Elevada Prevalencia de Infección por Genotipos de Alto Riesgo del Virus del Papiloma Humano detectada con la Genotipificación Completa en Mujeres que se atienden en un Hospital Universitario
Premio Mejor Trabajo Libre de Ginecología Congreso FASGO Posadas, Misiones 2025
Autores:
Fleider, Laura1; Tinnirello, María1, Gallo Vaulet, Lucía2,3; Toledano, Analia2,3 Giarmana, Julieta1; Puñal, Agustina1; García Kamermann, Florencia5; Cardinal, Lucia5; Ortiz, Javier1; Rodriguez Fermepin, Marcelo2,4
I. INTRODUCCIÓN
El carcinoma de cuello uterino (CCU) es el cuarto tumor maligno en frecuencia en las mujeres a nivel mundial1. En Argentina, cada año se diagnostican alrededor de 4500 casos nuevos y mueren cerca de 2300 mujeres a causa de esta enfermedad2.
Asimismo, es uno de los tumores con mayor potencial de prevención. La prueba de Papanicolaou, descripta por el Dr. George Papanicolaou a mediados del siglo XX, fue la primera prueba de prevención secundaria del CCU; consiste en la evaluación microscópica de las células cervicales exfoliadas para detectar cambios morfológicos indicativos de lesiones intraepiteliales y neoplásicas. En los países donde la detección basada en la citología se ha implementado de manera efectiva, la incidencia y mortalidad por CCU han disminuido significativamente debido a la detección y el tratamiento oportunos de sus lesiones precursoras.
Sin embargo, la prueba de Papanicolaou tiene una serie de limitaciones bien conocidas, su sensibilidad es moderada para la detección de las lesiones intraepiteliales de alto grado (CIN 2, CIN3), adenocarcinoma in situ y cáncer; tal vez debido a la escasez de células exfoliadas que se obtienen de la zona de transformacion3. Por lo tanto, la citología debe ser repetida sistemáticamente para lograr una efectividad programática significativa. Como consecuencia, las tasas anuales de adenocarcinoma no han disminuido significativamente en la mayoría de los países e incluso han aumentado en algunos de ellos en las últimas décadas4-5-6. Otra de las limitaciones de la prueba de Papanicolaou se debe en parte a su naturaleza subjetiva. Como consecuencia, solo tiene una reproducibilidad de regular a mala (índice de kappa bajo)7.
Además, debido a su naturaleza laboriosa, el número de muestras que un patólogo puede evaluar por día es limitado, por lo que en el contexto de un laboratorio con un alto volumen de muestras se necesita de un mayor número de patólogos especialistas en citología para satisfacer la demanda del centro. Por lo tanto, para lograr pruebas de Papanicolaou de alta calidad, se requieren inversiones significativas en infraestructura y amplias medidas de control de calidad. Incluso con las limitaciones de la prueba de Papanicolaou, la literatura indica que la presencia de CIN 2 o mayor (CIN2+) histológico, puede ocurrir en el 5 al 22% de los pacientes con un diagnóstico citológico de ASC-US (Atypical Squamous cells of undetermined significance)8-9-10, y en el 9 al 30% de que tengan un diagnóstico citológico de LSIL (Low-grade Squamous Intraepithelial Lesions)11.
En las áreas que el tamizaje se realiza únicamente con citología la carga de enfermedad sigue siendo importante debido a la dificultad en la ejecución de los programas de tamizaje basados en la citología. Los principales obstáculos inherentes a áreas de bajos recursos son la pobreza que se acompaña por falta de infraestructura sanitaria, bajo nivel de educación y dificultades para concurrir a centros de atención médica.
Las pruebas que detectan al Virus del Papiloma Humano (VPH) de alto riesgo (VPH-ar) son más sensibles12-13-14-15 y confiables16-17, que la citología para la detección del carcinoma cervical y sus lesiones precursoras. Es importante destacar que una prueba de VPH-ar negativa tiene un alto valor predictivo negativo (VPN), lo que permitiría ampliar los intervalos entre pruebas de tamizaje de manera segura. Una sola ronda de pruebas de VPH-ar fue más efectiva que la citología para reducir la incidencia de cáncer cervical en 6,5 años18 y para reducir la mortalidad por cáncer cervical en 8 años19.
La prueba de VPH-ar tiene una utilidad fundamental como prueba de tamizaje por su alto VPN, las decisiones clínicas no se deben tomar en base a un resultado positivo para VPH-ar porque la mayoría de las mujeres con esta condición no desarrollaran carcinoma cervical o lesiones precursoras, sin embargo, se encuentran en un grupo de alto riesgo, pasible de un seguimiento estricto.
El grupo de mujeres menores a 25 años presenta una tasa elevada de pruebas positivas debido a la mayor incidencia de infecciones transitorias, que no tienen significado clínico, por lo cual se las llama “falsos positivos”. Las estimaciones de sensibilidad y especificidad están fuertemente influenciadas por el seguimiento de los resultados anormales20.
Cuatro estudios clínicos aleatorizados (n> 250000 mujeres) compararon el tamizaje con la prueba de VPH-ar solo versus la citología sola: New Technologies for Cervical Cancer (NTCC) Phase II trial 21-22 en Italia, the HPV for Cervical Cancer Screening (HPV FOCAL) trial en Canadá23, el ensayo FINNISH en Finlandia24 y el ensayo Compass en Australia25. Los 4 ensayos encontraron que la prueba de VPH- ar sola condujo a un aumento en la tasa de detección de CIN3 en comparación con la citología sola en la primera ronda de detección.
La detección de ADN de VPH-ar identifica a aquellas mujeres en riesgo de desarrollar lesiones intraepiteliales de alto grado y cáncer cervical. Las agencias reguladoras en salud aprueban las pruebas de ADN/VPH como herramienta de tamizaje primario en las mujeres mayores de 30 años (para los test que no genotipifican) y desde los 25 años (para aquellos que genotipifican).
El Programa Nacional de Prevención de Cáncer Cervicouterino (PNPCC) de Argentina ha incorporado los métodos de biología molecular, basados en la detección de ADN del VPH, como pruebas de tamizaje primario a todas las mujeres a partir de los 30 años.
Sin embargo, bajo el paradigma que la infección por el VPH es la causa necesaria para el desarrollo del carcinoma cervical y sus lesiones precursoras, cofactores como la coinfección por el Virus de la Inmunodeficiencia Humana (VIH), Chlamydia Trachomatis (CT), por el Virus del Herpes Simplex (VHS) y la disbiosis vaginal, entre otros, favorecen la adquisición de la infección por VPH, su persistencia y el eventual avance al cáncer cervical26.
Actuales avances en la prevención primaria y secundaria (desarrollo de vacunas profilácticas para tipos de alto riesgo oncogénico y pruebas que permitan detectar las pacientes infectadas por VPH) han permitido desarrollar estrategias altamente costo efectivas en la prevención del carcinoma cervical.
La implementación de las pruebas de VPH conduce a promover el diagnóstico precoz del CCU con una sensibilidad muy superior a la del Papanicolaou y se los utiliza como método de tamizaje primario, para luego, en las pacientes infectadas que son las que están verdaderamente en riesgo de desarrollar CCU, utilizar un método de triage como la citología, los métodos que detectan integración viral (p16/Ki67, metilación, medición de ARNm de E6/E/7 de los VPH-ar) y la colposcopia para detectar HSIL y cáncer cervical.
El PNPCC del Ministerio de Salud de la Nación ha incluido las pruebas moleculares como técnica de tamizaje primario en el año 2011, utilizando a la citología como triage de aquellas pacientes positivas.
La Estrategia de la Organización Mundial de la Salud para la Eliminación del Cáncer del Cuello 27 propuesta en el año 2018 recomienda un enfoque integral para prevenir y controlar el CCU. Entre las acciones recomendadas para el año 2030, se incluyen intervenciones a lo largo de la vida, conocidas como la meta 90 -70-90 (Tabla I):
Tabla I: Estrategia de la OMS para la eliminación del CCU
|
90% de las niñas vacunadas a los 11 años |
|
70% de las mujeres tamizadas con un test de alta calidad entre los 35 y 45 años |
|
90% de las mujeres con lesiones intraepiteliales y cáncer, reciban el tratamiento adecuado |
II. ANTECEDENTES
1. VIRUS DEL PAPILOMA HUMANO Y CANCER DE CUELLO UTERINO
La relación entre el CCU y el VPH fue propuesta a principios de los años 80 por Harald zur Hausen28-29. Años más tarde, por métodos de biología molecular se detectó la presencia de ADN del VPH en el 99.7% de los mismos30
El desarrollo de la tecnología y la colaboración de distintos campos interdisciplinarios, permitieron probar la existencia de ADN del VPH en muestras celulares, no sólo de cáncer de cuello uterino, sino también cáncer vulvar, vaginal, anal, perianal, peneano y orofaringeo31
Se sabe que a pesar que la infección por VPH es el factor etiológico del CCU, necesita de cofactores para su desarrollo, entre los cuales podemos citar a coinfecciones con otros patógenos como el VIH, HSV, CT, factores genéticos, inmunológicos y factores propios del huésped que facilitan el contagio, la entrada y persistencia del VPH al núcleo de las células de las capas basales del epitelio, con su consecuente integración genómica y evolución al cáncer32
La persistencia viral es un paso decisivo en la transformación maligna; al permitir la integración del VPH y sobreexpresión de las oncoproteínas E6 y E7, capaces de interferir con el normal funcionamiento de las proteínas p53 y pRB de la célula huésped.
Desde un punto de vista clínico, la persistencia del VPH en las células del epitelio cervical resulta en el desarrollo de lesiones intraepiteliales del cuello uterino, que ocurren con mayor frecuencia en mujeres jóvenes, con una edad promedio de 20 a 30 años. Un alto porcentaje de ellas desarrollará lesiones intraepiteliales de alto grado, debiendo ser tratadas mediante técnicas quirúrgicas para evitar su transformación maligna.
La incorporación de métodos de diagnóstico cito-histológicos y moleculares para la prevención secundaria, permiten en la actualidad la detección de lesiones precursoras, y el tratamiento precoz reduce el impacto.
En la Argentina contamos con la prevención secundaria a través del Papanicolaou y se encuentra implementada en algunas regiones la prueba de VPH como test primario de tamizaje en las mujeres entre 30 y 64 años; a su vez contamos con la prevención primaria a través de la vacuna profiláctica, incluida dentro del Programa Nacional de Control de Enfermedades Inmunoprevenibles desde enero de 2011 para todas las niñas nacidas a partir del 1° de enero del año 2000 y en enero de 2015 se incorporaron a los niños de 11 años nacidos a partir del 1° de enero del 2006.
Según estadísticas de la Organización Mundial de la Salud (OMS) para el año 2020, el cáncer invasor de cuello uterino es la primer causa de muerte por cáncer en las mujeres entre 15 y 44 años en la Argentina2 En los últimos años se ha observado un notable incremento en la prevalencia de las lesiones vinculadas a la infección por VPH, tanto de condilomas acuminados, como de lesiones intraepiteliales y cánceres.
El VPH es un virus que pertenece a la familia Papillomaviridae, cuyo genoma es ADN de doble cadena circular (Figura 1) e infecta a piel y mucosas, representando en la actualidad la infección de transmisión sexual más frecuente en el mundo.
Figura 1. Organización genómica del VPH1633
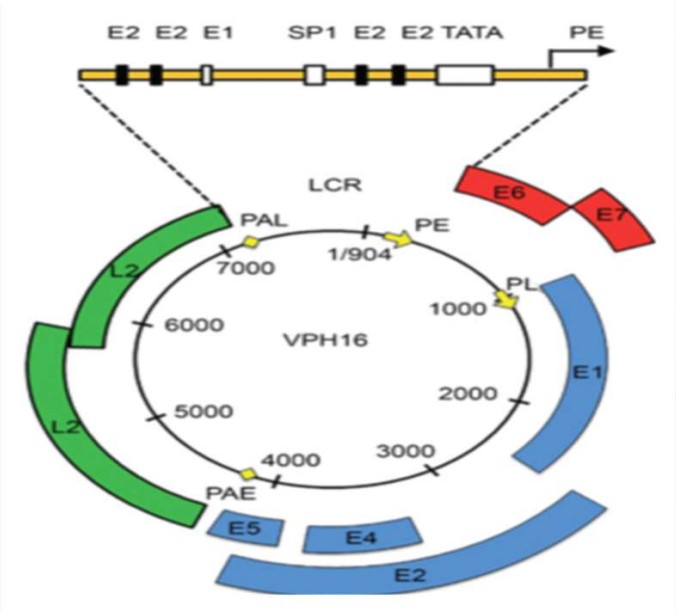
Desde hace más de 2 décadas se sabe que el 80% de las mujeres se infectan por VPH durante su vida, algo más del 50% lo hace en los primeros 5 años de iniciadas sus relaciones sexuales; siendo la duración media de la infección de 12 meses aproximadamente, pudiendo ser de mayor tiempo cuando los tipos involucrados son VPH 16 y 1834. Las mujeres infectadas, que presentan persistencia viral constituyen un grupo de riesgo para desarrollar cáncer cervical35. Los tipos de VPH con mayor índice de persistencia y por ende más frecuentes en el cáncer cervical son el 16, 18, 45, 31, 33, 52, 58 y 35. Los tipos 16, 18, 31, 33 y 45; son la causa de aproximadamente el 95% de los CCU36.
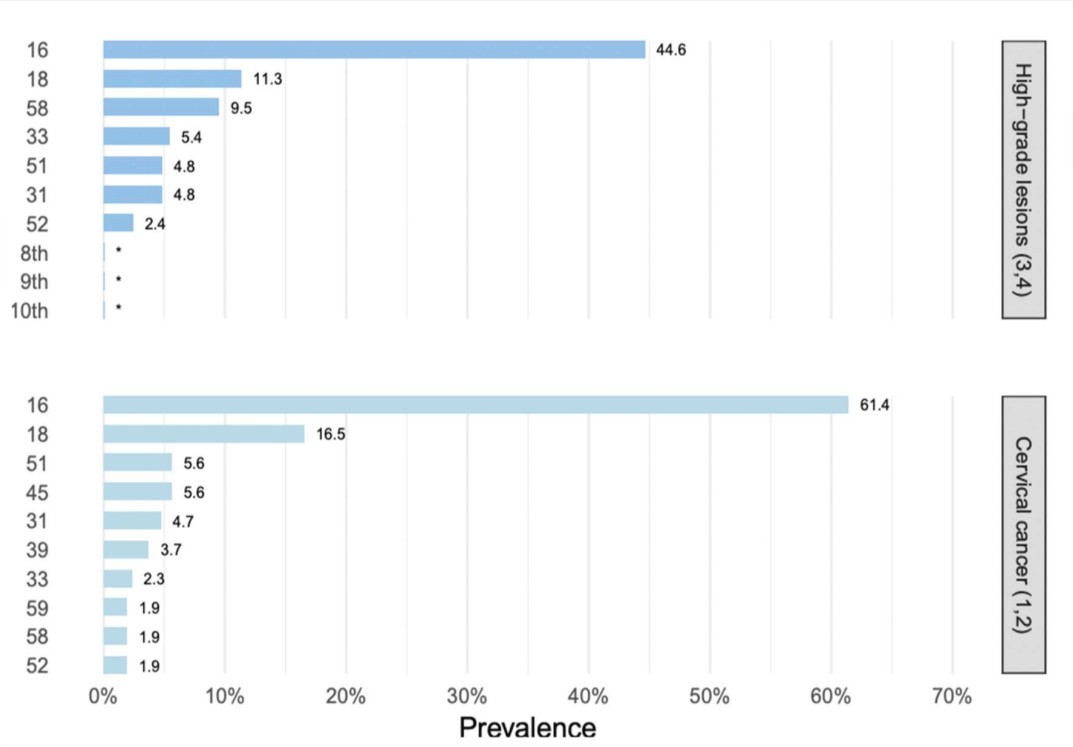
En Argentina, según la última actualización realizada en el año 2023; los tipos de VPH 16 y 18 se encuentran en el 61,4% y 16,5% respectivamente; seguidos en orden de frecuencia por los tipos 45, 51, 31, 39, 33, 59, 52 y 582. En la figura 2 podemos ver los tipos de VPH más frecuentes en CIN3 y el CCU en Argentina2
Figura 2. tipos de VPH más frecuentes en CIN3 y el CCU en Argentina2
Actualmente se puede detectar la infección por VPH mediante técnicas moleculares que detectan ADN o ARN viral, por lo que desde hace varios años se comenzó a proponer su implementación en el tamizaje. La mayoría de los métodos moleculares disponibles para el diagnóstico de infección por VPH se basan en el análisis de ADN (detección del ADN del genoma viral), el cual permite demostrar la presencia del virus; pero poco dice acerca de su integración. Estos métodos que detectan ADN son mucho más sensibles, pero menos específicos que la citología en la detección de lesiones intraepiteliales de alto grado (HSIL) y del cáncer cervical, tanto escamoso como glandular37-38.
Entre las pruebas moleculares que se disponen actualmente para la detección de ADN del VPH, las más utilizadas son PCR (Reacción en Cadena de la Polimerasa) y Captura de Híbridos tipo 2 (CH II); con muy buena sensibilidad.
Otras pruebas detectan ARN mensajero (ARNm) de las oncoproteínas E6/E7, estas técnicas tienen mayor especificidad, ya que estas proteínas sólo se expresan una vez que el VPH se ha integrado al genoma de la célula huésped, pero menor sensibilidad, ya que detectan el ARNm de unos pocos tipos de VPH39-40-41.
2. EPIDEMIOLOGIA DEL CÁNCER DE CUELLO UTERINO EN EL MUNDO
La mortalidad global por CCU destaca las desigualdades de nuestro tiempo en la riqueza, el género y el acceso a los servicios de salud. Las mujeres en todo el mundo están expuestas al VPH, sin embargo, son principalmente las mujeres en el mundo en desarrollo las que tienen poco o ningún acceso a la detección precoz y el tratamiento y son las que más posibilidades tienen de morir a causa de las consecuencias de este virus.
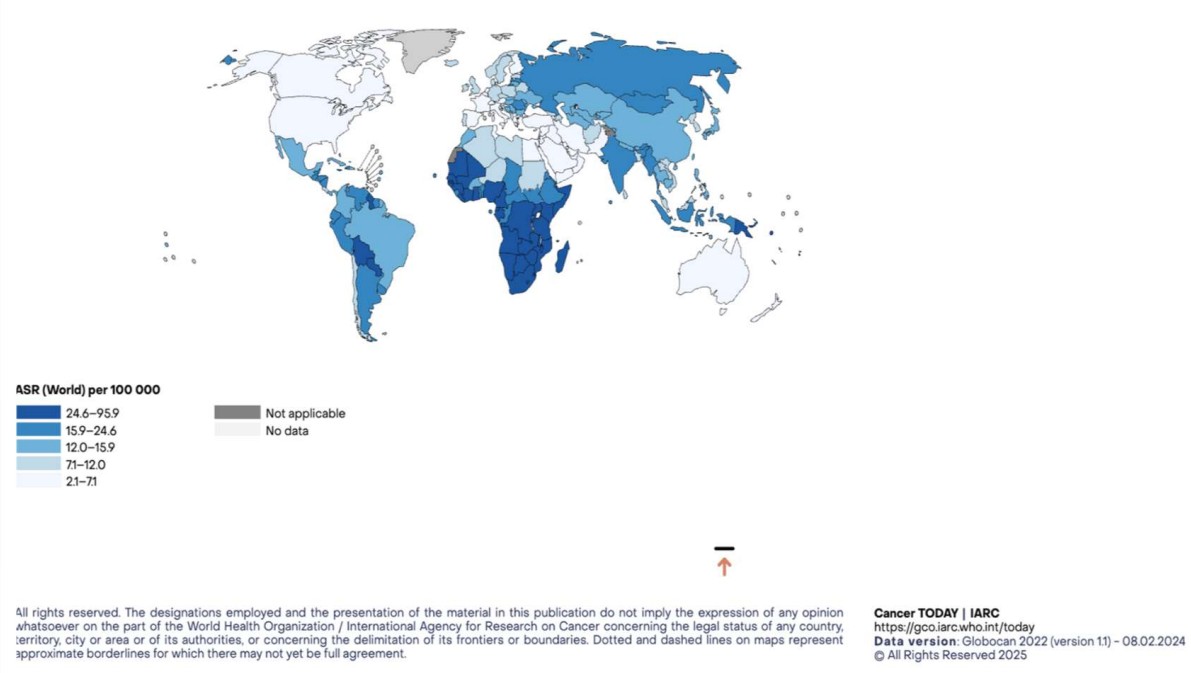
Hoy en día, el cáncer de cuello uterino es el segundo cáncer más común entre las mujeres en el mundo en desarrollo, y la principal causa de muerte por cáncer. Según estadísticas presentadas en GLOBOCAN, para el año 2022 se diagnosticaron 604.127 casos de CCU en el mundo42 (Figura 3) y cerca de 341.831 muertes. La gran mayoría de estas muertes ocurren en los países en desarrollo, o en comunidades desfavorecidas.
Figura 3. Tasas estandarizadas por edad x 100.000 mujeres de incidencia de CCU42
Durante las últimas décadas, hemos asistido a una caída constante de tasas de incidencia y mortalidad por cáncer de cuello uterino en los países de ingresos altos. Las tecnologías de detección y tratamiento tempranos eficaces han impulsado estas reducciones, lo que permite a los médicos detectar y eliminar las anomalías del cuello del útero antes de desarrollar cáncer invasor.
Después de décadas de esfuerzos para aplicar las estrategias de los países de altos ingresos, los países menos desarrollados todavía están luchando para encontrar una respuesta eficaz. Mientras tanto, la enfermedad continúa creciendo, avivado por el incremento en la esperanza de vida y el crecimiento de la población. La pérdida de estas mujeres-madres, hijas, hermanas, esposas, socias, y amigas es casi totalmente prevenible43-44.
3. EPIDEMIOLOGIA DEL CANCER DE CUELLO UTERINO EN LA ARGENTINA
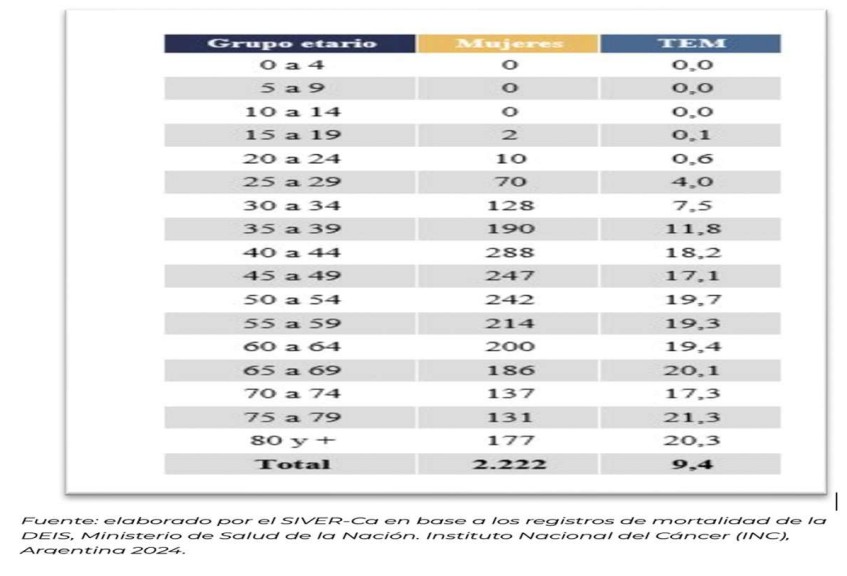
En 2022 se registró una mortalidad por CCU de 9,4 defunciones por 100.000 mujeres en la Argentina45. A partir de los 25 años se registra un aumento de las defunciones con tasas que alcanzan valores de 18,2 cada 100.00 mujeres a partir de los 40 años, alcanzando los valores más altos en mujeres de 65 y 69 años (20,1 cada 100.000 mujeres) y en mayores de 75 años (21,3 cada 100.000 mujeres) (Figura 4).
Figura 4. Defunciones por cáncer de cervicouterino y tasas específicas de mortalidad (TEM) por 100.000 mujeres según grupo etario. Argentina 2022 45
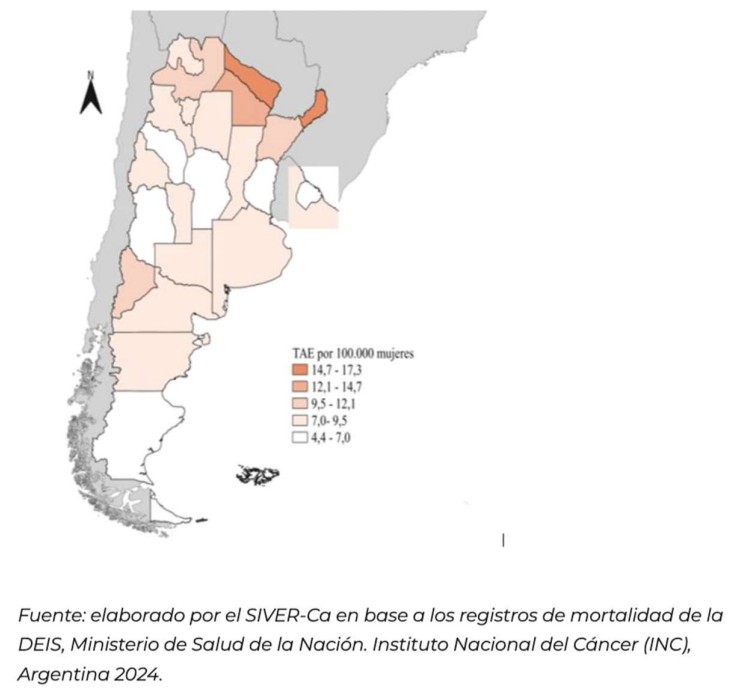
Las provincias de Misiones y Formosa se encontraron en el quintil más alto de mortalidad por cáncer cervicouterino (TAE: entre 14,7 - 17,3).
Por otro lado, en el quintil más bajo se ubicaron las jurisdicciones de La Rioja, Mendoza, CABA, Córdoba, Entre Ríos y San Cruz, (TAE: 4,4 - 7,0 defunciones cada 100.000 mujeres) (Figura 5)45.
Figura 5. Mortalidad por cáncer cervicouterino en mujeres según jurisdicciones. Tasas ajustadas por edad por 100.000 mujeres agrupadas en quintiles de mortalidad. Argentina, 202245.
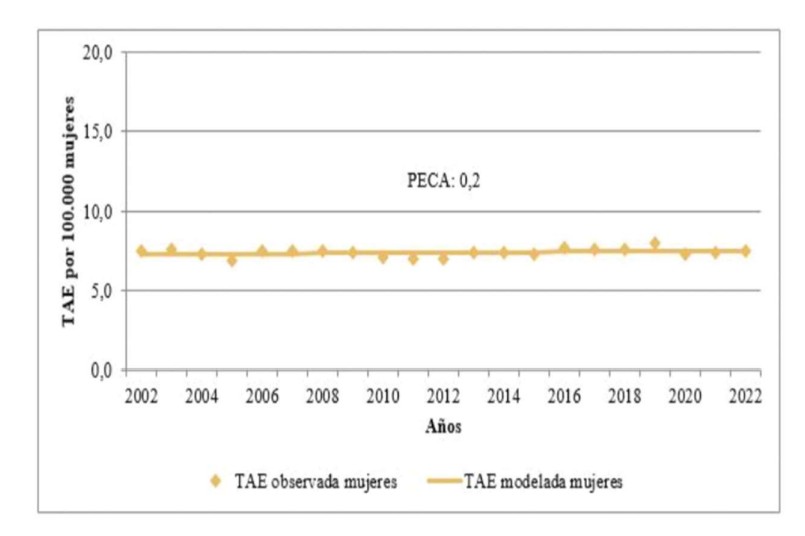
Respecto de la tendencia de la mortalidad a lo largo del período 2002-2021 mostró un aumento sostenido a una velocidad de 0,2% anual, el cual no resultó significativo (Figura 6)45
Figura 6. Tendencia y porcentaje de cambio estimado anual en la mortalidad por cáncer cervicouterino. Tasas ajustadas por edad según población mundial por 100.000 mujeres. Argentina, 2002-2022.45
En la Argentina, el Ministerio de Salud de la Nación ha aprobado la incorporación de la prueba de VPH como método de tamizaje primario para la prevención del CCU. En el año 2011, el Programa Nacional de Prevención del Cáncer Cérvico-uterino (PNPCCU), dependiente del Instituto Nacional del Cáncer (INC), comenzó la introducción de la prueba de VPH mediante un proyecto demostración en la provincia de Jujuy. Luego de tres años de implementación del proyecto, quedó demostrado que esta nueva tecnología duplicó la capacidad de detección de lesiones precancerosas y cáncer. A partir de estos buenos resultados obtenidos en la provincia de Jujuy, en los años 2014 y 2015 se incorporaron cinco nuevas provincias al tamizaje basado en la prueba de VPH (Catamarca, Neuquén, Misiones, Tucumán, y tres partidos de la Provincia de Buenos Aires). En los años subsiguientes se han ido incorporando otras provincias y el Gran Buenos Aires.46
Asimismo, durante los años 2012 y 2013 el Ministerio de Salud de la Nación, en conjunto con el Ministerio de Salud de la provincia de Jujuy y la Agencia Internacional de Investigación en Cáncer (IARC), llevó adelante el Proyecto EMA, un estudio randomizado cuyo objetivo principal ha sido evaluar la efectividad de la autototoma para el aumento de la cobertura y su efectividad para la detección del lesiones CIN2+. Los resultados de dicho estudio mostraron que con la autotoma se logró aumentar cuatro veces la cantidad de mujeres tamizadas y la tasa de detección de lesiones CIN2+ fue superior a la obtenida con el PAP durante el 2011. A partir de los resultados obtenidos en este estudio, las provincias de Jujuy y Tucumán incorporaron la autotoma al tamizaje programático en los años 2014 y 2015 respectivamente47.
El PNPCCU elaboró una primera versión de las recomendaciones con el objetivo de establecer los criterios de acción para el tamizaje, seguimiento y tratamiento de mujeres para la prevención del CCU en contextos de tamizaje con la prueba de VPH. En el año 2015, a partir de la incorporación de nuevas provincias al tamizaje con dicha estrategia y de la introducción de la autotoma al tamizaje programático, se evaluó la necesidad de actualizar el documento. Para ello, se revisó la nueva evidencia científica acerca del tamizaje con test de VPH en ambas modalidades (toma convencional y autotoma) y se analizaron las guías programáticas.
4. HISTORIA NATURAL DE LA INFECCION POR VPH
La Historia Natural de una enfermedad pasa por cuatro etapas sucesivas:
- Comienzo biológico. No la detectamos, pero está
- Diagnóstico precoz posible (DPP). No hay síntomas, pero si hay cambios estructurales o funcionales que se pueden poner de manifiesto con las pruebas
- Diagnóstico clínico usual (DCU). Aparecen los síntomas, el individuo enferma y solicita ayuda.
- La enfermedad llega a su “resultado”: recuperación, incapacidad o muerte.
Hutchinson describió hace más de 40 años el concepto de punto crítico y sería aquel punto de la evolución de la enfermedad antes del cual el tratamiento es más efectivo o más fácil de aplicar que más tarde.
Al iniciar su actividad sexual, la mujer puede contraer una infección por VPH de alto riesgo, que en la gran mayoría de los casos dará lugar a una infección transitoria, haciéndose indetectable en 6-12 meses34. Cualquier variable ligada a la actividad sexual, incluyendo la edad joven, el número de parejas sexuales, parejas sexuales recientes y tener relaciones sexuales con parejas que tienen otras parejas sexuales, incluyendo tanto a hombres y mujeres, es un factor de riesgo para la infección genital por el VPH.
Los estudios retrospectivos demuestran que la infección cervical persistente por VPH de alto riesgo precede a la aparición de las lesiones intraepiteliales cervicales y es necesaria para el desarrollo, mantenimiento y progresión de estas lesiones.
Es necesaria una microabrasión del epitelio para que el VPH infecte las células basales del epitelio estratificado del tracto genital inferior, especialmente en la Zona de Transformación. Los estudios de prevalencia e incidencia de infecciones detectadas durante seguimientos longitudinales de mujeres jóvenes muestran que la mayoría de las infecciones por VPH cervical son benignas y se resuelven espontáneamente, sin la necesidad de una intervención médica48.
Ocasionalmente, esta infección desarrollará lesiones intraepiteliales, que se resuelven espontáneamente en la mayoría de los casos. Cuando el virus no es eliminado y persiste la infección por VPH de alto riesgo, la lesión precursora se mantiene y tiene altas posibilidades de progresar a cáncer invasor49 En la Figura 7 podemos ver un esquema de la progresión de la infección por VPH al CCU.
Figura 7. Progresión al cáncer mediada por el VPH49

El paso previo a la invasión sería el HSIL, que ocurre en mujeres jóvenes con una edad media de 28 años. En ocasiones, los tratamientos escicionales que se realizan en estas pacientes para prevenir el cáncer las expone a alteraciones de la fertilidad.
A diferencia de los VPH de bajo riesgo, los cuales permanecen en el núcleo de la célula infectada en estado episomal, los VPH-ar ejercen su actividad oncogénica, aunque no exclusivamente, tras integrarse en el genoma celular. El mecanismo mejor conocido de inducción neoplásica por VPH se produciría a partir de la síntesis de las proteínas virales E6 y E7. Estas proteínas se ligan a las proteínas producidas por los genes supresores de tumores p53 y pRb respectivamente, alterando su función. Esta interacción en células proliferativas, como son las del cuello uterino y especialmente de la zona de unión escamo-cilíndrica con un epitelio inestable, impide la correcta reparación del ADN, conduce a una inestabilidad genómica y aumenta la probabilidad de desarrollar mutaciones específicas, esenciales para la progresión al cáncer invasor50.
Varios cofactores se han asociado a la persistencia de la infección por VPH en el cuello de útero, todos ellos han sido estudiados y su asociación con la persistencia viral ha sido establecida, entre ellos citamos el tabaquismo, los anticonceptivos orales a largo plazo, la multiparidad, infección por VIH, herpes simplex, chlamyidia trachomatis, disbiosis e inmunocompromiso entre otros51,52,53,54,55,56, pero el genotipo del VPH sigue siendo el mejor predictor de riesgo para la progresión de la enfermedad.
Jacobs y Walboomers57 en un trabajo sobre 3305 extendidos normales de Papanicolaou, detectaron un pico de prevalencia para todos los tipos de VPH de 19,6% en mujeres de 25 a 29 años, que disminuyó a 4,3% en mujeres mayores de 30 años. Las mujeres mayores tienen un riesgo menor de adquirir infecciones nuevas por VPH que las más jóvenes. La alta incidencia y la corta duración son las características representativas de la infección por VPH en la mujer joven. Mujeres con extendidos de Papanicolaou normales y ADN de VPH de alto riesgo, tenían un riesgo 116 veces mayor de desarrollar una lesión intraepitelial de alto grado. El factor clave es la persistencia viral58.
Nobbenhuis y col59, en el seguimiento de 353 pacientes con diagnóstico de discariosis moderada a severa, detectaron que las 33 pacientes que presentaron progresión clínica también presentaban infección persistente por VPH de alto riesgo, mientras que no se detectó progresión en las pacientes que tenían test negativo para VPH.
No es posible monitorizar la latencia de una infección a través de marcadores inmunológicos específicos, ya que una proporción significativa de las mujeres infectadas por el VPH no desarrollan anticuerpos detectables VPH específicos. No se entiende bien el motivo por el cual algunas mujeres desarrollan anticuerpos y otros no. Desde una perspectiva práctica, esta observación hace que sea poco probable que un examen de sangre que pueda detectar infección por VPH esté alguna vez disponible. El VPH tiene mecanismos de evasión inmune, que hacen factible su persistencia a través de los años, integración y desarrollo de cáncer.
La utilidad de las pruebas de detección viene dada por la ubicación del punto crítico en la Historia Natural de la enfermedad. Sólo que el punto crítico se encuentre entre el diagnóstico precoz posible (DPP) y el diagnóstico clínico usual (DCU) la enfermedad es vulnerable a la detección oportuna60. El CCU cumple con estos requisitos para el diagnóstico precoz.
5. PREVENCION PRIMARIA DEL CANCER DE CUELLO UTERINO
La vacunación profiláctica contra el VPH es la mejor estrategia de prevención primaria. Producidas por tecnología recombinante, se las conoce como VLP-L1 (Virus Like Particles: partículas similares al virus), debido a que son autoensamblajes de la proteína L1 de la cápside viral; es decir que poseen la misma actividad antigénica que el virus, sin propiedades carcinogénicas64-65-66.
Para ser efectivas, las mismas deben generar una respuesta inmune humoral en la superficie de la mucosa genital, capaz de reconocer e inactivar al VPH antes que infecte a las células epiteliales del huésped.
Protocolos de investigación, desarrollaron 3 vacunas profilácticas; dos de ellas previenen la infección hacia los tipos oncogénios 16 y 18 y posteriormente la vacuna nonavalente incluye en su fórmula a 5 tipos mas61-62-63
- Vacuna contra VPH 16 y 18 (vacuna bivalente HPV 16/18 VLP) (Cervarix™; GlaxoSmithKline, Rixensart, Belgium)
- Vacuna contra VPH 6, 11, 16, y 18 (vacuna cuadrivalente contra VPH 6/11/16/18 VLP) (Gardasil™; Merck & Co, Inc, Whitehouse Station, New Jersey)
- Vacuna contra VPH 6, 11, 16, 18, 31, 33, 45, 52 y 58 (vacuna nonavalente contra VPH 6/11/16/18/31/33/45/52/58 VLP) (Gardasil9™; Merck & Co, Inc, Whitehouse Station, New Jersey)
Dichas vacunas fueron aprobadas por ANMAT: la vacuna cuadrivalente en el año 2006; la vacuna bivalente en el año 2007 y la vacuna nonavalente en el año 2019.
Actualmente la vacuna bivalente ha dejado de comercializarse y la vacuna nonavalente se encuentra disponible en Argentina desde el mes de noviembre de 2022.
Las VLP son morfológicamente idénticas al VPH; por lo que el organismo produce anticuerpos neutralizantes y tipo-específicos, diseñados especialmente para cada tipo de VPH incluido en la vacuna. Gracias a ello son altamente efectivas en la producción de una respuesta inmune humoral por parte del huésped. Y como no contienen ADN de la región oncogénica del VPH, no producen infección ni cáncer67.
Para lograr los máximos beneficios de prevención que otorga la vacuna, es necesario vacunar a una edad temprana, idealmente antes del inicio de una vida sexual activa. La vacunación profiláctica contra el VPH está disponible actualmente en Argentina e incluida dentro del Programa Nacional de Enfermedades Inmunoprevenibles para ser aplicada a todas las niñas nacidas a partir del 1ro de enero del año 2000 y los niños nacidos a partir del 1ro de enero del año 200668, sin embargo, transcurrirán varios años antes que se aprecie una disminución de la incidencia del cáncer cervical y sus lesiones precursoras.
6. PREVENCIÓN SECUNDARIA DEL CANCER DE CUELLO UTERINO
La prevención secundaria es el diagnóstico preclínico del cáncer; y se conoce como tamizaje o cribado. Definimos tamizaje a la aplicación de una prueba cuya finalidad es detectar una enfermedad o condición potencial en una persona sin síntomas conocidos de esa enfermedad o condición.
El objetivo de la prevención secundaria mediante el tamizaje es la detección de las lesiones intraepiteliales de alto grado (CIN 2-3), cáncer microinvasor y adenocarcinoma in situ, para poder realizar un tratamiento temprano y disminuir la incidencia y mortalidad por cáncer cervical.
Una técnica de tamizaje no es una técnica diagnóstica y debe cumplir los siguientes criterios: ser simple, aceptable, no dolorosa, segura, validada y económica. Hay varios pre-requisitos para que un programa de tamizaje sea exitoso. Los más conocidos fueron publicados por Wilson y Jungner en 1968, y son válidos actualmente69. Estos criterios incluyen:
- La condición buscada debería ser un importante problema de salud
- Debería existir un tratamiento aceptable para las pacientes con esa enfermedad
- El diagnóstico y tratamiento deberían ser accesibles
- Debería tener un estado latente o de síntomas tempranos
- Debería tener un test o examen apropiado
- El test debe ser aceptado por la población
- La historia natural de la enfermedad debería ser comprendida adecuadamente
- Debería haber un acuerdo sobre quienes considerar como pacientes
- El costo debería ser económico, incluyendo los gastos del cuidado médico
El hallazgo de casos debería ser un proceso continuo y no una sola vez para todo el proyecto.
El tamizaje se puede realizar desde dos estrategias distintas. Una es la llamada de catastro: aquí se realizan pruebas a personas del público general con el objetivo de identificar aquellas que tienen más chance de padecer determinada enfermedad y luego de identificada se la estudia definitivamente (tamizaje de masas o más screening). La segunda estrategia se basa en que el médico es visitado con frecuencia y esta es una buena oportunidad para realizarle una prueba independiente del motivo de consulta. A esta estrategia se la conoce como búsqueda de casos (case finding).
Por último, debemos decir que el tamizaje en realidad no hace el diagnóstico, sino que selecciona una población a la que se le realizarán otras pruebas más específicas para confirmar la sospecha (triage). Esta sutil diferencia es la que hay entre tamizaje y diagnóstico precoz70.
Analicemos ahora cómo seleccionar una prueba que detecte la enfermedad en su periodo asintomático. La confiabilidad de la prueba vendrá dada por la precisión y exactitud, así como por la reproducibilidad, validez y valor de predicción. De estos parámetros cobran mayor jerarquía la validez que estará compuesta por la sensibilidad, la especificidad y el valor predictivo.
La sensibilidad de una prueba reside en su capacidad para detectar la presencia de un cáncer existente o lesión precancerosa y se define como la proporción de personas afectadas con resultado de la prueba positivo.
La especificidad es la exactitud con que una prueba demuestra la ausencia de un cáncer o lesión precursora inexistente y se define como la proporción de personas no afectadas con resultado de la prueba negativo.
Una prueba de baja sensibilidad producirá falsa tranquilidad y pérdida de recursos en la detección. Una prueba de baja especificidad provocará falsos positivos y por lo tanto alarma innecesaria, ansiedad y pérdida de recursos en investigaciones ulteriores además de posible iatrogenia.
Con respecto a la sensibilidad deberemos tener en cuenta además que en general no contamos con el número de personas con prueba negativa que realmente no tienen la afección ya que estas personas no se estudian ulteriormente. Por lo tanto, se dispone de más información acerca del valor predictivo positivo de una prueba. Este valor es la probabilidad de que un resultado positivo sea confirmado en estudios ulteriores y se define como la proporción de personas con resultado positivo y que realmente están afectadas.
Las nuevas pruebas de VPH en general y las que genotipifican en particular acorde al estudio VALGENT evalúan los resultados clínicos relevantes de los mismos para recomendar su aplicación clínica bajo evidencia científica71
6.1. CITOLOGÍA
El descubrimiento de las lesiones precancerosas y la posibilidad de detectar estas lesiones con una simple prueba citológica fue descubierto por George Papanicolaou, medico griego, y es reconocido como uno de los avances más significativos en el control del cáncer del siglo XX72
El Papanicolaou detecta cambios inflamatorios, infecciosos o la presencia de células anormales y neoplásicas. De la citología cervical no debe esperarse un diagnóstico sino un resultado, normal o anormal. Las citologías anormales detectan mujeres potencialmente afectadas por lesiones cervicales y necesitan estudiarse para confirmar el diagnóstico.
La prueba de Papanicolaou para el tamizaje de cáncer de cuello uterino fue reportado en 1928 y su eficacia fue probada en 1941. Desde entonces ha sido utilizado en todo el mundo como una herramienta clínica para la detección temprana del CCU. Para conseguir mediante el tamizaje citológico una disminución de la mortalidad por cáncer de cuello uterino, debe alcanzarse una cobertura mínima y continuada del 70% de la población. Los programas organizados de tamizaje poblacional mediante la citología han demostrado su efectividad al disminuir la incidencia y mortalidad por cáncer de cuello uterino en los países donde se han aplicado de forma masiva y sistemática. En los últimos 50 años el tamizaje citológico ha reducido la morbimortalidad por cáncer cervical en un 75-80%, en los países donde se ha aplicado con una estrategia poblacional con cobertura suficiente y continuada73.
Esto no ocurrió de igual manera en todos los países debido a que la prueba de Papanicolaou presenta limitaciones. Uno de los más importantes es que presenta alrededor de un 50% de falsos negativos debidos a inadecuación de la muestra lo que lleva a errores de interpretación. No obstante, el Papanicolaou presenta una especificidad cercana al 90% lo que revela un valor predictivo positivo elevado. Las citologías son interpretadas subjetivamente y no en forma automatizada y por lo tanto están sujetas a error.
A pesar de que muchas mujeres fallecidas por CCU nunca se realizaron un Papanicolaou, muchas de ellas recibieron un resultado negativo de esta prueba. Esto ocurre dado que la sensibilidad de la técnica es limitada por el error del muestreo (falta de células de la zona de transformación), error de interpretación donde pocas células anormales pasan desapercibidas entre tantas células normales en una muestra bien tomada en un frotis74
Otro problema asociado al Papanicolaou es la subjetividad en la interpretación de los resultados y los resultados inciertos; como los reportes de ASC US (células atípicas escamosas de significado incierto), ASC H (células atípicas de significado incierto, sugestivas de lesión de alto grado) y ACG (células glandulares de significado incierto), lo cual genera incertidumbre en el médico hacia la conducta a seguir. ASC US permanece como una entidad que se reporta en el 5-10% de los Papanicolaou75
Con el afán de lograr una mayor sensibilidad en el tamizaje por citología surgieron mejoras tales como citología en base líquida, pero no se ha observado un incremento de la sensibilidad contundente para que se realice en forma masiva76
6.2. COLPOSCOPIA
La colposcopía consiste en la visualización del cuello uterino y todo el tracto genital inferior mediante un microscopio binocular (12x a 16x) con una potente fuente de luz centrada sobre el campo de exploración, fue descripta por primera vez en 1924, consistiendo en un sistema de lentes binoculares con magnificación. En 1925 se hizo su primer reporte, pero luego mejoró la magnificación a 10x, 20x, 30x, y 40x, más la inclusión de un pie móvil y ajuste fino de la imagen.
En el año 1933, se publicó el libro “Introducción a la Colposcopía” donde se describieron los patrones asociados a las displasias del cuello uterino y más adelante se reportaron cambios en el epitelio relacionados al ácido acético (tornaba blancas las áreas anormales por la alta concentración de proteínas existentes) mientras se investigaba el uso de posibles agentes de contraste; tal como el lugol descubierto por Schiller. En 1938 se anunció que la utilización del colposcopio a gran escala profesional podría erradicar las muertes por cáncer de cuello uterino77 Permite identificar la topografía y extensión de las lesiones precancerosas, localizar las áreas más sospechosas donde practicar la toma de biopsia y planificar un tratamiento efectivo. Requiere una buena formación y experiencia del especialista. En el estudio LAMS la colposcopia fue utilizada en una de las ramas en forma simultánea con la citología a diferencia de otras ramas donde se realizaba colposcopia de referencia si había anormalidad en la citología y/o en la Captura
Hibrida para VPH. En la mayoría de los protocolos de tamizaje, la colposcopía suele ser referencial para arribar a un diagnóstico definitivo78.
El valor de la colposcopía como una técnica de tamizaje ha sido motivo de controversias. El problema del diagnóstico colposcópico reside en que las imágenes de las lesiones precursoras del cáncer cervical, como epitelios acetoblancos, mosaicos, puntillados, leucoplasias y áreas iodo negativas pueden confundirse con áreas de metaplasia inmadura, resultando, en consecuencia, en alta sensibilidad, pero pobre especificidad de la colposcopía como una herramienta de tamizaje. Por lo tanto, si no es realizada por un colposcopista experto con un adecuado entrenamiento se considera que no debe ser incluida como una técnica de tamizaje79
El diagnóstico colposcópico de las lesiones intraepiteliales del cuello uterino requiere conocer y saber reconocer las principales características de los cambios que se producen tras la infección por VPH, siendo muy útil guiarse con la nomenclatura de la clasificación de la Federación Internacional de Patología Cervical y Colposcopía (IFCPC) 201180. La colposcopia con biopsia dirigida se describe como el método de referencia o el patrón de oro para el diagnóstico de las lesiones cervicouterinas precancerosas. La coexistencia de características anormales en un área localizada de la zona de transformación aumenta la probabilidad de existencia de una lesión intraepitelial de alto grado.
Es obvio que se requiere una aptitud considerable para diferenciar entre las lesiones de bajo grado, la metaplasia escamosa inmadura y ciertas afecciones inflamatorias. La colposcopía nos permite tener una sospecha de existencia de alguna lesión, sin embargo, la biopsia del área sospechosa y el examen de los hallazgos histopatológicos con el anatomopatólogo confieren certeza diagnóstica.
La estrecha colaboración con el patólogo es insoslayable y útil para incrementar las propias aptitudes diagnósticas. Es esencial que el colposcopista tenga un adecuado entrenamiento para tomar biopsias de las zonas de mayor sospecha. La biopsia dirigida sigue siendo el método principal para detectar lesiones precancerosas que requieren tratamiento. La práctica basada en la evidencia recomienda tomar entre 2 y 4 biopsias de todas las áreas sospechosas.
En aquellas pacientes con una impresión colposcópica completamente normal, no se recomienda realizar biopsias al azar o no dirigidas.
3. MÉTODOS MOLECULARES
En la actualidad no existe un ensayo serológico confiable que permita diagnosticar la infección por VPH por medición de anticuerpos y el desarrollo de este ensayo tiene que enfrentar graves obstáculos. En primer lugar, el poco conocimiento que se tiene sobre los mecanismos de respuesta inmune del huésped a la infección y la evasión de esta respuesta por parte del virus. En segundo lugar, el hecho de no poder disponer de una proteína viral suficientemente antigénica en cantidades abundantes para desarrollar el ensayo; y por último la incapacidad de poder cultivar el virus in vitro, debido a que éste sólo prolifera en células diferenciadas permisivas y éstas no pueden mantenerse en cultivo81; por todo ello no podemos monitorizar la infección por VPH basados en la medición de anticuerpos.
- Detección de ADN-VPH
Puesto que el VPH (junto a cofactores) se considera el agente etiológico del CCU, y se ha establecido como el principal factor de riesgo en el desarrollo de esta enfermedad, surge la necesidad de disponer de ensayos que permitan el diagnóstico temprano de la infección por VPH82
Una aplicación potencial del diagnóstico molecular de la infección por VPH en el tamizaje primario es la autotoma. La posibilidad de un método de tamizaje no citológico, que no requiere la colocación de un espéculo vaginal, podría reducir el número de mujeres subdiagnosticadas que no tienen acceso a sistemas de salud. El método de la autotoma también podría aumentar el acceso a sistemas de tamizaje en regiones de escasos recursos donde existe un número limitado de personal entrenado en realizar exámenes vaginales83-86
La sensibilidad y la especificidad analíticas y clínicas de las técnicas de detección del VPH varían ampliamente. La sensibilidad analítica se refiere al número mínimo de los genomas virales por mililitro que contiene la toma, mientras que la sensibilidad clínica expresa la capacidad del test para detectar lesiones. Es necesario tener muy presente que los sistemas de detección de ADN de VPH con mucha sensibilidad analítica no aumentan necesariamente la detección de lesiones, puesto que la detección de una carga viral muy baja no está asociada con un mayor riesgo de lesiones intraepiteliales.
- Detección de transcriptos de ARNm
Una vez que la infección persistente por VPH de alto riesgo se establece en el epitelio cervical, la regulación transcripcional de los oncogenes E6 y E7 se ve alterada, conduciendo a la transformación maligna del epitelio. La medición de la sobreexpresión87 de estas oncoproteínas es útil como marcador de integración viral en la célula huésped y por lo tanto de riego a desarrollar cáncer de cuello uterino.
La detección de ARNm (ARN mensajero) E6/E7 puede ser muy útil como un marcador relacionado a la transformación maligna y podría ser usado como método alternativo a los ya existentes como la detección del genoma de VPH mediante ensayos de ADN. La presencia de ARNm de E6/E7 ha demostrado que incrementa la especificidad y el valor predictivo positivo en CIN 2 y CIN 3.
Se han realizado diferentes ensayos que han demostrado la detección de ARNm de E6/E7 con una sensibilidad ligeramente menor o igual a los ensayos de detección de ADN; pero con un notable aumento de la especificidad88-89
Los ARNm virales pueden ser detectados utilizando la tecnología de PCR a tiempo o por el método Nucleic Acid Sequence Based Amplification (NASBA). Teóricamente, la presencia de transcriptos de ARNm para las oncoproteínas E6 y E7 de VPH-ar debería predecir mejor el riesgo de infección persistente que la simple presencia de ADN de VPH. Existen kits comerciales que detectan transcriptos de ARNm de E6 y E7 de los VPH 16, 18, 31, 33 y 45.
- Determinación de oncoproteínas virales
Las oncoproteínas E6 y E7 son los principales efectores de la actividad oncogénica del VPH. La estructura molecular, las funciones y los niveles de expresión son diferentes entre los tipos de VPH oncogénicos y no oncogénicos90. E6 se expresa a niveles elevados en las células cervicales solo cuando las células cervicales infectadas con VPH sufren cambios precancerosos o cancerosos.
Una prueba de VPH E6, la prueba cervical OncoE6 dirigida a E6 HPV16 y HPV18 (anteriormente prueba Advantage HPV E6, dirigida a E6 HPV 16, 18 y 45) se ha utilizado en estudios en todo el mundo con resultados prometedores91,92,93.
En un estudio en Honduras, la sensibilidad de la prueba para detectar el precáncer relacionado con las infecciones por el VPH 16/18 fue del 96.8% (IC del 95%: 83.8% a 99.8%) y 56.4% (IC del 95%: 43.3% a 68.6%) independientemente del tipo de VPH y la especificidad fue del 97,5% (IC del 95%: 93,7% a 99,0%). Todos menos un sujeto con HSIL histológico dieron positivo para E6 y la prueba fue negativa en todos los casos asociados con tipos de VPH distintos de 16 y 18 o en negativos de VPH94.
- Inmunohistoquímica
Con el uso de anticuerpos monoclonales de ratón se pueden detectar las proteínas E6/E7 de los VPH 16 y 18, mediante técnicas inmunohistoquímicas en especímenes procedentes de lesiones cervicales de alto grado y cáncer cervical. Por ejemplo, la p16INK4a se detecta cuando la pRb (proteína del gen del retinoblastoma) está mutada, delecionada o inactivada y se reduce o está ausente en células que contienen pRb con actividad normal. La sobreexpresión detectada por técnicas inmunohistoquímicas de esta proteína es un marcador excelente de HSIL. La p16INK4a se puede determinar por medio de ELISA o con técnicas inmunohistoquímicas en extendidos citológicos con el kit CINtec PLUS (mtm, Heildelberg, Alemania) que detecta en la misma célula de forma simultánea 16INK4a y ki6795-96.
- Metilación del ADN
La metilación aberrante es una característica central de la carcinogénesis, generando la expresión de un gen defectuoso, e inestabilidad cromosómica97. E6 y E7 son capaces de modular la maquinaria de metilación del ADN.
La infección por VPH en el genoma del huésped se relaciona con múltiples alteraciones epigenéticas en cada estadío del cáncer cervical, incluyendo: hipometilación universal, hipermetilación de los genes supresores tumorales y la modificación de las histonas. Las alteraciones epigenéticas ocurren de manera más temprana con respecto a las alteraciones genéticas en el cáncer cervical. La metilación anormal del ADN puede ocurrir de manera temprana en LSIL, indicando el potencial de progresión de la lesión. Está demostrado que la metilación del ADN del VPH tiene correlación con la adhesión celular, siendo la hipermetilación de las mismas detectadas en sangre, orina o células exfoliadas del cuello uterino. Se encuentran en estudio los diferentes patrones de metilación para el carcinoma escamoso y el adenocarcinoma98
Se han desarrollado una serie de técnicas para examinar la metilación del ADN, y ha experimentado una revolución durante las últimas dos décadas, especialmente desde la adaptación de la tecnología de microarrays al estudio de metilación y la aparición de la secuenciación de nueva generación (Next Generation Sequence-NGS)99
7. RECOMENDACIONES BASADOS EN LA EVIDENCIA CIENTÍFICA
Un estudio cooperativo multinacional y un trabajo aleatorizado han coincidido en probar que la sensibilidad de la citología para la detección de lesiones de alto grado (CIN 2+) se sitúa sobre el 53 % y la especificidad sobre el 97 %. La baja sensibilidad se ha suplido en parte con la reiteración de la prueba en intervalos cortos de tiempo, lo que probablemente ha disparado los costes y penalizado la eficiencia del método, aunque su efectividad (reducción de la mortalidad a partir de su aplicación clínica) está bien documentada
El tamizaje citológico se ha mostrado inefectivo en reducir las tasas de incidencia y mortalidad por adenocarcinoma de cuello de útero. El impacto reductor se ha producido estrictamente sobre los cánceres escamosos. Las enfermas con adenocarcinoma de cuello de útero tienen de forma significativa un mayor número de controles citológicos normales previos que las que presentan un carcinoma
escamoso. El desconocimiento preciso de la historia natural del adenocarcinoma y la falta de criterios citológicos y colposcópicos bien establecidos y reproducibles para su detección o la de sus lesiones precursoras pueden ser la causa de esta situación.
Se han elaborado directrices con los requisitos que una prueba de VPH debe de poseer para su adopción como método de tamizaje primario100. La prueba elegida ha de demostrar un equilibrio óptimo entre la sensibilidad y la especificidad clínicas para la detección de CIN 2+. Es necesario desarrollar pautas de detección que maximicen los beneficios y disminuyan los riesgos de sobrecontrol. Los beneficios del tamizaje del cáncer (disminución de la incidencia del cáncer, de su morbilidad y su mortalidad) son bien conocidos y ampliamente difundidos, pero los efectos adversos del tamizaje están empezando a recibir atención y pueden ser minimizados mediante la adopción de unos protocolos más reales con el conocimiento actual de la historia natural de la infección cervical por VPH, incluyendo el retraso de la edad de inicio y un alargamiento de los intervalos de control.
La IARC ha confirmado que existe suficiente evidencia sobre la utilidad de la prueba de VPH para reducir la incidencia y la mortalidad por CCU. El debate no se establece en si debe o no incorporarse la prueba de VPH a los programas de tamizaje, sino en cómo debe incorporarse. En un trabajo prospectivo y aleatorizado101, en el ámbito de un país en desarrollo se demostró por primera vez que la aplicación de la prueba de VPH como método inicial de tamizaje ha producido un impacto significativo y relevante de la mortalidad por CCU en la población estudiada. Se ha documentado de manera consistente que la detección de VPH-ar es significativamente más sensible que la citología cervical para identificar mujeres con lesiones CIN 2+102, 103, 104
Determinar el tipo de VPH-ar es un instrumento muy válido para marcar el riesgo de presentar CIN 2+ en el seguimiento. El VPH 16 presenta un riesgo acumulado de producir CIN 2+ a 10 años, de algo más del 20 %; frente al 17 % del tipo 18; el resto de los tipos de VPH un 1-2 % aproximado. El riesgo de desarrollar CIN 2+ en 10 años en mujeres VPH negativas tiende a ser cero105.
La prueba de VPH es menos específica que la citología para mujeres jóvenes, pero en mujeres de 30 años o más para las pruebas sin genotipificación o de 25+ con genotipificación, las diferencias en la especificidad entre ambas técnicas disminuyen.
La utilización conjunta de la prueba de VPH y la citología en el tamizaje tiene su justificación en el elevado valor predictivo negativo. Las mujeres negativas para ambas tienen un riesgo inferior a 1 entre 1.000 de estar afectadas de un CIN 2+ no detectado105. El costo que significa añadir la prueba de VPH a un programa de tamizaje se compensa mediante el incremento del intervalo de tamizaje que puede espaciarse con seguridad entre los casos negativos a 3 a 5 años. Únicamente las mujeres inmunocomprometidas, en las que es posible un acortamiento de la historia natural del proceso oncogénico, tendrían que ser controladas anualmente.
Por otro lado, la vinculación etiológica establecida del VPH con el adenocarcinoma de cuello de útero permite suponer que la utilización de la prueba de VPH en el tamizaje podría provocar un incremento importante de la detección de adenocarcinomas y de sus lesiones precursoras, corrigiendo el déficit antes citado que la citología presenta al respecto.
La más reciente información que refuerza el uso de la prueba de VPH-ar en el tamizaje se refiere a la posibilidad de que la mujer practique una autotoma para su envío al laboratorio106-, 107, 108, 109. Ofrecer a una mujer que no acude al control preventivo la posibilidad de protegerse sin tener que desplazarse es una posibilidad que ha demostrado multiplicar la cobertura de los programas sin disminuir significativamente la sensibilidad para CIN 2+, especialmente útil en países en vías de desarrollo, pero también en desarrollados.
8. VALIDACION DE LAS PRUEBAS DE ADN PARA TAMIZAJE
Actualmente la OMS recomienda la prueba de VPH para la prevención secundaria del cáncer de cuello uterino y los países la van incorporando paulatinamente a nivel nacional o en esquemas pilotos110.
Las pruebas moleculares deben cumplir con ciertos requisitos para poder ser aplicados en el tamizaje primario en mujeres mayores de 25 años. Estos deben asegurar una alta sensibilidad clínica para la detección de cáncer y pre-cáncer cervical y, al mismo tiempo, una alta especificidad clínica para limitar los procedimientos innecesarios y el seguimiento de las mujeres positivas para la prueba de VPH. Datos de varios estudios de tamizaje han demostrado que las pruebas de VPH-ar mediante CH II y PCR producen resultados considerablemente mejores en la detección de CIN 2/3 que la citología. Estos datos se pueden utilizar para guiar el traslado de las pruebas de VPH-ar a la práctica clínica mediante establecimiento de estándares de rendimiento y características de las pruebas.
La cuestión clave para las pruebas de detección de ADN-VPH-ar en el tamizaje del cáncer cervical es detectar las infecciones por VPH que se asocian con CIN 2+ o se desarrollan en ellas y diferenciarlas de las infecciones transitorias del VPH. Esto implica que debe haber un equilibrio entre la sensibilidad clínica y la especificidad para la detección de CIN 2+.
De acuerdo con los criterios de Meijer101, la prueba candidata debe tener una sensibilidad clínica para ≥ CIN2 no inferior al 90% de la sensibilidad clínica de la CH2 en mujeres de al menos 30 años. Esta recomendación se basa en metaanálisis que informaron una sensibilidad combinada para CH2 del 97,9% (IC del 95%: 95,9%
-99,9%) en el tamizaje primario en Europa y América del Norte y una sensibilidad combinada de CH2 y GP5 + / 6 + PCR en estudios europeos del 96,1%100,110
La especificidad clínica para CIN2+ de la prueba candidata no debe ser menos del 98% de la especificidad clínica de la CH II en mujeres de al menos 30 años. El fundamento del alto límite inferior de la especificidad clínica es que una alta especificidad clínica limitará el número de pruebas positivas que posiblemente desencadenarían una mayor vigilancia y estigmatizarían innecesariamente a las mujeres como positivas al VPH 111-112.
9. RECOMENDACIONES DE TAMIZAJE
En Argentina, en el año 2020 se diagnosticaron 4583 casos nuevos de cáncer de cuello uterino113, de las cuales fallecieron 2218114. De estas, el 82% corresponde a mujeres mayores de 40 años. Existe suficiente evidencia científica de que el tamizaje de las lesiones precursoras del cáncer cervical entre los 35 y 64 años mediante la citología convencional en un programa de alta calidad reduce la incidencia del cáncer cervical en un 80% o más.
Independientemente de la prueba utilizada, la eficacia de un programa de tamizaje depende de varios factores y dentro de ellos, la cobertura de la población objetivo es quizá el más importante.
9.1. GUÍAS ARGENTINAS DEL PNPCCU 2011 (actualización 2015)
El PNPCCU tiene como objetivo fortalecer los programas provinciales a partir del establecimiento de una estrategia de prevención organizada que unifique los criterios de acción a la vez que contemple las necesidades particulares de cada provincia.
En el año 2011, Argentina implementó una estrategia integral para prevenir el cáncer de cuello uterino que consistió en la incorporación de la vacuna contra el VPH al Calendario Nacional de Vacunación para las niñas de 11 años nacidas a partir del 1ro de enero del año 2000 y el test de VPH en el sistema público de salud para el tamizaje de las mujeres a partir de los 30 años. La incorporación del test de VPH se realizó en el marco de un programa en la provincia de Jujuy, llevado a cabo por el PNPCCU en colaboración con el ministerio de salud. En base a los buenos resultados obtenidos, se extendió a las provincias de Tucumán, Catamarca, Misiones y Neuquén.
El test se ofrece a todas las mujeres mayores de 30 años, ya que el que se utiliza es la CH2, que está aprobada para su uso como test de tamizaje primario a partir de los 30 años, ya que en menores la infección por VPH es muy frecuente, y además en su mayoría son infecciones de tipo transitorio que en la mayoría de los casos tienden a la remisión espontánea114.
La edad de comienzo del tamizaje es a los 25 años, utilizándose el Papanicolaou como estrategia de tamizaje primario entre los 25 y 29 años. La frecuencia recomendada por el Programa Nacional es la realización de un Papanicolaou cada 3 años luego de dos Papanicolaous anuales consecutivos negativos.
A partir de los 30 años se toma test de VPH en forma conjunta con la citología, la cual es leída únicamente si el test de VPH es positivo. La toma en conjunto de dos muestras “doble toma”, una para test de VPH y otra para citología. Únicamente en pacientes con test de VPH positivo, se procederá a realizar la lectura de la citología como método de triage, con el fin de evitar las múltiples consultas al centro de salud, en base a la evidencia disponible sobre su efectividad para la detección de lesiones luego del conocimiento de un resultado VPH+115.
El objetivo final del Programa es la reducción de la incidencia y mortalidad por cáncer cervicouterino en la Argentina.
La recomendación de la autotoma por el PNPCCU es mejorar la cobertura en los programas de prevención, focalizando en aquellas mujeres sin historia de tamizaje; con el propósito de mejorar la cobertura. El estudio EMA realizado en la Argentina evidenció un 86% de aceptabilidad y una adherencia al tamizaje cuatro veces mayor en comparación a la toma dirigida (86% vs 20%)116.
El desempeño de la autotoma es mayor que el de la citología, pero menor que la de la prueba de VPH tomada por el médico; sin embargo, esta disminución en la sensibilidad es compensada por el aumento de la adherencia al tamizaje.
9.2 GUÍAS SOCIEDAD ARGENTINA DE PATOLOGIA DEL TRACTO GENITAL INFERIOR Y COLPOSCOPIA (SAPTGIyC) 2022
La Sociedad Argentina de Patología del Tracto Genital Inferior y Colposcopía (SAPTGIyC) publicó en el año 2022 una actualización de sus guías de tamizaje y de manejo de citología anormal y lesiones intraepiteliales cervicales117
Consideran iniciar el tamizaje luego de 3 años de iniciadas las relaciones sexuales o antes de los 3 años en los casos en que el médico lo considere conveniente acorde a los antecedentes de la paciente y finalizar a los 69 años y discontinuarlo a partir de los 70 años, excepto que el médico considere conveniente continuar con el tamizaje. Se discontinúa el tamizaje en aquellas pacientes con al menos dos citologías sucesivas previas negativas en los dos controles, sin historia de H-SIL o de lesiones glandulares en los últimos 20 años
Proponen 2 modalidades de tamizaje:
- Tamizaje primario con prueba de VPH c/s genotipificación (HPV 16/18)
- Citología sola
Los intervalos de tamizaje que proponen estas guías son los siguientes:
- Hasta los 29 años inclusive, lo recomendado es la citología, con un intervalo anual. Luego de 2 citologías negativas, puede pasarse a un intervalo cada 3 años. Individuos HIV +, trasplantados e inmunocomprometidos, mantendrán el intervalo anual.
- En ≥ 30 años, lo recomendado es el tamizaje con prueba de VPH. Si la prueba es negativa, podrá repetirse a los 5 años y si es positiva, realizar triage con citología. Prueba negativa en individuos inmunosuprimidos y HIV + deberán repetirla cada 3 años. El agregado de la citología (co-test) eleva los costos y aumenta muy levemente la sensibilidad de la estrategia.
- En caso de no contar con las pruebas moleculares, es aceptable el tamizaje con citología sola, continuando con el intervalo anual y luego de 2 pruebas negativas, pasar a un intervalo cada 3 años. Se mantendrá el intervalo anual en individuos HIV +, trasplantados e El embarazo se considera una oportunidad para el tamizaje con citología.
9.3. GUÍAS SOCIEDAD AMERICANA DE PATOLOGIA CERVICAL Y COLPOSCOPIA (ASCCP) 2019
Está guía publicada en el año 2020118 actualiza el manejo de anomalías celulares en la prevención del CCU para acomodar las 3 estrategias de detección cervical disponibles: detección primaria de VPH, cotest (prueba simultánea con prueba de VPH y citología), y citología sola.
Los nuevos datos indican que el riesgo de una paciente de desarrollar precáncer o cáncer de cuello uterino se puede estimar utilizando los resultados de las pruebas de detección actuales y los resultados de las biopsias y las pruebas de detección anteriores, considerando factores personales como la edad y la inmunosupresión.
Esta es la cuarta edición, reemplaza a las guías 2001, 2006, 2012 y la actualización 2015. Recomienda tamizaje, colposcopía y seguimiento más frecuentes para las pacientes con un riesgo progresivamente más alto. Se han generado tablas de estimaciones de riesgo para posibles combinaciones de los resultados actuales de las pruebas de detección de VPH y el historial de detección para estimar los riesgos a partir de una cohorte longitudinal prospectiva de más de 1,5 millones de pacientes seguidos durante más de una década en Kaiser Permanente Northern California (KPNC)119.
El cambio en estas nuevas guías de consenso es que las recomendaciones actuales se basan en los riesgos, a diferencia de las guías anteriores basadas en los resultados de los estudios, determinando “a igual riesgo, igual manejo”.
Para facilitar el uso de estas tablas, se puede acceder a la misma información a través de la página web de la ASCCP www.asccp.org .
Se definió como punto de corte un valor mayor o menor al 4% de riesgo inmediato y a 5 años de desarrollar CIN 3+ para determinar el manejo. Cuando el riesgo es ≥4% se debe realizar una acción inmediata, que podría corresponder a colposcopía (entre 4%-24%), tratamiento inmediato o colposcopía (25-59%) o tratamiento inmediato sin colposcopía si el riesgo es ≥ 60%. Si el riesgo a 5 años es < al 4%, está indicado realizar seguimiento. Si el riesgo es < 0.15%, estaría indicado el seguimiento dentro de 5 años. Entre 0.15-0.54% se debe realizar tamizaje dentro de 3 años y por último un riesgo ≥ 0.55%, se debería realizar seguimiento anual.
Es decir, en pacientes sin antecedentes, con resultado de test de VPH negativo, se debería realizar seguimiento a los 5 años, ya que el riesgo inmediato es muy bajo (< 0.15%). En cambio, en una paciente sin antecedentes, con citología negativa, los controles deberían realizarse a los 3 años, ya que el riesgo inmediato es entre 0.15-0.54%. La baja sensibilidad y el bajo valor predictivo negativo de la citología en comparación con la prueba de VPH reduce su utilidad para la predicción del riesgo a largo plazo120.
En el caso de una paciente con diagnóstico citológico de ASCUS, con prueba de VPH positiva, su riesgo inmediato es del 4%, por lo cual se debería realizar colposcopía. La posterior colposcopía y los hallazgos en la misma definirán el nuevo riesgo inmediato y los posteriores seguimientos.
En pacientes con diagnóstico citológico de HSIL y test de VPH positivo para el genotipo 16, el riesgo inmediato de CIN 3 es muy elevado (>60%), motivo por el cual justifican estas guías realizar tratamiento inmediato. En cambio, si el test de VPH es negativo, el riesgo inmediato disminuye al 25%, por lo cual se podría realizar tratamiento o colposcopía.
Otro de los cambios sugeridos es que luego de cualquier prueba VPH positiva, independientemente del genotipo, deben realizarse pruebas adicionales de triage.
Los nuevos principios de tamizaje de ASCCP 2019 incluyen:
- Las pruebas basadas en el VPH son la base para la estimación del riesgo. Se hace referencia a la utilización de la prueba primaria de VPH sola o en asociación con la citología cervical (cotesting) a partir de los 25 años. Aunque la citología tiene una alta especificidad y puede ser útil en la estimación de riesgo inmediato, su baja sensibilidad valor predictivo negativo en comparación con la prueba de VPH, reduce su utilidad para la predicción del riesgo a largo plazo120.
- Con el conocimiento de los resultados actuales y la historia pasada se puede conocer el riesgo individual y definir así tres tipos de pacientes. Las pacientes sin antecedentes, las pacientes con antecedentes y las pacientes que desconocen sus antecedentes.
- Se permite incorporan nuevos métodos de tests de tamizaje a medida que se validan y que se ajusten para disminuir los riesgos de CIN3+.
- La colposcopia debe seguir la guía detallada en los Estándares de Colposcopia de ASCCP 2017121.
- El objetivo principal es la prevención del cáncer cervical mediante la detección y el tratamiento del pre-cáncer. Numerosos estudios a nivel poblacional indican que la incidencia y la mortalidad por cáncer cervical disminuyen a medida que aumenta la detección y el tratamiento de anomalías cervicales histológicas de alto grado121.
- Estas guías son para pacientes con cuello
- Debe haber un equilibrio entre los beneficios y los daños al aplicar estas nuevas recomendaciones, evitando el sobre diagnóstico y el sobre
- Estas guías son para ser utilizadas en mujeres asintomáticas.
- Están realizadas para la población de Estados
Es importante remarcar este último punto, ya que la población norteamericana presenta características distintas a la nuestra. No obstante, citamos estas guías porque fueron las primeras en el mundo en basarse en el riesgo individual de cada mujer, más allá del diagnóstico histológico.
II. HIPÓTESIS Y OBJETIVOS
La hipótesis de trabajo es que el tamizaje basado en la detección de ADN de VPH con identificación de los tipos de alto riesgo es el mejor predictor para la identificación de pacientes con lesiones de alto grado y CCU.
Objetivo Primario
Evaluar la utilidad de la detección de ADN de VPH de alto riesgo como prueba de tamizaje primario del carcinoma de cuello uterino y sus lesiones precursoras en mujeres entre 25-65 años en la población que se atiende en el Hospital de Clínicas “José de San Martín”.
Objetivos secundarios
- Evaluar los tipos de VPH presentes en la población.
- Evaluar la prevalencia de VPH oncogénico según los diferentes grupos
- Determinar la edad media de las pacientes con CIN
III. DISEÑO DEL ESTUDIO
Diseño: Prospectivo y de cohortes. Se incluyeron un total de 516 pacientes. Selección de pacientes y toma de la muestra: Se incorporó un total de 516 mujeres entre 25 y 65 años que concurrieron a una Campaña de Prevención del Cáncer de Cuello Uterino en el Hospital de Clínicas “José de San Martín” de la Universidad de Buenos Aires, a quienes se realizó toma de Papanicolaou exo- endocervical. También se realizó toma de muestra para pruebas moleculares: Test de VPH-ar, detección de ADN de Chlamydia Trachomatis (CT) y del Virus del Herpes Simplex VHS). En esta primera etapa analizamos las pruebas de VPH, en una segunda etapa se analizarán los resultados de CT y VHS, para analizar su rol como posibles cofactores.
Ingresaron al estudio de manera consecutiva y prospectiva, mujeres adultas entre 25 a 65 años cumplidos al momento de la consulta, que hayan iniciado relaciones sexuales, previa firma del consentimiento informado. Independientemente del número de parejas sexuales, de la etnia y su nivel socioeconómico.
Luego de firmar el consentimiento informado y completar una encuesta, se les tomó una muestra de Papanicolaou con espátula de Ayre y citobrush y un hisopado utilizando un dispositivo de hisopo en forma de L y almacenado en Solución de conservación CELLPRESERV (Grupo Kolpast, Brasil) para realizar la prueba de VPH.
Las pacientes que presentaron uno o ambos estudios positivos fueron convocadas a realizar una colposcopia con toma de biopsia cervical ante la presencia de imágenes sospechosas de estar vinculadas a la infección por VPH.
Criterios de inclusión.
- Mujeres que hayan firmado el Consentimiento Informado
- Mujeres que hayan iniciado las relaciones sexuales
- Mujeres que tengan entre 25 y 65 años
- Mujeres que tengan útero
- Mujeres que no presenten malformaciones vaginales ni uterinas
Criterios de exclusión.
- Mujeres embarazadas
- Mujeres que se encuentren menstruando o con sangrado uterino anormal al momento de la toma de la muestra cervical
- Mujeres histerectomizadas por cualquier indicación
- Mujeres con malformaciones del tracto genital inferior
- Mujeres que no cumplen con 48 horas de abstinencia sexual previa a la toma de la muestra
- Mujeres diagnosticadas con carcinoma cervical
Procedimiento:
- Formulación de una encuesta validada anónima
- Confección de la historia clínica electrónica
Se incluyeron los siguientes datos: antecedentes patológicos y quirúrgicos de relevancia, edad de inicio de relaciones sexuales, embarazos, menarca, menopausia (si corresponde), método anticonceptivo, consumo de sustancias toxicas (tabaco, alcohol, marihuana u otro estupefaciente), antecedentes de enfermedades de transmisión sexual (HIV, Hepatitis B y C, sífilis, etc.) y antecedentes de tratamientos realizados en el tracto genital inferior
- Examen clínico y ginecológico
- Realización de citología cervical
- Realización de toma de muestra para pruebas moleculares: Test de VPH-ar
- A toda paciente con lesión cervical sospechosa de cáncer se les realizó colposcopia y biopsia
- A todas las pacientes con resultado de la Prueba de VPH positivo o prueba de Papanicolaou ASCUS+ se las citó para realizar colposcopía y en caso de encontrarse una lesión del cuello uterino o vagina se tomó biopsia dirigida
Análisis citológico-histológico: la citología y la histología se analizaron por citopatólogos especializados en el Tracto Genital Inferior. Los resultados citológicos fueron interpretados de acuerdo con el sistema Bethesda 2014122
Los informes histológicos fueron realizados siguiendo la Nomenclatura Lower Anogenital Standarized Terminology (LAST) 2012123.
Análisis mediante biología molecular: se extrajo el material genético de las muestras empleando el extractor automatizado Seeprep32 (Seegene, Corea del Sur) y el kit de extracción STARMag 96 ProPrep Plate Type (Seegene, Corea del Sur). A continuación, se realizó la tipificación de los genotipos de VPH presentes mediante la técnica de PCR en tiempo real empleando el kit Allplex™ HPV28 Detection (Seegene, Corea del Sur) que permite la amplificación y la detección simultánea de los ácidos nucleicos básicos de 19 tipos de HPV de alto riesgo (16, 18, 26, 31, 33, 35, 39, 45, 51, 52, 53, 56, 58, 59, 66, 68, 69, 73, 82), 9 tipos de HPV de bajo riesgo (6, 11, 40, 42, 43, 44, 54, 61, 70) y un control interno (CI) de muestras de cuello uterino y muestras vaginales obtenidas por la paciente124. Se empleó el equipo de análisis de PCR en tiempo real CFx96 Dx (BioRad, EEUU). El análisis de los resultados obtenidos se realizó utilizando el software Seegene Viewer (Seegene, Corea del Sur).
Análisis colposcópico: Se realizó colposcopia según técnica mediante la colocación del especulo vaginal, impregnación del cuello uterino con ácido acético al 5% para la visualización de imágenes utilizando la Nomenclatura de la Federación Internacional de Patologia Cervical y Colposcopia (IFCPC) 2011. Ante la presencia de lesiones anormales y sospechosas, se tomó biopsia de las mismas con pinza de Tischler según técnica y se enviaron a estudio histopatológico en frascos con formol al 10%.
En las pacientes con ambas pruebas negativas esta fue su visita final y a las pacientes con citología ASCUS+ y/o Test de VPH positivo se realizó colposcopía con biopsia de cuello uterino en presencia de áreas anormales o sospechosas con pinza de Tischler.
Acorde a los resultados se asignó a las pacientes dentro de los siguientes grupos de estudio:
Grupo 1: Pacientes con citología y test de VPH negativo.
Grupo 2: Citología negativa o ASCUS+ y/o test de VPH positivo, sin lesión colposcópica.
Grupo 3: Pacientes con diagnóstico histológico de lesiones intraepiteliales de bajo grado (Condiloma Viral Plano, CIN1 o CIN2 con P16 negativo).
Grupo 4: Pacientes con diagnóstico histológico de lesiones intraepiteliales de alto grado (CIN2 con P16 positivo o CIN3).
Grupo 5: Pacientes con cáncer de cuello uterino.
Grupo 6: Pacientes con test de HPV positivo, citología negativa, sin lesión colposcópica.
IV. MATERIALES Y MÉTODOS
Materiales:
- Planillas con variables a estudiar
- Colposcopio
- Espátula de Ayre
- Cepillo tipo citobrush o endobrush
- Portaobjetos convencionales
- Fijador Celular
- Material de recolección y de preservación para test de HPV Allplex™ HPV28 Detection
- Ácido Acético al 5%
- Camilla apta para efectuar examen ginecológico
Variables en estudio Variables a controlar
- Detección de pacientes con test de VPH-ar positivas para alguno de los 19 genotipos de alto riesgo: 16, 18, 26, 31, 33, 35, 39, 45, 51, 52, 53, 56, 58, 59, 66, 68, 69, 73, 82.
- Detección de pacientes con test de VPH-ar positivas para alguno de los 9 genotipos de bajo riesgo: 6, 11, 40, 42, 43, 44, 54, 61, 70.
- Prevalencia de lesiones CIN3+ en nuestra población.
Variables de caracterización
- Edad medida en años según fecha de nacimiento
- Nivel de educación: primario completo/incompleto; secundario completo/incompleto; terciario completo/incompleto
- Menarca: edad en que ocurrió su primera menstruación (medida en años)
- Menopausia: edad en que cesaron las menstruaciones
- Gesta: se cuantificarán número de embarazos, partos, cesáreas o abortos referidos por la paciente
- IRS: inicio de relaciones sexuales
- Número de parejas sexuales, en números, según refiera la paciente
- Se interrogó sobre los métodos anticonceptivos utilizados desde el inicio de las relaciones sexuales hasta la actualidad, tipo (barrera, hormonal, DIU, ligadura tubaria, implante hormonal) y tiempo de uso
- Se interrogó sobre infecciones de transmisión sexual
- Se interrogó sobre el consumo de tabaco, alcohol, marihuana o algún otro estupefaciente
- Se interrogó a la paciente si ha sido vacunada con alguna vacuna contra VPH (bivalente, cuadrivalente o nonavalente)
- Se realizó una encuesta acerca del conocimiento del VPH y la prevención del cáncer de cuello uterino
Análisis estadístico
Se realizaron pruebas de sensibilidad, especificidad y cálculo de los valores predictivos positivos (VPP) y valores predictivos negativos (VPN) con los correspondientes intervalos de confianza (IC) del 95% del test de VPH-ar. El gold estándar de la prueba diagnóstica será la presencia de H-SIL (CIN2 con p16+ o CIN 3) cervical en la biopsia. El valor de p <0,05 se considera estadísticamente significativo.
Se estimó el porcentaje con los correspondientes IC del 95% de las pacientes con test VPH 16, 18, 26, 31, 33, 35, 39, 45, 51, 52, 53, 56, 58, 59, 66, 68, 69, 73, 82,6, 11, 40, 42, 43, 44, 54, 61, 70 sometidos a colposcopia con toma de biopsia.
Los investigadores se comprometen a cumplir con la Declaración de Helsinki en su última versión (Helsinki 2024) y la Ley Nacional de Protección de Datos Personales Nº 25.326.
V. RESULTADOS
Con respecto a los datos epidemiológicos de nuestra cohorte de 516 pacientes, la edad media de las mismas fue de 43 años (Rango entre 25 a 65 años).
El 80% de las pacientes eran de nacionalidad Argentina, 5.8% eran procedentes de Paraguay, 3.9% de Perú, 3.5% de nacionalidad boliviana, 0.7% provenientes de Uruguay y un 6.2% de otros países.
El 53.1% de las pacientes que participaron del protocolo de investigación provenían de la Ciudad de Buenos Aires, mientras que el 46.2% correspondían a la Provincia de Buenos Aires. Únicamente el 0.2% eran oriundos de otras provincias de Argentina y el 0.5% viven en el exterior del país.
Con respecto a la paridad de nuestras pacientes al momento del testeo, el 68.6% de las mismas habían cursado algún embarazo, mientras que el 34.4% eran nuligestas.
A todas las pacientes participantes se interrogó sobre utilización de métodos anticonceptivos (MAC). Llamativamente el 36.1% de las pacientes no utilizaba ningún MAC al momento de la consulta. Por otro lado, el 26.4% de las pacientes usaban preservativo y el 16.4% utilizaban anticonceptivos orales combinados.
Con respecto a los datos socio económicos de nuestras pacientes, el 33.9% tenían un nivel de estudios terciario/ universitario completo, mientras que el 1.6% no tenía estudios primarios finalizados. El 77% de las pacientes tenían empleo al momento de la consulta.
El acceso al sistema de salud de nuestras pacientes corresponde a un 60% de acceso a obras sociales, mientras que un 32.9% no tiene cobertura médica.
El 81.1% de nuestras pacientes refiere realizar controles ginecológicos en forma periódica, en contraposición al 18.9% que refiere realizarlos únicamente cuando sienten que “están enfermas”. El 31.7% de las pacientes había realizado el último control hacía 1 año.
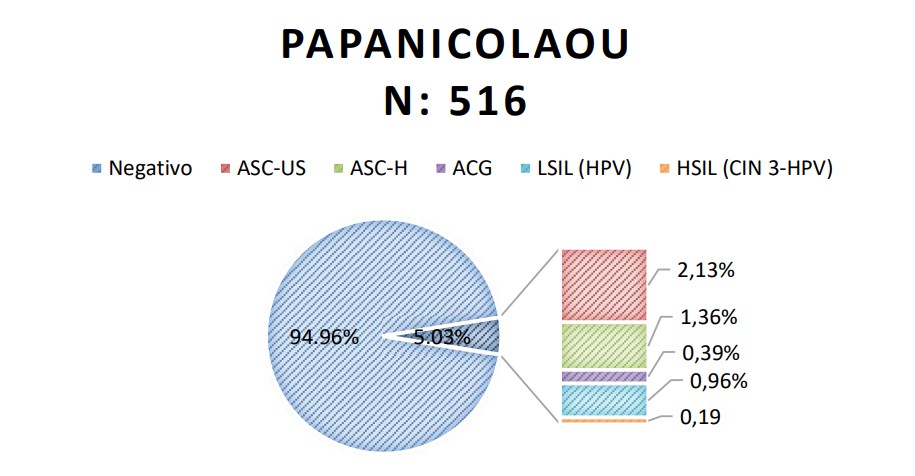
Se analizaron los resultados del cotest de 516 pacientes y de la evaluación colposcópica en aquellas mujeres que presentaron Papanicolaou ASCUS+ y/o test de VPH positivo para tipos de alto riesgo (Tabla 2, Figura 8)
Papanicolaou negativo en 490/516 (94.96%). Papanicolaou ASCUS+ en 26/516 (5.03%)
Tabla 2: Resultados del Papanicolaou
|
PAPANICOLAOU |
N |
% |
|
NEGATIVO |
490 |
94.96 |
|
ASC-US |
11 |
2.13 |
|
ASC-H |
7 |
1.36 |
|
ACG |
2 |
0.39 |
|
LSIL (HPV) |
5 |
0.96 |
|
HSIL (CIN 3-HPV) |
1 |
0.19 |
Figura 8. Resultados del Papanicolaou
Se detectó una prevalencia de infección por VPH de alto y bajo riesgo del 30,2% (156/516). En el grupo de mujeres de 25-34 años se detectó la mayor prevalencia de VPH de alto y bajo riesgo (39.3% 57/145).
En la tabla 3 y figura 9 se observa el análisis de la prevalencia de VPH de alto y bajo riesgo según los diferentes grupos etarios. Se analizó la prevalencia de VPH 16 y/ 18, solos o en combinación entre sí o con otros tipos de VPH de alto riesgo.
Tabla 3: Prevalencia de VPH de alto y bajo riesgo según los diferentes grupos etarios
|
Rango Edad |
n |
Detectable |
AR |
BR |
AR/BR |
16+18 |
|||||
|
n |
% |
n |
% |
n |
% |
N |
% |
||||
|
25-34 |
145 |
57 |
39.3 |
46 |
31.7 |
30 |
20.6 |
46/30 |
1.5 |
6 |
4.1 |
|
35-44 |
136 |
42 |
30.8 |
33 |
24.2 |
13 |
9.6 |
33/13 |
1.3 |
2 |
1.5 |
|
45-54 |
132 |
33 |
25.0 |
21 |
15.9 |
14 |
10.6 |
21/14 |
1.5 |
7 |
5.3 |
|
> 55 |
103 |
24 |
23.3 |
19 |
18.4 |
9 |
8.7 |
19/9 |
2.1 |
1 |
0.97 |
Figura 9. Prevalencia de VPH de alto y bajo riesgo según los diferentes grupos etarios
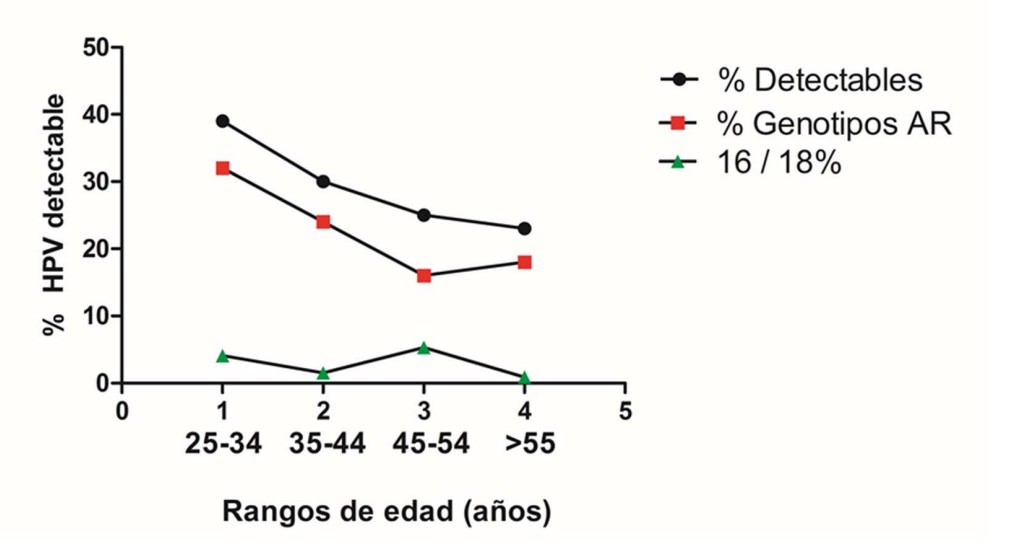
Se detectó la presencia de genotipos de VPH-ar en el 23% de las muestras (119/516).
En 73/516 muestras se detectó un único tipo de VPH-ar (14,1%), en 17/516 una mezcla de hasta 3 tipos VPH-AR (3,2%); y en 29/516 una mezcla de VPH de alto y bajo riesgo (5,6%).
Las muestras con genotipos de bajo riesgo únicamente fueron 37 (7,2%) (Figura 10).
Figura 10. Composición de tipos de VPH en muestras detectables
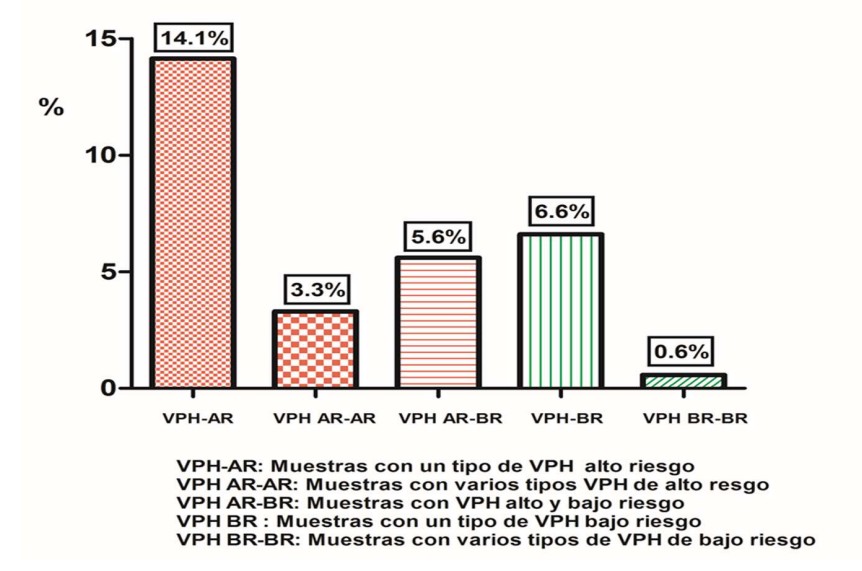
Los genotipos VPH-ar más frecuentemente detectados fueron el 31 (13,4%, 16/119); 68 (11,7%, 14/119); 45 y 66 (10%, 12/119). Los genotipos 51, 16, 52, 39 y 53 presentaron valores menores al 10%. Los genotipos 18, 58, 59 y 73 fueron menores al 6% y 56, 69, 35, 82 y 33 menores al 5%.
Los genotipos VPH-br más frecuentemente detectados fueron el 54 (27.3% 18/66), 42 y 61 (19.7% 13/66); 44 (15.1% 10/66); 70 (12.1% 8/66); 43 (6% 5/66) y 40 (6% 4/66). Los VPH-BR 6 y 11 se detectaron en 1.5%. (Tabla 4- Figura 11)
Tabla 4: Frecuencia de genotipos detectados
|
Genotipo Alto Riesgo n=119 |
Genotipo Bajo Riesgo n=66 |
||||
|
n |
% |
n |
% |
||
|
31 |
16 |
13.4 |
54 |
18 |
27.3 |
|
68 |
14 |
11.7 |
42 |
13 |
19.7 |
|
45 |
12 |
10 |
61 |
13 |
19.7 |
|
66 |
12 |
10 |
44 |
10 |
15.1 |
|
51 |
10 |
8.4 |
70 |
8 |
12.1 |
|
16 |
9 |
7.6 |
43 |
5 |
7.6 |
|
52 |
9 |
7.6 |
40 |
4 |
6 |
|
39 |
8 |
6.7 |
6 |
1 |
1.5 |
|
53 |
8 |
6.7 |
11 |
1 |
1.5 |
|
18 |
7 |
5.9 |
|||
|
58 |
7 |
5.9 |
|||
|
59 |
7 |
5.9 |
|||
|
73 |
7 |
5.9 |
|||
|
56 |
5 |
4.2 |
|||
|
69 |
4 |
3.4 |
|||
|
35 |
3 |
2.5 |
|||
|
82 |
3 |
2.5 |
|||
|
33 |
2 |
1.7 |
|||
Figura 11. Frecuencia de genotipos detectados
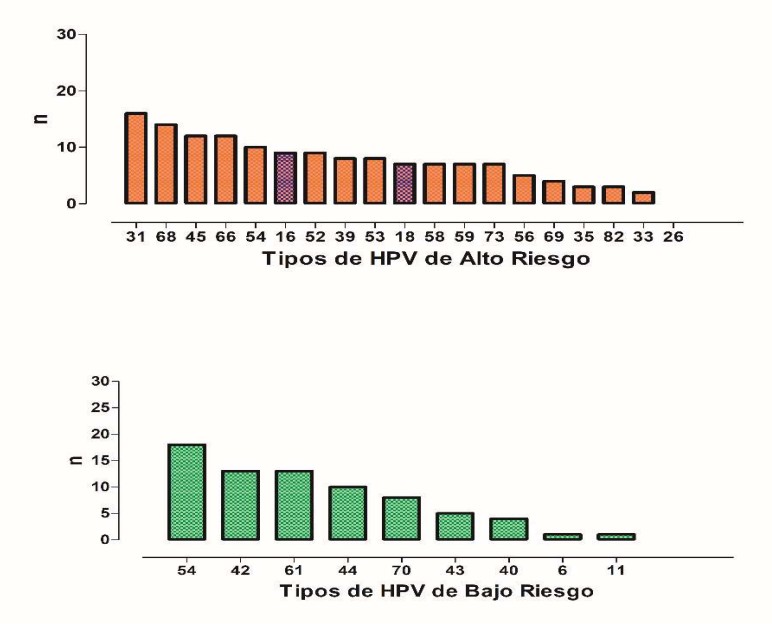
Se analizaron los resultados de la citología:
De las 490/516 (94.96%) pacientes con citología negativa: 4 pacientes con test VPH-ar positivo, presentaron histología HSIL y 12 LSIL, siendo excluidas para este análisis de distribución de tipos de VPH, considerando 474/516 (91.86%) de las pacientes con Papanicolaou negativo, sin lesión histológica. De estas pacientes, 124/474 (26.16%) presentaron una infección por VPH y no se detectó VPH-ar en 350/474 (73.83%) En la Tabla 5- Figura 12 se muestra la distribución de VPH-ar y VPH-br en pacientes con citología negativa, sin lesión histológica
Tabla 5: Distribución de tipos de VPH en pacientes con citología negativa, sin lesión histológica
|
Citología normal |
|||||
|
Genotipo Alto Riesgo n=88 |
Genotipo Bajo Riesgo n=60 |
||||
|
n |
% |
n |
% |
||
|
68 |
12 |
13.63 |
54 |
16 |
26.66 |
|
31 |
11 |
12.5 |
61 |
12 |
20 |
|
66 |
11 |
12.5 |
42 |
10 |
16.66 |
|
51 |
10 |
11.36 |
44 |
10 |
16.66 |
|
45 |
8 |
9.09 |
70 |
8 |
13.33 |
|
53 |
8 |
9.09 |
43 |
4 |
6.66 |
|
39 |
7 |
7.95 |
40 |
3 |
5 |
|
16 |
6 |
6.81 |
6 |
1 |
1.66 |
|
58 |
6 |
6.81 |
11 |
1 |
1.66 |
|
73 |
6 |
6.81 |
|||
|
52 |
5 |
5.68 |
|||
|
59 |
5 |
5.68 |
|||
|
56 |
5 |
5.68 |
|||
|
33 |
3 |
3.40 |
|||
|
18 |
2 |
2.27 |
|||
|
35 |
2 |
2.27 |
|||
|
82 |
2 |
2.27 |
|||
|
69 |
1 |
1.13 |
|||
Figura 12. Distribución de tipos de VPH en pacientes con citología negativa, sin lesión histológica
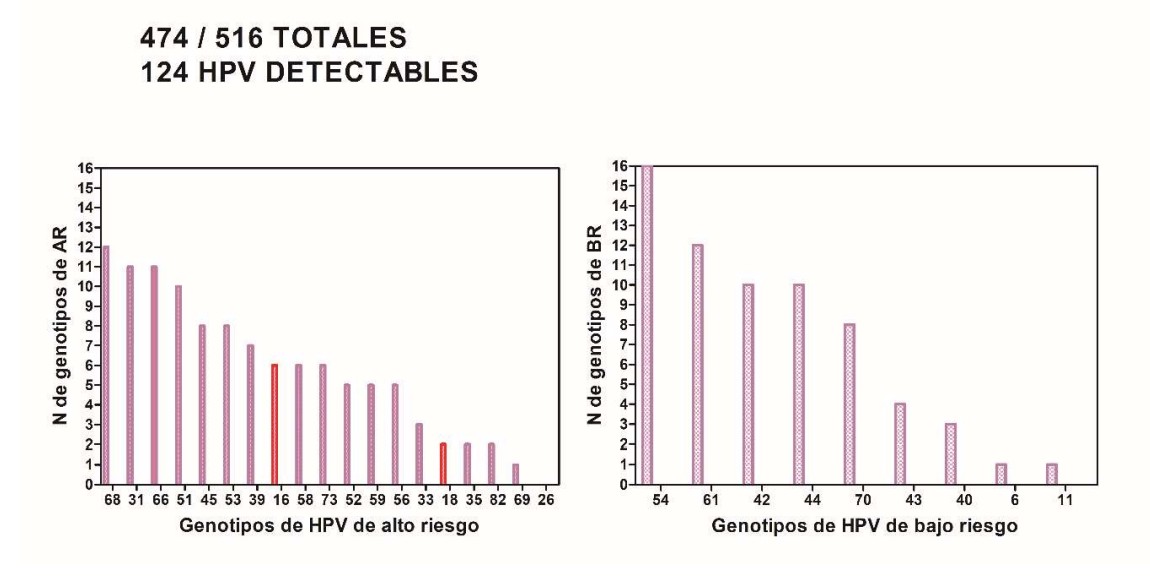
Con respecto a la citología ASCUS+: 26/516 (5.03%) pacientes presentaron citología ASCUS+. Entre ellas la prueba de VPH-ar fue positiva en 61.54% (16/26) y negativa en 10/26 (38.46%). El 57.69% (15/26) de estas pacientes, no presentaron lesiones histológicas. En 9 pacientes no se detectó infección por VPH La distribución de los genotipos la podemos observar en la Tabla 6 - Figura 13.
Tabla 6: Distribución de VPH-ar y VPH-br en pacientes con citología ASCUS+ sin patología
|
Citología ASCUS+ sin patología (15/516) |
|||||
|
Genotipo Alto Riesgo n=6 |
Genotipo Bajo Riesgo n=1 |
||||
|
n |
% |
n |
% |
||
|
18 |
1 |
0.16 |
61 |
1 |
0.16 |
|
35 |
1 |
0.16 |
|||
|
45 |
1 |
0.16 |
|||
|
59 |
1 |
0.16 |
|||
|
68 |
1 |
0.16 |
|||
|
69 |
1 |
0.16 |
|||
Figura 13. Distribución de VPH -ar en pacientes con citología ASCUS+ sin patología
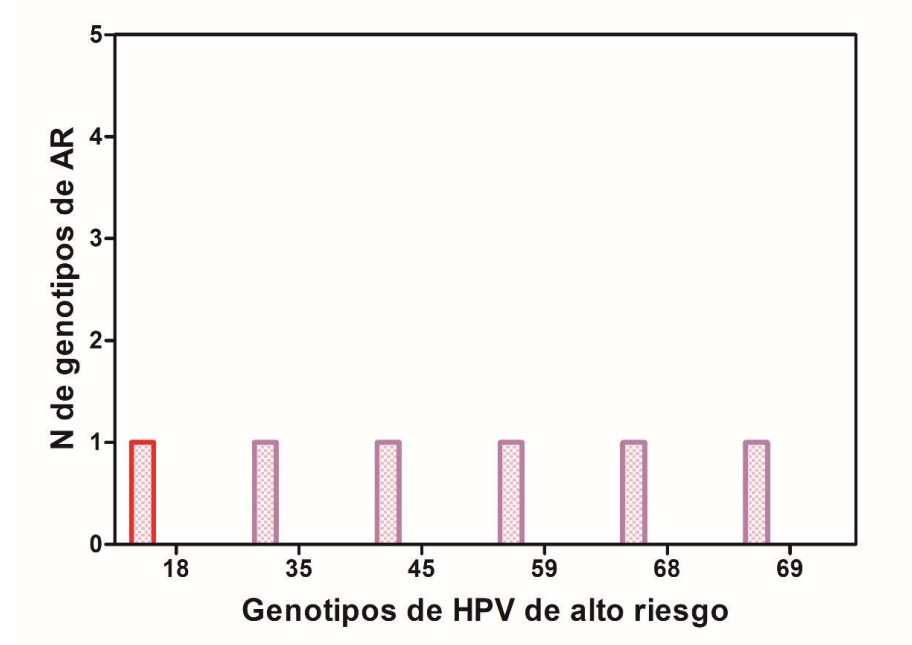
En 42.30% (11/26) de las pacientes con citología ASCUS+, se diagnosticó lesión intraepitelial, 4/26 (15.38%) HSIL y 7/26 (26.92%) LSIL. No se ha detectado infección por VPH en 1 paciente. La distribución de los genotipos se puede observar en la Tabla 7- Figura 14
Tabla 7: Prevalencia de genotipos de VPH-AR y BR en pacientes con citología ASC US+
|
Citología ASC US+ con patología (n=11) |
|||||
|
Genotipo Alto Riesgo |
Genotipo Bajo Riesgo |
||||
|
n |
% |
N |
% |
||
|
31 |
2 |
18.18 |
43 |
1 |
9.09 |
|
18 |
1 |
9.09 |
|||
|
45 |
1 |
9.09 |
|||
|
52 |
2 |
18.18 |
|||
|
16 |
1 |
9.09 |
|||
|
69 |
2 |
18.18 |
|||
|
56 |
1 |
9.09 |
|||
|
66 |
1 |
9.09 |
|||
Figura 14. Distribución de genotipos de AR en pacientes con citología ASC US+ con lesión
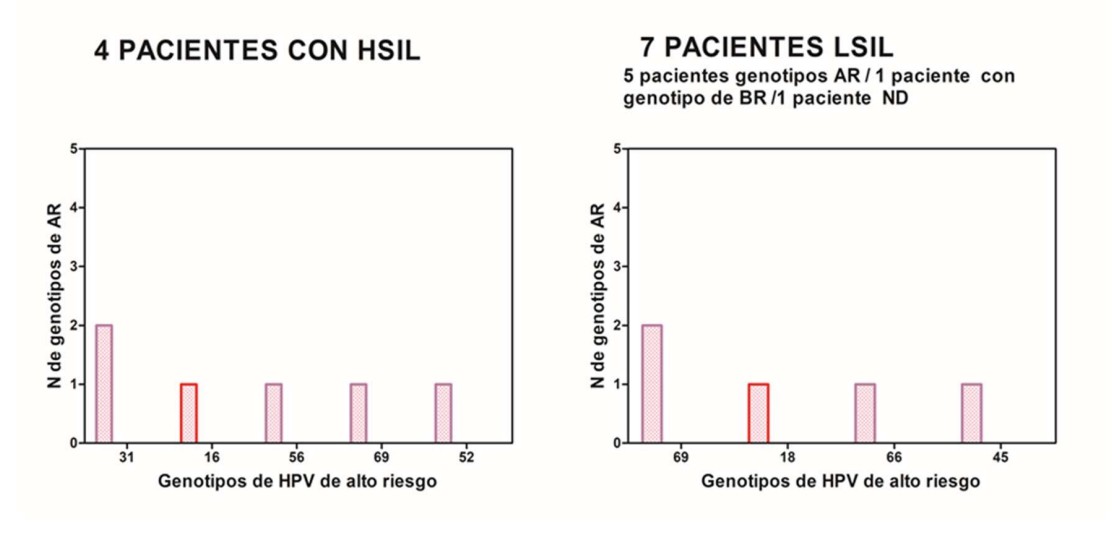
Citología ASC-H: ha sido informada en 10/26 pacientes (38.46%):
- 2/10 (20%) con Bx Cx HSIL, con test VPH positivo para VPH 69 y 52,
- 2/10 (20%) Bx Cx LSIL con 1/10 test VPH-AR 52 y 1/10 VPH-BR 42,
- 4/10 (40%) VPH-AR positivo (VPH 68, 45, 35, 18) sin lesión histológica
- 2/10 (20%) VPH negativo sin lesión histológica.
Se analizaron los resultados de la histología: Diagnostico histológico de lesión intraepitelial (SIL)
Se diagnosticó lesión intraepitelial (SIL) en 27/516 (5.23%) de las pacientes, 8/516 (1,55 %) lesión de alto grado (HSIL) y 19/516 (3,68 %) lesión de lesión de bajo grado (LSIL).
En 8/8 (100%) pacientes con HSIL se detectó VPH-ar.
- 75% (6/8) se detectó un único tipo de VPH-AR: VPH 31 (50% 3/6), VPH 16 (16.7% 1/6), VPH 52 (16.7% 1/6) VPH 69, (16.7% 1/6).
- 25% (2/8) más de un tipo de VPH-AR, 50% (1/2) confección VPH-AR 16/ 31/ 56 y 50% (1/2) confección con VPH-AR 52 /59 (Tabla 8)
El test de VPH tiene una Sensibilidad de 100% y una Especificidad de 76,4%, VPP: 6,7% y VPN: 100%.
Tabla 8: Prevalencia de VPH-AR y BR en pacientes con diagnóstico histológicos de HSIL
|
Bx Cx: HSIL (8/516) |
|||||
|
Genotipo Alto Riesgo |
Genotipo Bajo Riesgo |
||||
|
n |
% |
n |
% |
||
|
31 |
4 |
50 |
42 |
1 |
12.5 |
|
16 |
2 |
25 |
|||
|
52 |
2 |
25 |
|||
|
56 |
1 |
12.5 |
|||
|
59 |
1 |
12.5 |
|||
|
69 |
1 |
12.5 |
|||
Coinfección HPV 31/HPV 42
El Papanicolaou fue negativo en 50% (4/8) de las pacientes con diagnostico histológico de HSIL (Sensibilidad: 50% - Especificidad: 99.2%)
La edad promedio de las pacientes con HSIL: 39 años (mediana 41.5 años). De las 19 pacientes con diagnóstico de LSIL, en 17/19 (89.47%) se detectó VPH- ar, en 1/19 (5.26%) VPH-br y en 1/19 (5.26%) presento una prueba de VPH negativa (Tabla 9- Figura 15)
Tabla 9: Prevalencia de VPH-ar y VPH-br en pacientes con diagnóstico histológicos de LSIL
|
Bx Cx: LSIL (19/516) |
|||||
|
Genotipo Alto Riesgo |
Genotipo Bajo Riesgo |
||||
|
n |
% |
n |
% |
||
|
18 |
3 |
15.78 |
42 |
2 |
10.52 |
|
45 |
3 |
15.78 |
54 |
2 |
10.52 |
|
31 |
2 |
10.52 |
40 |
1 |
5.26 |
|
39 |
2 |
10.52 |
43 |
1 |
5.26 |
|
52 |
2 |
10.52 |
|||
|
16 |
1 |
5.26 |
|||
|
58 |
1 |
5.26 |
|||
|
66 |
1 |
5.26 |
|||
|
68 |
1 |
5.26 |
|||
|
69 |
1 |
5.26 |
|||
|
73 |
1 |
5.26 |
|||
|
82 |
1 |
5.26 |
|||
El Papanicolaou fue negativo en 63.15% (12/19) de las pacientes con diagnostico histológico de LSIL. La edad promedio de las pacientes con LSIL: 36 años (mediana 36 años)
Figura 15. Distribución de genotipos de VPH-ar detectados en pacientes con lesión histológica
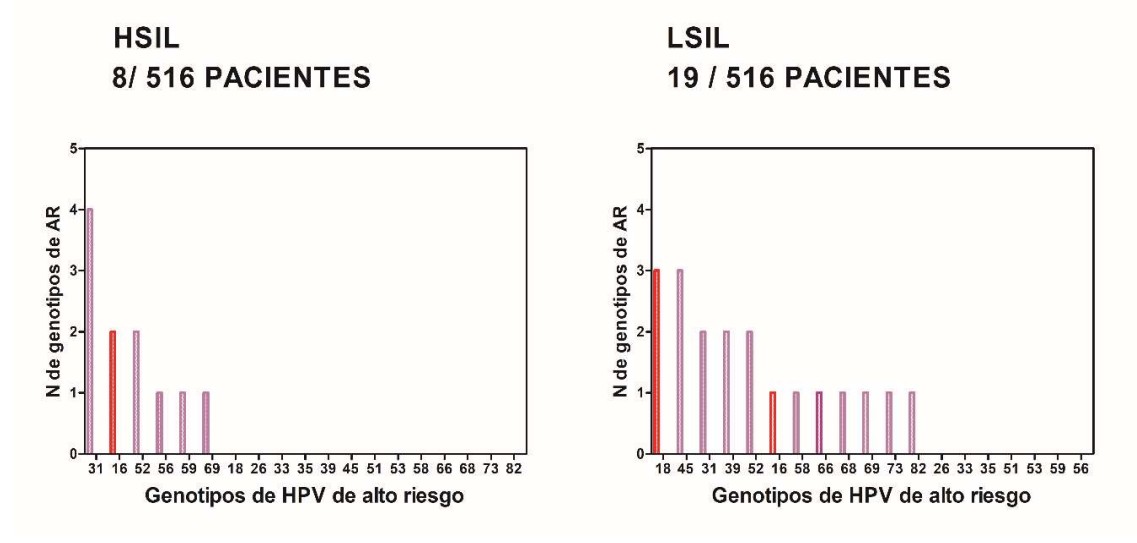
VI. DISCUSIÓN
El PNPCCU del Ministerio de Salud de la Nación incorporó a la prueba de VPH como herramienta de tamizaje primario en la prevención del CCU, con toma conjunta de Papanicolaou que se lee solo en las pacientes con test de VPH positivo (es decir, la citología es utilizada como método de triage) para las mujeres entre 30 y 64 años. Luego de su implementación como prueba piloto en la provincia de Jujuy, a partir del año 2011, quedó demostrado que esta nueva estrategia duplicó la capacidad de detección de lesiones precancerosas y cáncer cervicouterino.
El Test Allplex™ HPV28 Detection, utilizado en este estudio amplifica solo blancos específicos sin reactividad cruzada y la detección es automatizada mediante un método de real-time PCR. Solo detecta específicamente verdaderos VPH y los genotipifica con precisión e individualmente; permitiendo la amplificación y detección simultánea de ácidos nucleicos diana de 19 tipos de VPH de alto riesgo (16, 18, 26, 31, 33, 35, 39, 45, 51, 52, 53, 56, 58, 59, 66, 68, 69, 73, 82) y 9 tipos de VPH de bajo riesgo (6, 11, 40, 42, 43, 44, 54, 61, 70), así como el control interno (CI); a diferencia de los 13 tipos que detecta la CH II o los 14 tipos que detectan Cobas® y Abbott® disponibles en Argentina en la actualidad. Este tipo de test brinda una genotipificación completa permitiendo realizar un seguimiento de persistencia viral en las pacientes con pruebas de VPH positivas, un paso fundamental para la toma de decisiones. Está aprobada a partir de los 25 años, debido a que la detección individualizada de los genotipos de mayor riesgo y la posibilidad de seguimiento por tipo individualizado de VPH ayuda a la prevención del CCU en mujeres entre los 25 y 30 años, al detectar infecciones clínicamente significativas. Además, la distinción concurrente de los 19 genotipos VPH-ar sería importante para evaluar el impacto de la vacunación en la circulación de genotipos virales125.
En estudios comparativos con COBAS®, la prueba Anyplex II™ HPV28 Detection demostró una mayor sensibilidad para la detección de genotipos oncogénicos126. Anyplex II™ HPV28 Detection y Allplex™ HPV28 Detection comparten el mismo panel de detección de genotipos de VPH y presentan rendimientos clínicos comparables. Sin embargo, Allplex™ HPV28 Detection incorpora una tecnología más reciente que permite mayor automatización y eficiencia operativa. Dado que Allplex™ HPV28 Detection, emplea el mismo panel genotípico y mantiene una sensibilidad clínica equivalente, es esperable que su rendimiento diagnóstico sea comparable, con el beneficio adicional de una plataforma automatizada y más amigable para programas de tamizaje de alto volumen.
En base a los resultados de este estudio de tipo cohorte transversal en mujeres entre 25 y 65 años que participaron en la campaña de prevención secundaria del cáncer de cuello uterino, se encontró Papanicolaou ASCUS+ en el 5.03% (26/516) de las pacientes. La prueba de VPH resultó positiva para virus oncogénicos en 23% (119/516) de las muestras, de las cuales el 13,4% (16/119) fue positivo para VPH 31, seguidos por VPH 68 en 11,7% (14/119); VPH 45 y 66 en 10% (12/119). Los genotipos 51, 16, 52, 39 y 53 presentaron valores menore al 10%. Los genotipos 18, 58, 59 y 73 menores al 6%, y 56, 69, 35, 82 y 33 menores al 5%.
Es interesante nuestro hallazgo. Acorde a la bibliografía internacional, la mayor prevalencia de tipos de VPH de alto riesgo oncogénico se da en el grupo entre 25-34 años (31.7%), disminuyendo en los siguientes grupos etarios. A su vez, en coincidencia también con las publicaciones internacionales, en las cuales se observa un aumento de los casos en el grupo de 50-54 años, en nuestra población la prevalencia de VPH-ar en mujeres mayores de 55 años fue de 18.4%. Las posibles causas de esta curva bimodal de prevalencia de infección por VPH-ar pueden ser: adquisición de nuevas infecciones como consecuencia de cambios en el comportamiento sexual, reactivación de infecciones latentes asociada a la inmunosenescencia y persistencia viral127
En 8/8 de las pacientes con CIN2 p16+ y CIN3 la prueba de VPH-AR fue positiva, demostrando una sensibilidad del 100% en la detección de lesiones intraepiteliales de alto grado128
En este trabajo la mayor prevalencia de HSIL se encontró en los grupos de 32-45 años (promedio 39 años) con una prevalencia de 1.55% (8/516); ninguna paciente en esta casuística presento cáncer cervical.
En el 73.83% (350/474) de las pacientes con Papanicolaou negativo, la prueba de VPH fue negativa (Papanicolaou negativo + test de VPH negativo), mientras que en el 26.16% (124/474) se detectó una infección por VPH.
El 23% de las muestras (119/516) presentaron test de VPH-ar positivo, siendo los 5 tipos más frecuentes VPH 31 (13.4%), VPH 68 (11.7%), VPH 45 y 66 (10%), 51 (8.4%). VPH 16 (7.6%), 18 (5.9%) 16/18 en el 13.44%.
Es importante destacar la alta frecuencia en la cual hemos hallado el genotipo 31, en coincidencia con publicaciones internacionales129 En Argentina el Instituto Malbran demostró un descenso en los genotipos 16 y 18 mayor al 90% y los genotipos 16, 18, 31, 33 y 45 en conjunto del 89.3%130
En las pacientes con citología ASCUS+, el test de VPH fue positivo en el 61.54% (16/26) de las pacientes.
En las pacientes con citología ASC-H+ el test de VPH-ar fue positivo en 7/10 (70%). En 28.6% (2/7) pacientes con VPH-ar la biopsia colposcópica informo HSIL, en 14.3% (1/7) resultado histológico LSIL, y 57.1% (4/7) con biopsia negativa.
Por otra parte, el resultado del Papanicolaou fue negativo en el 100% de pacientes con diagnóstico histológico de HSIL/ CIN2-p16+ (2/2) y 33.33% de pacientes con HSIL/CIN 3 (2/6). Sin embargo, el test de VPH fue positivo en el 100% de las pacientes: VPH 31 en 50 % (4/8), VPH 16 y 52 en 25% cada uno (2/8 para HPV 16 y 2/8 para HPV 52) de los casos.
El aumento de la prevalencia de VPH 31 en las pacientes con HSIL coincide con publicaciones internacionales donde ocupa el segundo lugar en frecuencia luego del VPH 16 (VPH 16, 50%; VPH 31, 18.92%; VPH 18, 35 y 45, 5.41%; VPH 51, 12.16%; VPH 66, 10.81%; VPH 56 y 68, 9.46%; VPH 39, 52 y 59, 6.76% (Bruni L, et al. IARC 2023)131
El valor de la colposcopía como una técnica de tamizaje ha sido motivo de controversias. Esto se debe a que la interpretación de las imágenes colposcópicas sugestivas de lesiones precancerosas, son también operador dependiente. La sensibilidad de la colposcopia para CIN3 publicada por el grupo ALTS fue de 53.6%, esta baja sensibilidad puede deberse en parte a que las actuales herramientas de tamizaje basadas en pruebas de VPH detectan lesiones nuevas o iniciales, donde la colposcopia debe identificar lesiones preinvasoras con cambios mínimos, en el límite de la detección132.
Por otro lado, Wentzensen y col. publicaron un trabajo donde se observó un incremento en la detección de lesiones precancerosas desde un 60.6% cuando se realiza una biopsia hasta 100% cuando se realizaron 4 biopsias, por lo que la sensibilidad de la colposcopia puede mejorar significativamente tomando de 2 o 4 biopsias en lugar de una biopsia frente a colposcopias con imágenes anormales o sospechosas133. En nuestro trabajo a todas las pacientes con lesión colposcópica se les han realizado entre 2 a 4 biopsias.
Cabe remarcar que el 100% (8/8) de las pacientes con diagnóstico histológico de lesiones cervicales de alto grado presentaron test de VPH positivo: VPH 31, 16, 52, 56, 59, 69.
Esta modalidad de tamizaje es tan sensible que la Sociedad Americana de Cáncer (ACS)134 ha cambiado la estrategia de prevención, publicando las nuevas guías de tamizaje 2020. Afirman que en comparación con la estrategia anterior de tamizaje basada en citología sola a partir de los 21 años y cotest a partir de los 30 años, la nueva estrategia basada en iniciar el tamizaje a los 25 años con test de VPH; demostró un aumento del 13% en la prevención del cáncer de cuello uterino y del 7% en muertes por cáncer evitadas, con años de vida similares ganados (64.193 vs 64.194, respectivamente) y con solo un 9% más de colposcopias, pero un 45% menos de pruebas (VPH o citología) necesarias.
En Latinoamérica el protocolo ESTAMPA (Estudio multicéntrico de tamizaje y triage de cáncer de cuello uterino con pruebas del Virus del Papiloma Humano), del cual formamos parte como centro investigador. ESTAMPA evalúa el desempeño de diferentes técnicas de tamizaje y triage para detectar precáncer e informar cómo implementar programas de tamizaje basados en test de VPH en países de ingresos bajos y medios135 en el cual se demostró que el tamizaje basado en test de VPH tiene resultados prometedores para disminuir la incidencia de CCU en la región.
En las pacientes con test de VPH negativo consideramos extender los intervalos de tamizaje; el estudio FOCAL136 recientemente publicado demostró que el tamizaje con test de VPH con un intervalo de 4 años es tan seguro como la citología en base líquida con un intervalo de 2 años.
Citamos un estudio poblacional recientemente realizado en Suecia137 donde las mujeres con VPH positivo y citología negativa tuvieron un riesgo de cáncer cervical invasivo de 79,2 por 100.000 personas-año, y las mujeres con VPH 16 o VPH 18 positivo y citología negativa tuvieron un riesgo de 318,2 por 100.000 personas-año. En este mismo estudio se observó que las mujeres que participaron en un cribado basado en el VPH tuvieron un riesgo 28% menor de cáncer cervical invasivo en comparación con las mujeres que participaron en una citología (HR: 0,72; IC del 95%: 0,54-0,95).
Coincidimos claramente en la necesidad de cambios de paradigmas en el tamizaje del cáncer cervical, virando a un tamizaje virológico.
VII. CONCLUSIONES
El cambio de paradigma en la prevención del CCU es una realidad; desde hace varios años se están implementando en el mundo programas de tamizaje basados en detección de ADN-VPH, dado que los programas de tamizaje basados en citología se han encontrado con limitaciones para alcanzar el impacto deseado en la reducción de la incidencia y mortalidad por CCU, especialmente en los países de ingresos medios y bajos.
Los programas de prevención basados en pruebas de detección de VPH, representan una gran oportunidad para mejorar el desempeño del tamizaje. Además, permiten la modalidad de autotoma, lo que implica un gran potencial para aumentar la cobertura, en particular entre mujeres que habitualmente no concurren a los servicios de salud.
Existe evidencia sólida para recomendar la utilización de la prueba de VPH en el tamizaje del CCU a partir de los 25-30 años (según el test utilizado); basado en décadas de estudios que comparan su eficacia con la citología.
Esto ha sido posible gracias a un mejor entendimiento del riesgo que produce la infección persistente por los tipos de VPH de alto riesgo.
De acuerdo con nuestros resultados, concluimos que debe considerarse la transición del tamizaje de CCU basado en citología hacia uno basado en pruebas de VPH.
La utilización de un equipo de detección molecular individual de 28 tipos de VPH reveló la presencia de al menos un genotipo de VPH-AR en más de una de cada cinco mujeres (23%); así como numerosas infecciones mixtas (con más de un tipo de VPH). En nuestro estudio, el VPH-AR más frecuente fue el 31 (13,4%) observándose una baja circulación de 16 y 18, probablemente como resultado de la vacunación. Por lo tanto, la genotipificación completa permitiría determinar los tipos VPH prevalentes en nuestra población en la era de la vacunación.
Con la incorporación de la genotipificación completa al tamizaje, contamos con información detallada sobre genotipos individuales, lo cual podría ser considerado en futuros algoritmos para el manejo de mujeres con resultados positivos para VPH de alto riesgo y negativos en la prueba de Papanicolaou, especialmente en poblaciones con alta cobertura de vacunación y considerando el reemplazo de tipo de VPH.
Creemos que la genotipificación completa de los tipos de VPH de alto riesgo representa el futuro del tamizaje, ya que permitirá categorizar con mayor precisión el riesgo que implica la persistencia asociado a cada tipo de VPH. Esto abrirá la posibilidad de desarrollar algoritmos de manejo más personalizados y eficientes, especialmente en escenarios con alta cobertura de vacunación y con reemplazo de tipos virales.
Referencias
- https://www.who.int/cancer/prevention/diagnosis-screening/cervical-cancer/en/
- Human Papillomavirus and Related Diseases Reports Argentina junio 2023 https://hpvcentre.net/statistics/reports/ARG.pdf consultado el 20/07/2025
- Wang SS, Sherman ME, Hildesheim A, Lacey JV Jr, Devesa S. Cervical adenocarcinoma and squamous cell carcinoma incidence trends among white women and black women in the United States for 1976-2000. 2004; 100 (5): 1035-44
- Bray F, Carstensen B, Møller H, Zappa M, Zakelj MP, Lawrence G, Hakama M, Weiderpass E. Incidence trends of adenocarcinoma of the cervix in 13 European countries. Cancer Epidemiol Biomarkers 2005; 14 (9): 2191-9.
- Liu S, Semenciw R, Mao Y. Cervical cancer: the increasing incidence of adenocarcinoma and adenosquamous carcinoma in younger women. 2001; 164 (8): 1151-2.
- Liu S, Semenciw R, Probert A, Mao Y. Cervical cancer in Canada: changing patterns in incidence and Int J Gynecol Cancer. 2001; 11 (1): 24-31
- Stoler MH1, Schiffman M; Atypical Squamous Cells of Undetermined Significance-Low-grade Squamous Intraepithelial Lesion Triage Study (ALTS) Group. Interobserver reproducibility of cervical cytologic and histologic interpretations: realistic estimates from the ASCUS-LSIL Triage Study. 2001; 285 (11): 1500-5.
- Stoler MH, Wright TC, Sharma A, Apple R, Gutekunst K, Wright TL. High-Risk Human Papillomavirus Testing in Women With ASC-US Cytology Results From the ATHENA HPV Study. Am J Clin Pathol. 2011; 135(3):468–75.
- Wright TC Jr., Cox JT, Massad LS, Twiggs LB, Wilkinson EJ. 2001 Consensus Guidelines for the management of women with cervical cytological abnormalities. 2002; 287(16):2120–9.
- Edgerton N, Cohen C, Siddiqui Evaluation of CINtec PLUS1 testing as an adjunctive test in ASCUS diagnosed SurePath1 preparations. Diagn Cytopathol. 2013; 41(1):35–40
- Lapierre SG, Sauthier P, Mayrand M-H, Dufresne S, Petignat P, Provencher D, et al. Human papillomavirus (HPV) DNA triage of women with atypical squamous cells of undetermined significance with cobas 4800 HPV and Hybrid Capture 2 tests for detection of high-grade lesions of the uterine cervix. J Clin Microbiol. 2012; 50(4):1240–4.
- Cuzick J, Clavel C, Petry KU, Meijer CJ, Hoyer H, Ratnam S, Szarewski A, Birembaut P, Kulasingam S, Sasieni P, Iftner Overview of the European and North American studies on HPV testing in primary cervical cancer screening. Int J Cancer. 2009; 119 (5): 1095-101.
- Rijkaart DC1, Berkhof J, Rozendaal L, van Kemenade FJ, Bulkmans NW, Heideman DA, Kenter GG, Cuzick J, Snijders PJ, Meijer Human papillomavirus testing for the detection of high-grade cervical intraepithelial neoplasia and cancer: final results of the POBASCAM randomised controlled trial. Lancet Oncol. 2012; 13 (1): 78-88.
- Ronco G1, Giorgi-Rossi P, Carozzi F, Confortini M, Dalla Palma P, Del Mistro A, Ghiringhello B, Girlando S, Gillio- Tos A, De Marco L, Naldoni C, Pierotti P, Rizzolo R, Schincaglia P, Zorzi M, Zappa M, Segnan N, Cuzick J; New Technologies for Cervical Cancer screening (NTCC) Working Group. Efficacy of human papillomavirus testing for the detection of invasive cervical cancers and cervical intraepithelial neoplasia: a randomised controlled Lancet Oncol. 2010; 11 (3): 249-57
- Castle PE, Stoler MH, Wright TC Jr, Sharma A, Wright TL, Behrens CM. Performance of carcinogenic human papillomavirus (HPV) testing and HPV16 or HPV18 genotyping for cervical cancer screening of women aged 25 years and older: a subanalysis of the ATHENA study. Lancet Oncol. 2011; 12 (9): 880-90)
- Castle PE, Wheeler CM, Solomon D, Schiffman M, Peyton CL; ALTS Group. Interlaboratory reliability of Hybrid Capture 2. Am J Clin Pathol. 2004; 122 (2): 238-45.
- Carozzi FM1, Del Mistro A, Confortini M, Sani C, Puliti D, Trevisan R, De Marco L, Tos AG, Girlando S, Palma PD, Pellegrini A, Schiboni ML, Crucitti P, Pierotti P, Vignato A, Ronco Reproducibility of HPV DNA Testing by Hybrid Capture 2 in a Screening Setting. Am J Clin Pathol. 2005; 124 (5): 716-21
- Ronco G, Dillner J, Elfström KM, Tunesi S, Snijders PJ, Arbyn M, Kitchener H, Segnan N, Gilham C, Giorgi-Rossi P, Berkhof J, Peto J, Meijer CJ; International HPV screening working group. Efficacy of HPV-based screening for prevention of invasive cervical cancer: follow-up of four European randomised controlled trials. 2014; 383 (9916): 524-32.
- Sankaranarayanan R1, Nene BM, Shastri SS, Jayant K, Muwonge R, Budukh AM, Hingmire S, Malvi SG, Thorat R, Kothari A, Chinoy R, Kelkar R, Kane S, Desai S, Keskar VR, Rajeshwarkar R, Panse N, Dinshaw HPV screening for cervical cancer in rural India. N Engl J Med. 2009; 360 (14): 1385-94
- Melnikow J, Henderson JT, Burda BU, et al. Screening for Cervical Cancer With High-Risk Human Papillomavirus Testing: A Systematic Evidence Review for the US Preventive Services Task Force: Evidence Synthesis No. 158. Rockville, MD: Agency for Healthcare Research and Quality; 2018. AHRQ publication 15-05224-EF-1
- Ronco G, Giorgi-Rossi P, Carozzi F, et al; New Technologies for Cervical Cancer Screening Working Human papillomavirus testing and liquid-based cytology in primary screening of women younger than 35 years: results at recruitment for a randomised controlled trial. Lancet Oncol. 2006;7(7):547-555.
- Ronco G, Segnan N, Giorgi-Rossi P, et al; New Technologies for Cervical CancerWorking Group. Human papillomavirus testing and liquid-based cytology: results at recruitment from the new technologies for cervical cancer randomized controlled trial. J Natl Cancer Inst. 2006;98(11):765-774
- Ogilvie GS, Krajden M, van Niekerk D, et al. HPV for cervical cancer screening (HPV FOCAL): Complete round 1 results of a randomized trial comparing HPV-based primary screening to liquid-based cytology for cervical cancer. Int J Cancer. 2017;140(2):440-448
- Leinonen MK, Nieminen P, Lönnberg S, et Detection rates of precancerous and cancerous cervical lesions within one screening round of primary human papillomavirus DNA testing: prospective randomised trial in Finland. BMJ. 2012; 345:e7789
- Canfell K, Caruana M, Gebski V, et al. Cervical screening with primary HPV testing or cytology in a population of women in which those aged 33 years or younger had previously been offered HPV vaccination: results of the Compass pilot randomised trial. PLoS Med. 2017;14(9):e1002388.
- Mitra A, MacIntyre DA, Marchesi JR, Lee YS, Bennett PR, Kyrgiou The vaginal microbiota, human papillomavirus infection and cervical intraepithelial neoplasia: what do we know and where are we going next? Microbiome. 2016 Nov 1;4(1):58. doi: 10.1186/s40168-016-0203-0. PMID: 27802830; PMCID: PMC5088670
- https://paho.org/es/fin-cancer-cervicouterino
- zur Hausen H, Human genital cáncer; synergism between two virus infections and/or synergism between a virus infection and initiating events? Lancet 1982; 2 (8312):1370–1372
- zur Hausen H, Papillomavirus infections – a major cause of human Biochim. Biophys. Acta 1996; 1288 (2): F55–F78
- Walboomers JMM, Jacobs MV, Manos MM, et al. Human papillomavirus is a necessary cause of invasive cervical cancer worldwide. J Pathol 1999; 189: 12-19
- Cuzick J., Berverley E., Ho l., Terry G., Sapper H., Mielzynska I., Lorincz A., Chan W., Krausz T., Soutter P HPV testing in primary screening of older women. Br J Ca 1999; 81 (3):554-448
- zur Hausen Papillomaviruses in human cancers. Proc.Assoc. Am. Physicians 1999; 111: 581 – 587
- Doorbar J., Quint W., Banks L., Bravo I., Stoler M., Broker T., Stanley M. The biology and life-cycle of human papillomaviruses. Vaccine 2012; 30 (Suppl 5): F55-70
- Ho GY, Bierman R., Beardsley L, Chee J. Chang J., Burk R. Natural History of Cervicovaginal Papillomavirus Infection in Young Women N Engl J Med 1998; 388: 423-428
- Schiffman M, Castle PE Human Papillomavirus Epidemiology and Public Health Arch Pathol Lab Med 2003; 127: 930-934
- Bosch FX, Lorincz ,Muñoz M., Meijer C., Shah k. The causal relation between Human Papillomavirus and Cervical Cancer J Clin Pathol 2002; 55: 244-265
- Clavel C, Masure M, Bory JP, Putaud I, Mangeonjean C, Lorenzato M, Gabriel R, Quereux C., Birembaut Hybrid capture II-*based human papillomavirus detection, a sensitive test to detect in rutine high-grade cervical lesions: a preliminary study on 1518 women. Br J Cancer 1999; 80 (9): 1306-1310
- Cuzick Human Papillomavirus testing for primary cervical cancer screening JAMA 2000; 283 (1):108-109
- Sotlar K, Stubner A, Diemer D., Menton S., Menton M., Dietz K., Wallwiener D., Kandolf R., Bültmann B. Detection of high‐risk human papillomavirus E6 and E7 oncogene transcripts in cervical scrapes by nested RT‐polymerase chain reaction. J Med Virol 2004; 74(1): 107‐116
- Lie AK, Risberg B, Borgea , Sandstadbc B., Delabiea J., Rimalad R., Onsrude M., Thoresenf S. DNA‐versus RNA‐ based methods for human papillomavirus detection in cervical neoplasia. Gynecol. Oncol 2005; 97(3): 908‐915
- Castle PE, DockterJ, Giachetti C, Garcia F, McCormick M, Mitchell A, Holladay E., Kolk D. A cross-sectional study of a prototype carcinogenic human papillomavirus E6/E7 messenger RNA assay for detection of cervical precancer and cancer Cancer Res 2007; 13(9), 2599‐2605
- GLOBOCAN 2025 https://gco.iarc.fr/today/en/dataviz/maps-heatmap?mode=population&sexes=2&cancers=23 Consultado el 12/6/2025
- Detailed Guide: What are the key statistics about cervical cancer? American Cancer Society website. https://cancer.org/cancer/cervical-cancer.html. consultado el 29/5/25
- Cervical Cancer UK Mortality Cancer Research UK website.https://www.cancerresearchuk.org/about- cancer/cervical-cancer consultado el 29/5/25
- Ministerio de Salud de la Nación. Instituto Nacional del Cáncer https://argentina.gob.ar/salud/instituto- nacional-del-cancer/estadisticas/mortalidad- ccu#:~:text=En%20relaci%C3%B3n%20con%20el%20c%C3%A1ncer,%2C3%20cada%20100.000%20mujeres). Consultado el 30/06/2025
- Prevención del Cáncer Cérvico-uterino https://argentina.gob.ar/sites/default/files/bancos/2021-07/2021-07- 07-tomadores-vph.pdf Consultado el 15/07/2025
- Arrossi, S., Thouyaret L., Herrero R., Campanera A., Magdaleno A., Cuberli M., Barletta P., Laudi R., Orellana L. The EMA Study Team Effect of self-collection of HPV DNA offered by community health workers at home visits on uptake of screening for cervical cancer (the EMA study): a population-based cluster-randomised trial. The Lancet Global Health, Volume 3, Issue 2, e85 - e94
- Winer RL, Hughes JP, Feng Q, Xi L, Cherne S, O'Reilly S, Kiviat N., Koutsky L. Early natural history of incident, type-specific human papillomavirus infections in newly sexually active young Cancer Epidemiol Biomarkers Prev 2011;20 (4): 699–707.
- Woodman , Collins S., Young L. The natural history of cervical HPV infection: unresolved issues Nature Reviews Cancer 2007; 7: 11-22.
- Alazawi W, Pett M., Arch B., Scott L., Freeman T., Stanley M., Coleman N. Changes in cervical keratinocyte gene expression associated with integration of human papillomavirus 16. Cancer Res 2002; 62: 6959-6965
- Castellsague X, Munoz Chapter 3: Cofactors in human papillomavirus carcinogenesis-role of parity, oral contraceptives, and tobacco smoking. J Natl Cancer Inst Monogr 2003; 20–28.
- Plummer M, Herrero R, y col. Smoking and cervical cancer: pooled analysis of the IARC multi-centric case-control Cancer Causes Control 2003;14:805–14
- Moreno V, Bosch X., Muñoz N., Meijer C., Shah K., Walboomers J., Herrero R., Franceschi s. for the International Agency for Research on Cancer (IARC) Multicentric Cervical Cancer Study Group. Effect of oral contraceptives on risk of cervical cancer in women with human papillomavirus infection: the IARC multicentric case-control study. Lancet 2002; 359:1085–92
- Muñoz N, Franceschi S., Bosetti C., Moreno V., Herrero R., Smith J., Shah K., Meijer C., Bosch X., for the International Agency for Research on Cancer (IARC) Multicentric Cervical Cancer Study Group Role of parity and human papillomavirus in cervical cancer: The IARC multicentric case-control study. Lancet 2002;359:1093–101.
- Vermund , Kelley K. Impact of HIV on human papilloma virus-mediated cervical disease progression AIDS 2018, 32:1715–1717
- Reinholdt K., Thomsen L., Dehlendorff C., Larsen H., Sørensen S., Hædersdal M., Kjær S. Human papillomavirus (HPV)-related anogenital premalignancies and cancer in renal transplant recipients: a Danish nationwide, registry- based cohort study. Int J Ca 2020; 146 (9): 2413-2422
- Jacobs M, Walboomers J., Snijders P., Voorhorst F., Verjeijen R., Fransen-Daalmeijer N., Meijer C. Distribution of 37 mucosotropic HPV types in women cytologically normal cervical smears: the age-related patterns for high-risk and low-risk types. Int J Cancer 2000; 87: 221-227
- Rozendaal L, Walboomers J., van der Linden J., Voorhorst F., Kenemans P., Helmerhost T., van Ballegooijen M., Meijer PCR-based high-risk HPV test in cervical cancer screening gives objective risk assessment of women with cytomorphologically normal cervical smears Int J Cancer 1996; 68 (6): 766-9
- Nobbenhuis M, Walboomers , Helmerhorst T., Rozendaal L., Remmink A., Risse E., van der Linden H., Voorhorst F., Kenemans P., Meijer C. Relation of human papillomavirus status to cervical lesions and consequences for cervical cancer screening: a prospective study. Lancet 1999; 354: 20-25
- Nielsen C., Lang Principles of screening. Med Clin North Am. 1999; 83(6): 1323-1337.
- Garland S., Hernandez-Avila M., Wheeler C., Perez G., Harper D., Leodolter S., Tang G., Ferris D., Steben M., Bryan J., Taddeo F., Railkar R., et al., for the Females United to Unilaterally Reduce Endo/Ectocervical Disease (FUTURE) I Investigators Quadrivalent Vaccine against Human Papillomavirus to Prevent Anogenital Diseases N Engl J Med 2007; 356 (19): 1928 – 1943
- Villa , Perez G et al for the Quadrivalent Vaccine against Human Papillomavirus to Prevent High-Grade Cervical Lesions N Engl J Med 2007; 356 (19): 1915 – 1927
- Paavonen J., Naud P., Salmerón J., Wheeler C., Chow S., Apter D., Kitchener H., Castellsague X., Teixeira J., Skinner S., Hedrick J., Jaisamrarn U., Limson G., Garland S., Szarewski A., Romanowski B., Aoki F., Schwarz T., Dubin G. Efficacy of human papillomavirus (HPV) -16/18 AS04-adjuvanted vaccine against cervical infection and precancer caused by oncogenic HPV types PATRICIA: final analysis of a double-blind, randomized study in young women. Lancet 2009; 374 (9686): 301-314
- Zhou J, Sun XY, Stenzel DJ, Frazer Expression of vaccinia recombinant HPV 16 L1 and L2 ORF proteins in epithelial cells is sufficient for assembly of HPV virion-like particles. Virology 1991; 185: 251–257
- Kirnbauer R, Booy F, Cheng N, Lowy DR, Schiller JT. Papillomavirus L1 major capsid protein self-assembles into virus-like particles that are highly immunogenic. Proc Natl Acad Sci 1992; 89:12180– 12184
- Schiller JT, Lowy Papillomavirus-like particles and HPV vaccine development. Semin Cancer Biol 1996; 7:373– 382
- Harro C., Pang Y, Roden R., Hildesheim A., Wang Z., Reynolds M., Mast C., Robinson R., Murphy B., Karron R., Dillner J., Schiller J., Lowy D. Safety and immunogenicity trial in adult volunteers of a human papillomavirus 16 L1 virus-like particle vaccine. J Natl Cancer Inst 2001; 93: 284–292.
- http://www.msal.gob.ar/index.php/home/organigrama/269-vacuna-vph accesado el 14/6/25
- Wilson J, Jungner Principles and practice of screening for disease. World health Organization Public Health Paper 34, WHO, Geneva 1968
- Cabello Lopez El consejo médico: la prevención primaria y secundaria de la enfermedad, principios del screening. Medicine 1998; 7(104): 4866-4871
- Arbyn M., Depuydt C., Benoy I., Bogers J., Cuschieri K., Schmitt M., Pawlita M., Geraets D., Heard I., Gheit T., Tommasino M., Poljak M., Bonde J., Quint W..VALGENT: a protocol for clinical validation of human papillomavirus Journal of Clinical Virology http://dx.doi.org/doi:10.1016/j.jcv.2015.09.014
- Vilos G The history of the Papanicolaou smear and the Odyssey of George and Andromache Papanicolaou Obstet Gynecol 1998; 91:479-483
- Cancer, IARC International Agency for Research on Cervix Cancer Screening. s.l. : Iarc Handbooks of Cancer Prevention, 2005. 10. IARCPress Lyon. https://www.cabdirect.org/cabdirect/abstract/20063099485 accesado el 14/6/20
- Koss L The Papanicolaou Test for Cervical Cancer Detection A Triumph and a Tragedy JAMA 1989; 261 (5): 737- 743
- Nanda K, McCrory , Myers E., Bastian L., Hasselblad V., Hickey J., Matchar D.Accuracy of the Papanicolaou test in screening for and follow-up of cervical cytologic abnormalities: a systematic review. Ann Intern Med 2000; 132:810-819
- Ronco G., Cuzick J., Pierotti P., Cariaggi M., Dalla Palma P., Naldoni C., Ghiringhello B., Giorgi-Rossi P., Minucci D., Parisio F., Pojer A., Schiboni M., Sintoni C., Zorzi M., Segnan N., Confortini M. and the New Technologies for Cervical Cancer Screening (NTCC) Working Group Accuracy of liquid based versus conventional cytology: overall results of new technologies for cervical cancer screening randomised controlled trial BMJ 2007; 335: 28-34
- Powell Biographic Sketch: Powell_s Pearls : Hans Peter Hinselmann, MD (1884-1959). Obstet Gynecol Surv 2004;59:693-695
- Longhatto- Filho A., Naud P., Derchain , Roteli-Martins C., Tatti S., Hammes L., Sarian L., Eržen M., Branca M., Matos J., Gontijo R., Maeda M., Lima T., Costa S., Syrjänen S., Syrjänen K. Performance characteristics of Pap test, VIA, VILI, HR-HPV testing, cervicography, and coloscopy in diagnosis of significant cervical pathology . LAMS study, Virchows Archiv 2012; 460: 577–585
- Schneider A, Hoyer H, Lotz B Leistritza S., Kühne‐Heid R., Nindl I., Müller B., Haerting J., Dürst M. Screening for high-grade cervical intra-epithelial neoplasia and cancer by testing for high-risk HPV, routine cytology or colposcopy. Int J Cancer 2000; 89: 529-534.
- Bornstein J , J Bentley , Bösze P , F Girardi , H Haefner , M Menton , Perrotta M, W Prendiville , Russell P , M Sideri, B Strander, Tatti S , A Torne , Walker P. Nomenclatura de la Federación Internacional de Colposcopia y Patología Cervical: IFCPC 2011 Obstet Gynecol 2012; 120 (1) :166-172
- Rowen Toward a human papillomavirus vaccine. Dermatol Clinics. 1998; 16: 835-838
- Ferenczy A, Franco Persistent human papillomavirus infection and cervical neoplasia. Lancet Oncol 2002; 3:11- 16.
- Wright , Denny L., Kun L. HPV DNA Testing of self collected vaginal samples compared whith cytologic screening to detect cervical cancer. JAMA 2000; 283(1): 81-86
- Gök M, Heideman D., van Kemenade F., Berkhof J, Rozendaal L., Spruyt J., Voorhorst F., Beliën J., Babović M., Snijders P.,
- Meijer C. HPV testing on self collected cervicovaginal lavage specimens as screening method for women who do not attend cervical screening: cohort study. BMJ 2010; 340: c1040
- Lazcano-Ponce E, Lorincz A., Cruz Valdez A., Salmerón J., Uribe P., Velasco-Mondragón E., Hernandez-Nevarez P., Diaz-Acosta R., Hernández-Avila M. Self-collection of vaginal specimens for human papillomavirus testing in cervical cancer prevention (MARCH): a community-based randomised controlled Lancet 2011; 378: 1868–1873
- Arbyn M, Verdoodt F., Snijders P.,Verhoef V., Suonio E., Dillner L., Minozzi S., Bellisario C., Banzi R., Zhao F., Hillemanns P., Anttila A. Accuracy of human papillomavirus testing on self-collected versus clinician-collected samples: a meta-analysis. Lancet Oncol 2014; 15: 172–183.
- Munger K, Baldwin , Edwards K., Hayakawa H., Nguyen C., Owens M., Grace M., Huh K. Mechanisms of human papillomavirus-induced oncogenesis. J Virol .2004; 78, 11451-1160
- Cuschieri K., Whitley M., Cubie H. Human papillomavirus type specific DNA and RNA persistence-Implications for cervical disease progression and monitoring. Med. Virol. 2004, 73, 65-70
- Smits H, van Gemen R Schukkink R., Van Der Velden J., Tjong-a-hung S., Jebbink M., Schegget J.Application of the NASBA nucleic acid amplification method for the detection of human papillomavirus type 16 E6-E7 transcripts J Virol Methods 1995; 54: 75-81
- Ibeanu Molecular pathogenesis of cervical cancer. Cancer Biol Ther 2011;11:295–306.
- Schweizer J, Lu PS, Mahoney C., Berard-Bergery M., Ho , Ramasamy V., Silver J., Bisht A., Labiad Y., Peck R., Lim J., Jeronimo J., Howard R., Gravitt P., Castle P. Feasibility study of a human papillomavirus E6 oncoprotein test for diagnosis of cervical precancer and cancer. J Clin Microbiol 2010; 48: 4646–8.
- Torres KL, Mariño JM, Pires Rocha DA, Bandeira de Melo M., Farah H., Dos Santos Reis R., Rodriguez Alves V., Gomes E., Martins T., Soares A., Mendes de Olivera ., Levi J. Self-Sampling coupled to the detection of HPV 16 and 18 E6 protein: a promising option for detection of cervical malignancies in remote areas. PLoS One 2018;13:e0201262.
- Yu L, Jiang M, Qu P, Wu , Sun P., Xi M., Qin X., Liu X., Liao G., Lei X., Sun L., Zhang Y., Li Z., Chen W., Qiao YL Clinical evaluation of human papillomavirus 16/18 oncoprotein test for cervical cancer screening and HPV positive women triage. Int J Cancer 2018;143:813–22
- Ferrera A, Valladares W, Cabrera Y, Hernandez M., Darragh T., Baena A., Almonte , Herrero R. Performance of an HPV 16/18 E6 oncoprotein test for detection of cervical precancer and cancer. Int J Cancer 2019;145: 2042–50.
- Tsoumpou I, Arbyn M, Kyrgiou M, Wntzensen N., Koliopoulos G., Martin-Hirsh P., Mitsi V., Paraskevaidis E. p16 (INK4a) immunostaining in cytological and histological specimens from the uterine cervix: a systematic review and meta-analysis. Cancer Treat Rev 2009;35:210–20.
- Carozzi F, Confortini M, Dalla Palma P., Del Mistro A., Gillio-Tos A., De Marco L., GiorgiRossi P., Pontenani G., Rosso S., Sani C., Sintoni C., Segnan N., Zorzi M., Cuzick J., Rizzolo R., Ronco R., the New Technologies for Cervival Cancer screening (NTCC) Use of p16-INK4A overexpression to increase the specificity of human papillomavirus testing: a nested substudy of the NTCC randomised controlled trial. Lancet Oncol 2008; 9:937–45.
- Denis H, Ndlovu MN, Fuks Regulation of mammalian DNA methyltransferases: a route to new mechanisms. EMBO Rep. 2011;12: 647–656.
- Naumann RW, Wendel Naumann The role of the phosphatidylinositol 3-kinase (PI3K) pathway in the development and treatment of uterine cancer. Gynecol Oncol. 2011; 411–420.
- Balaguer F., Moreira L. Hospital Clínic. Barcelona. España. Epigenómica. 2010; 9 (4). http://aeeh.es/wp- content/uploads/2012/04/v9n4a619pdf001.pdf accesado el 10/7/25
- Meijer C, Berkhof J, Castle P, Hesselink A, Franco E, Ronco G, Arbyn M, Bosch X, Cuzick J, Dillner J, HeidemanD, Snijders P Guidelines for human papillomavirus DNA test requirements for primary cervical cancer screening in women 30 years and older J. Cancer 2009; 124, 516–520
- Sankaranarayanan , Nene B, Shastri S, Jayant k, Muwonge R, Budukh A, Hingmires S,. Malvi S, Thorat R, Kothari A, Chinoy R, Kelkar R, y col HPV Screening for Cervical cáncer in Rural India. New Engl J Med 2009; 360 (14): 1385-1394
- Kjaer S., Høgdall E, Frederiksen K, Munk C, van den Brule A, Svare E, Meijer C, Lorincz A., Iftner T The Absolute Risk of Cervical Abnormalities in High-risk Human Papillomavirus–Positive, Cytologically Normal Women Over a 10- Year Period Cancer Res 2006; 66(21): 10630-6
- Ronco G, Segnan N, Giorgi-Rossi P, Zappa M, Casadei G, Carozzi F, Dalla Palma P, Del Mistro A, Folicaldi S, Gillio-Tos A, Nardo G, Naldoni C, Schincaglia P, Zorzi M, Confortini M, Cuzick J For the New Technologies for Cervical Cancer Working Human Papillomavirus Testing and Liquid-Based Cytology: Results at Recruitment From the New Technologies for Cervical Cancer Randomized Controlled Trial JNCI 2006; 98 (11): 765–774
- Cuzick , Clavel C., Petry K., Meijer C., Hoyer H., Ratnam S., Szarewski A., Birembaut P., Kulasingam S., Sasieni P., Iftner T. Overview of the European and North American studies on HPV testing in primary cervical cancer screening Int. J. Cancer: 2006; 119: 1095–1101
- Kahn MJ, Castle PE, Lorincz AT, Wacholder S, Sherman , Scott D., Rush B., Glass A., Schiffman M. The elevated 10-year risk of cervical pre-cancer and cancer in women with HPV type 16 or 18 and possible utility of type specific HPV testing in clinical practice. J Natl Cancer Inst. 2005; 97: 1072-1079
- Gök M, Heideman DA, van Kemenade FJ, Berkhof J, Rozendaal L, Spruyt JW, et al. HPV testing on self-collected cervicovaginal lavage specimens as screening method for women who do not attend cervical screening: cohort study. BMJ. 2010; 340:c1040.
- Lazcano-Ponce E, Lorincz AT, Cruz-Valdez A, Salmerón J, Uribe P, Velasco-Mondragón E, et al. Self-collection of vaginal specimens for human papillomavirus testing in cervical cancer prevention (MARCH): a community-based randomised controlled trial. 2011; 378 (9806): 1868-1873
- Arbyn M, Verdoodt F, Snijders PJ, Suonio E, Dillner L, et al. Accuracy of human papillomavirus testing on self- collected versus clinician-collected samples: a meta-analysis. Lancet Oncol. 2014. 15 (2): 172-183
- Dillner J. Rebolj M. Birembaut P. Ullrich Petry K., Szarewski A., Munk C., de Sanjose S., Naucler P., Lloveras B., Kjaer S., Cuzick J., van Ballegooijen M., Clavel C., Iftner T. Long term predictive values of cytology and human papillomavirus testing in cervical cancer screening: joint European cohort study. BMJ. 2008; 337: a1754
- Arbyn M, Sasieni P, Meijer CJ, Clavel C, Koliopoulos G, Dillner Chapter 9: Clinical applications of HPV testing: A summary of metaanalyses. Vaccine 2006; 24 (Suppl 3):S78–S89.
- Castle PE, Wheeler CM, Solomon D, Schiffman M, Peyton CL, ALTS Interlaboratory reliability of Hybrid Capture 2. Am J Clin Pathol 2004; 122: 238–245.
- https://argentina.gob.ar/salud/instituto-nacional-del-cancer/estadisticas/incidencia consultado el 10/7/25
- https://argentina.gob.ar/salud/instituto-nacional-del-cancer/estadisticas/mortalidad consultado el 10/7/25
- Bergeron C, Giorgi-Rossi P, Cas F, Schiboni ML, Ghiringhello B, Dalla Palma P, et Informed cytology for triaging HPV-positive women: substudy nested in the NTCC randomized controlled trial. J Natl Cancer Inst. 2015; 107(2): dju423.
- Arrossi S, Thouyaret L, Herrero R, Campanera A, Magdaleno A, Cuberli M, Barletta P, Laudi R, Orellana L, EMA study team. Effectiveness of HPV self-collection offered by community health workers at home visits to increase screening uptake (EMA study): A cluster randomized trial. Lancet Glob Health 2015; 3: e85-94
- https://colpoweb.org/archivos/Guia_2022_Manejo_del_tamizaje_anormal_y_de_las_lesiones_histologicas_d el_cuello_uterino.pdf accesado 22/7/2025
- Perkins , Guido R., Castle P., Chelmow D., Einstein M., Garcia F., Huh W., Kim J., Moscicki AB., Nayar R., Saraiya M., Sawaya G., Wentzensen N., Schiffman M., for the 2019 ASCCP Risk-Based Management Consensus Guidelines Committee 2019 ASCCP Risk-Based Management Consensus Guidelines for Abnormal Cervical Cancer Screening Tests and Cancer Precursors J Low Genit Tract Dis 2020; 24: 102–131
- EgemenD, Cheung LC, ChenX, Demarco M., Perkins R., Kinney W., Poitras N., Befano B., Locke A., Guido R., Wiser A., Gage J., Katki H., Wentzensen N., Castle , Schiffman M., Lorey T. Risk estimates supporting the 2019 ASCCP Risk-Based Management Consensus Guidelines. J Low Genit Tract Dis 2020; 24:132–43.
- Schiffman M, Kinney WK, Cheung LC, et Relative performance of HPV and cytology components of cotesting in cervical screening. J Natl Cancer Inst 2018;110:501–508.
- Wentzensen N., Massad , Mayeaux Jr E., Khan M., Waxman A., Einstein M, Conageski C, Schiffman M, Gold M, Apgar B, Chelmow D, Choma D, Darragh T, Gage J., Garcia F., Guido R., Jeronimo J., Liu A., Mathews C., MitchellM., Moscicki AB., Novetsky A., Papasozomenos T., Perkins R., Silver M., Smith K., Stier E., Tedeschi C., Werner C., Huh W. Evidence-Based Consensus Recommendations for Colposcopy Practice for Cervical Cancer Prevention in the United States J Low Genit Tract Dis 2017; 21(4):216-222.
- Nayar, , & Wilbur, D. C. (2015). The Pap test and Bethesda 2014. Cancer cytopathology, 123(5), 271– https://doi.org/10.1002/cncy.21521
- Darragh TM, Colgan TJ, Cox JT, Heller DS, Henry MR, Luff RD, McCalmont T, Nayar R, Palefsky JM, Stoler MH, Wilkinson EJ, Zaino RJ, Wilbur DC; Members of LAST Project Work Groups. The Lower Anogenital Squamous Terminology Standardization Project for HPV-Associated Lesions: background and consensus recommendations from the College of American Pathologists and the American Society for Colposcopy and Cervical J Low Genit Tract Dis. 2012 Jul;16(3):205-42. doi: 10.1097/LGT.0b013e31825c31dd. Erratum in: J Low Genit Tract Dis. 2013 Jul;17(3):368. PMID: 22820980.
- Allplex™ HPV28 Detection https://helena.anmat.gob.ar/uploads/pdfs/IF-2023-124438532-APN- INPM%20ANMAT.pdf?rnd=1aeceab8-b569-460b-adbb-689760e56e5e consultado el 20/07/2025
- Pimenoff VN, Gray P, Louvanto K, Eriksson T, Lagheden C, Söderlund-Strand A, Dillner J, Lehtinen M. 2023. Ecological diversity profilesof non-vaccine-targeted HPVs after gender-based community vaccination efforts.Cell Host Microbe 31:1921–1929. https://doi.org/10.1016/j.chom.2023.10.001
- Godoy LR, El-Zein M, Padalko E, Verberckmoes B, Van Eenooghe B, Vermandere H, Dias S, Gama A, Vega Crespo B, Neira VA, Franco EL, Longatto-Filho A; ELEVATE Study Group. Comparative performance of cobas 4800 HPV Test and Anyplex II HPV HR for high-risk human papillomavirus detection. J Clin Microbiol. 2025 Jul 9:e0020025. doi: 10.1128/jcm.00200-25. Epub ahead of print. PMID: 40631887.
- Syrjanen Mechanisms and predictors of high-risk human papillomavirus (HPV) clearance in the uterine cervix Eur J Gynaecol Oncol 2007; 28(5):337-51
- Arbyn M. Ronco Anttila A., Meijer C., Poljak M., Oglivie G., Koliopoulos G., Naucler P., Sankarayanan R., Peto. Evidence regarding HPV testing in secondary prevention of cervical cancer. Vaccine. 2012; 30: F88-F99
- Rachael Adcock PhD, Cosette Wheeler PhD, William C. Hunt, MA, Norah E. Torrez-Martinez, Michael Robertson BS, Ruth McDonald MS, Nancy E. Joste MD MS2, Mark H. Stoler MD, MauritsN.C. de Koning PhD4, Wim G.V. Quint PhD, on behalf of the New Mexico HPV Pap Registry Steering Committee members J Natl Cancer Inst. 2025 Jul 1;117(7):1377-1386. doi: 10.1093/jnci/djaf055. PMID: 40069924; PMCID: PMC12229469.
- González JV, Deluca GD, Correa RM, Liotta DJ, Basiletti JA, Fellner MD, Colucci MC, Alzogaray OG, Katz N, Carmona JJ, Tappari NF, Berner E, Cramer V, Real P, López Kaufman CV, Kosoy GJ, Katabian L, Severino MS, Aboslaiman RE, Chami C, Totaro ME, Rogoski C, Giurgiovich AJ, Martínez GL, Plana LM, Vizzotti C, Picconi MA. Strong reduction in prevalence of HPV16/18 and closely related HPV types in sexually active adolescent women following the introduction of HPV vaccination in Argentina. Papillomavirus Res. 2020 Dec;10:100208. doi: 10.1016/j.pvr.2020.100208. Epub 2020 Nov 6. PMID: 33161174; PMCID: PMC7683272.
- Bruni, L., Albero, G., Serrano, B., Mena, M., Collado, J. , Gómez, D., Muñoz, J., Bosch, F. X., & de Sanjosé, S. (2023, March 10). Human Papillomavirus and Related Diseases in the World. ICO/IARC Information Centre on HPV and Cancer.
- ASCUS-LSIL Triage Study (ALTS) Group Results of a randomized trial on the management of cytology interpretations of atypical squamous cells of undetermined significance Am J Obstet Gynecol 2003;188:1383-1392
- Wentzensen N, Schiffman M, Silver M, Khan M, Perkins , Smith K., Gage J., Gold M., Conageski C., Einstein M., Mayeaux E., Waxman A., Huh H., Massad L. J Low Genit Tract Dis. 2017;21 (4): 230-234
- Fontham E,, Wolf A.,Church T., Etzioni R., Flowers C., Herzig A., Guerra C., Oeffinger K., Shih Y., Walter L., Kim J., Andrews , DeSantis C., Fedewa S., Manassaram-Baptiste D., Saslow D., Wender R., Smith R. Cervical Cancer Screening for Individuals at Average Risk: 2020 Guideline Update from the American Cancer Society CA Cancer J Clin 2020; 0: 1-26
- Almonte M., Murillo R., Sánchez G., González P., Ferrera A., Picconi MA., Wiesner C., Cruz-Valdez A., Lazcano- Ponce E., Jerónimo J., Ferreccio , Kasamatsu E., Mendoza L., Rodríguez G., Calderón A., Venegas G., Villagra V., Tatti S., Fleider L., Terán C., Baena A., Hernández ML., Rol ML., Lucas E., Barbier S., Ramírez A., Arrossi S., Rodríguez MI.,González E., Celis M., Martínez S., Salgado Y., Ortega M., Beracochea A., Pérez N., Rodríguez de la Peña M., Ramón M., Hernández-Nevarez P., Arboleda-Naranjo M., Cabrera Y., Salgado B., García L., Retana M., Colucci M., Arias-Stella J., Bellido-Fuentes Y., Bobadilla M.,1 Olmedo G., Brito-García I., Méndez-Herrera A., Cardinal L., Flores B., Peñaranda J., Martínez-Better J., Soilán A.,Figueroa J., Caserta B., Sosa CV., Moreno A., Mural J., Doimi F., Giménez D., Rodríguez H., Lora O., Luciani S., Broutet N., Darragh T., Herrero R. Multicentric study of cervical cancer screening with human papillomavirus testing and assessment of triage methods in Latin America: the ESTAMPA screening study protocol BMJ Open 2020;10:e035796.
- Coldman A. van Niekerk D. Krajden M., Smith L., Cook D., Gondara L., Ceballos K., Quinlan D. Lee M., Elwood- Martin , Gentile L., Peacock S., Stuart G., Franco E., Ogilvie G. Disease Detection at the 48 Month Exit Round of the HPV FOCAL Cervical Cancer Screening Trial in Women Per-Protocol Eligible for Routine Screening Short Title: Per-protocol Exit Results for the FOCAL HPV Screening Trial Int J Cancer 2020;146 (7):1810-1818 HPV vaccine impact: Genotype-specific changes in cervical pre-1 cancer share similarities with changes in cervical screening cytology
- Wang J, Elfström KM, Dillner Human papillomavirus-based cervical screening and long-term cervical cancer risk: a randomised health-care policy trial in Sweden. Lancet Public Health. 2024 Nov;9(11):e886-e895. doi: 10.1016/S2468-2667(24)00218-4. PMID: 39486904.
- Universidad de Buenos Aires, Hospital de Clínicas “José de San Martín”. División Ginecología. Buenos Aires,
- Universidad de Buenos Aires, Facultad de Farmacia y Bioquímica, Cátedra de Microbiología Clínica, Buenos Aires, Argentina.
- Universidad de Buenos Aires, Instituto de Investigación en Fisiopatología y Bioquímica Clínica (INFIBIOC), Buenos Aires, Argentina.
- Universidad de Buenos Aires, Hospital de Clínicas “José de San Martín”, Departamento de Bioquímica Clínica, Inmunología y Virología Clínica, Buenos Aires, Argentina. 4Universidad de Buenos Aires, Hospital de Clínicas “José de San Martín”, División Ginecología, Sección Consultorios Externos, Buenos Aires, Argentina.
- Universidad de Buenos Aires, Hospital de Clínicas “José de San Martín. División Patológica Ginecológica.