Utilidad del cociente sFlt-1/PlGF como predictor de resultados adversos en preeclampsia.
Autores:
Prof. Dr. Roberto Casale1, Mg. Silvana Varela2, Dr. Julián Pascale3, Dr. Jose Ferreiros4, Dra. Ana Corominas5
Resumen
Objetivo
Evaluar la utilidad del cociente sFlt-1/PlGF en embarazadas de riesgo y su relación con PE e identificar puntos de corte y resultados perinatales adversos.
Materiales y Método
Estudio observacional, longitudinal, retrospectivo y analítico. Se analizaron registros perinatales del 2T. Inclusión: control prenatal completo, nacimiento en la institución; exclusión: falta de seguimiento. Se evaluó capacidad diagnóstica en PE y resultados adversos. Se calculó curva ROC.
Resultados
Ingresaron 81 pacientes. Edad media 30.6 (DE 7). 37% con antecedentes HTA. Sin alteraciones hepáticas ni renales. Media de Ácido úrico: 4.6 mg/dL y mediana de proteinuria: 188 mg/24hs. 53% desarrolló HTA, 43% parto prematuro, 10% RCIU, 1 muerte fetal. sFlt-1/PlGF con PE: 77.12 pg/ml (rango: 2.4-962.8); sin PE: 12.2 pg/ml (rango: 0.1-686; p = 0.0016). Punto de corte: 34.87 pg/ml (sensibilidad 72%, especificidad 67%; ABC 0.72, IC 95%: 0.60-0.84. Valores >34.87 pg/ml se asociaron con mayor PE y parto prematuro (p < 0.05).
Palabras claves: Preeclampsia; sFlt-1/PIGF ratio; punto corte; Area Bajo la Curva (ABC)
Abstract:
Objective
To evaluate the usefulness of the sFlt-1/PlGF ratio in at-risk pregnant women and its relationship with PE, and to identify cutoff points and adverse perinatal outcomes.
Materials and Method
observational, longitudinal, retrospective, and analytical study. Perinatal records from 2T were analyzed. Inclusion: complete prenatal care, birth at the institution; exclusion: lack of follow-up. Diagnostic capacity for PE and adverse outcomes were assessed. ROC curve analysis.
Results
81 patients were admitted. Mean age: 30.6 (SD: 7). 37% had hypertension history. No liver or kidney alterations. Mean uric acid: 4.6 mg/dL and median proteinuria: 188 mg/24 hours. 53% developed hypertension, 43% premature birth, 10% IUGR, and 1 fetal death. sFlt-1/PlGF with PE: 77.12 pg/ml (range: 2.4–962.8); without PE: 12.2 pg/ml (range: 0.1–686; p = 0.0016). Cut-off: 34.87 pg/ml (sensitivity 72%, specificity 67%; AUC 0.72, 95% CI: 0.60–0.84). Values >34.87 pg/ml were associated with higher PE and preterm delivery (p < 0.05).
Key words: Preeclampsia; sFlt-1/PIGF ratio; cut-off; AUC
Introducción
La preeclampsia (PE) es una complicación obstétrica que afecta entre el 2% y el 7% de los embarazos y representa una causa importante de morbimortalidad materna y fetal. El diagnóstico clínico suele ser desafiante debido a la superposición de síntomas con otras condiciones médicas.
En términos fisiopatológicos, por una predisposición genética, se produce una insuficiente remodelación de las arterias espiraladas uterinas que genera hipoxia placentaria, desencadenando una alteración endotelial con desequilibrio de factores angiogénicos. Este cambio, no solo contribuye al desarrollo de preeclampsia, sino que también se asocia con complicaciones como parto prematuro y muerte fetal intrauterina.
Se han descripto moléculas, que liberadas por el endotelio hipóxico, predicen y/o diagnostican la preeclampsia, permitiendo un abordaje sintomático oportuno y adecuado a las necesidades de la patología.
El factor antiangiogénico, la tirosina quinasa soluble tipo fms 1 (sFlt-1) y el factor proangiogénico, el factor de crecimiento placentario (PlGF), se pueden medir en plasma y suero en situaciones de riesgo; generalmente se informan como una relación, que se relaciona específicamente con la aparición de la fase sintomática de la preeclampsia.
En este caso, el sFlt-1 aumenta y el PlGF disminuye, por lo que se propone analizar ambas moléculas en un ratio sFlt-1/ PlGF para aumentar la sensibilidad de la detección
La medición de estos marcadores plasmáticos y sus proporciones, puede ser útil para:
- Distinguir la preeclampsia de otros trastornos hipertensivos- proteinúricos en pacientes que presentan características clínicas sospechosas de preeclampsia.
- Predecir el riesgo a corto plazo de progresión a preeclampsia con características graves que requieran hospitalización.
Un cociente elevado se correlaciona con una mayor incidencia de complicaciones maternas, como insuficiencia renal (IR) hemorragia postparto (HPP) y eclampsia.
Los efectos adversos fetales se asociaron con restricción del crecimiento intrauterino (RCIU), parto prematuro y mayor necesidad de cuidados intensivos neonatales (UCIN).
Estas determinaciones se pueden utilizar para predecir el riesgo de progresión a preeclampsia con criterios de gravedad y determinar aquellas pacientes que tienen más probabilidades de tener resultados maternos y neonatales adversos.
Esta información ayudaría a estratificar el riesgo, planificar el tratamiento y facilitar la toma de decisiones en torno a cuestiones clave como la atención hospitalaria frente a la ambulatoria y el momento del nacimiento.
El cociente sFlt-1/PlGF se ha establecido como un biomarcador que refleja la salud placentaria. En mujeres con sospecha de preeclampsia, este cociente tiene un valor predictivo negativo (VPN) superior al 99% para descartar la preeclampsia en la semana siguiente y además, presenta una alta capacidad predictiva para identificar casos con mayor riesgo de complicaciones graves, como eclampsia, síndrome HELLP y restricción del crecimiento intrauterino.
Marco Teórico
Se publicó un estudio observacional analítico, PROGNOSIS STUDY (Prediction of short term outcome in pregnant women with suspected Preeclampsia Study), realizado en 14 países de Europa y EEUU, para evaluar y validar un punto de corte del cociente sFlt-1/PlGF para la presencia o ausencia de PE a corto plazo (1sem) en mujeres con embarazo único con sospecha de esta patología (24-36 semanas de gestación). Se realizó el seguimiento de una cohorte de 500 mujeres y se identificó como punto de corte el valor de 38 con un valor predictivo negativo del 99.33% (IC 95% 97.9-99.9), con una sensibilidad del 80% (IC 95% 51.9-95.7) y un 78.3% de especificidad (IC 95% 74.6-81.7) para predecir PE en la primer semana. Sin embargo, los autores establecen que si bien fue un estudio bien realizado, los resultados fueron validados solo con una técnica de laboratorio y que además deben considerarse en el marco de un estudio observacional resaltando la importancia de realizar ensayos que confirmen su utilidad en la práctica obstétrica en diferentes poblaciones para así poder validar globalmente este punto de corte1.
El estudio “PROGNOSIS Asia” fue realizado entre 2014 y 2016 en 25 sitios de Asia cuyo objetivo fue evaluar la utilidad del cociente sFlt-1/PlGF en la predicción a corto plazo de preeclampsia y resultados fetales adversos en mujeres asiáticas embarazadas con sospecha de preeclampsia. Fue un estudio prospectivo, multicéntrico, doble ciego en el cual participaron 764 mujeres embarazadas con una edad gestacional de 20+0 a 36+6 semanas. Los criterios de inclusión fueron: sospecha clínica de preeclampsia según TA elevada, proteinuria, RCIU y alteraciones del doppler de las arterias uterinas
Esta investigación estableció los puntos de corte en el cociente.
Con un cociente <38; el valor predictivo negativo (VPN) para descartar preeclampsia dentro de 1 semana fue del 98.6% (IC 95%: 97.2%-99.4%) con una sensibilidad del 76.5%. y una especificidad de 82.1%.
Con un cociente >38 el valor predictivo positivo (VPP) para confirmar preeclampsia dentro de 4 semanas fue del 30.3% (IC 95%: 23.0%-38.5%) con una sensibilidad del 62.0%. y una especificidad del 83.9%.
La predicción de resultados fetales adversos para un cociente ≤38: VPN para descartar resultados adversos fetales en 1 semana fue del 98.9% (IC 95%: 97.6%-99.6%) y con un Cociente >38: VPP para predecir resultados adversos fetales en 4 semanas: 53.5% (IC 95%: 45.0%-61.8%).
El estudio concluyó que el cociente sFlt-1/PlGF sería un predictor confiable para descartar preeclampsia y resultados fetales adversos en el corto plazo; podría evitar hospitalizaciones innecesarias en mujeres con bajo riesgo de complicaciones, optimizando el uso de recursos de salud y ayudar a identificar embarazos de alto riesgo que requieren intervenciones tempranas2.
En el año 2019, se publicó el INSPIRE TRIAL cuyo objetivo fue evaluar el uso del cociente sFIt-a/PIGF en mujeres entre 24 y 37 con sospecha de preeclampsia. Comparó el manejo clínico habitual con el conocimiento del resultado del cociente. Se utilizó un punto de corte de <38 bajo riego y >o igual a 38 alto riesgo de desarrollar PE dentro de la próxima semana.
El resultado primario fue la hospitalización dentro de las 24 hs luego de realizado el test Se reclutaron 370 mujeres (186 en grupo intervención y 184 control). La preeclampsia se presentó en el 23% de los casos y no se hallaron diferencias significativas en el número de admisiones ( n=48 vs n= 60; p=0.19).
En el grupo intervención se internó al 100% de los casos que luego desarrollaron preeclampsia dentro de los 7 días, mientras que en el grupo control fue del 83% (p=0.03.). La utilización del cociente, si bien mejoró la precisión clínica, no modificó las tasas de admisiones que se buscaba como punto final3.
El PRAECIS study realizado en el año 2022 en EEUU e incluyó 18 centros de salud, realizó el cociente Flt/PlGF a mujeres embarazadas hospitalizadas entre las 23-35 semanas de gestación. El resultado primario fue la predicción de PE y el secundario la aparición de eventos adversos.
Las pacientes que desarrollaron preeclampsia con criterios de gravedad tuvieron un cociente significativamente más alto que las que no lo hicieron (mediana 200; rango intercuartil 53-458 vs mediana 6 rango intercuartil 3-26); p<=0001.
Aquellas pacientes con un cociente >=40 presentaron mayor riesgo de resultados maternos adversos compuestos (16.1 vs 2.8; RR 5.8 IC 2.8-12.2).
La sensibilidad y especificidad para desarrollar preeclampsia con signos de severidad dentro de dos semanas fue: 94% (IC 89-96 y 75% (IC 70-79) respectivamente. El VPP fue del 65 % (IC 59-71) y el VPN fue del 96 % (IC 93-98)4.
A partir de este estudio, la FDA aprobó el uso del cociente sFl-1/PlGF en pacientes hospitalizadas con hipertensión para predecir la progresión a preeclampsia con características graves.
Un metaanálisis publicado en el 2021 de estudios observacionales con el objetivo de evaluar la performance del cociente como predictor de resultados perinatales adversos en mujeres con sospecha de preeclampsia mostró una curva ROC que osciló entre 0.68-0.87 para predecir un resultado adverso compuesto materno-fetal. Sin embargo, se halló mucha heterogeneidad (I2 33-99) en relación a la calidad de estudios incluidos y la medición de los puntos finales5.
En resumen, todos los estudios analizados coinciden en la importancia de determinar el cociente sFlt-1/PlGF, cuyo valor estaría alterado en mujeres con preeclampsia6,7.
Los estudios destacan que el cociente sFlt-1/PlGF tiene un alto VPN y podría ser especialmente útil para descartar el riesgo de desarrollar preeclampsia en el corto plazo, generalmente en un periodo de 1 a 4 semanas.
Un punto de corte de ≤38 ha demostrado ser eficaz para descartar preeclampsia con una precisión superior al 99% en una semana, mientras que valores más altos, como>85 identifican a mujeres con mayor riesgo de complicaciones en embarazos.
Finalmente sería de suma importancia integrar el cociente sFlt-1/PlGF en la práctica clínica lo que permitiría personalizar el manejo clínico, reduciendo intervenciones innecesarias y optimizando recursos médicos. No obstante, también enfatizar en la importancia de establecer protocolos estandarizados para su uso, considerando las variaciones en puntos de corte y necesidades específicas de cada población.
Objetivo General
Determinar la utilidad del cociente sFlt-1/PlGF en pacientes embarazadas de riesgo y su relación con el diagnóstico de preeclampsia.
Objetivos Específicos
Identificar puntos de corte para Preeclampsia.
Evaluar los resultados adversos perinatales en esa población.
Describir el valor del cociente según el tiempo transcurrido al nacimiento.
Materiales y Método
Se realizó un estudio observacional, longitudinal, analítico y retrospectivo a partir del resultado del cociente sFlt-1/PlGF de pacientes embarazadas, en control ambulatorio, con algún factor de riesgo en la Maternidad del Hospital Nacional Prof. A. Posadas durante un período comprendido entre el 01/06/2023 y el 30/11/2024 (18 meses).
Se identificaron los registros de laboratorio del cociente y se procedió a la revisión y recolección de los datos perinatales de las historias clínicas de pacientes, a partir del 2do trimestre de gestación.
Los criterios de riesgo por los cuales se solicitó el cociente sFlt-1/PlGF fueron:
- Antecedentes familiares de preeclampsia
- Antecedentes personales de preeclampsia en embarazo anterior
- Sospecha clínica de Preeclampsia (cifras tensionales >160/110, edema, dolor de cabeza, visión borrosa)
- Antecedente de patología vascular crónica (HTA crónica, Diabetes previa, enfermedad renal, trombofilia)
- Edad materna avanzada (>=35 años)
- Screening del 1er trimestre patológico con riesgo elevado para preeclampsia y RCIU.
Como técnica del procesamiento, se tomó una muestra de sangre materna de cada participante durante el reclutamiento. Se extrajo un volumen de 5 ml de sangre materna utilizando tubos con EDTA para muestras de plasma. Las muestras se invirtieron al menos cinco veces después de la extracción y se dejaron coagular a temperatura ambiente durante 30 minutos antes de la centrifugación.
El plasma se recogió después de la centrifugación y se almacenó a una temperatura de entre 2 °C y 8 °C hasta su análisis. Todas las muestras se analizaron en un plazo de 24 hs.
Los niveles plasmáticos de sFlt-1/PlGF se midieron utilizando un ensayo comercial de en una plataforma de inmunoensayo. El análisis de las muestras se realizó según las instrucciones del fabricante de inmunoanálisis para la determinación cuantitativa in vitro de la quinasa de tirosina soluble similar al FMS (sFlt-1) en suero humano.
El test Elecsys sFlt-1 se utilizó junto con el test Elecsys PlGF para determinar el cociente sFlt-1/PlGF. En combinación con otras informaciones diagnósticas y clínicas, la determinación del cociente sFlt-1/PlGF está previsto como ayuda en el diagnóstico de la preeclampsia.
Este inmunoensayo es de electroquimioluminiscencia (electrochemiluminescence immunoassay) y se analiza en un equipo cobas E411.
Se consideró como criterio de inclusión a aquellas pacientes a las que se les solicitó el cociente por criterios de riesgo, con control prenatal completo y cuya internación y nacimiento se produjo en nuestra maternidad, quedando excluídas las embarazadas que abandonaron el seguimiento o cuya historia clínica no haya sido completada para los resultados finales planteados.
Se tuvo en cuenta como variable de resultado principal la capacidad diagnóstica del mejor punto de corte del cociente sFlt-1/PlGF para la predicción de preeclampsia; entendiendo, como la aparición de hipertensión y proteinuria o disfunción de órgano blanco después de las 20 semanas de gestación o en el periodos postparto8,9.
Además se consideraron dos subtipos de preeclampsia: De aparición temprana (<34 semanas de gestación) y De aparición tardía (≥34 semanas de gestación) y la presencia de subtipos como el desarrollo de síndrome HELLP, hipertensión gestacional (HG) y restricción del crecimiento intrauterino.
Se consideraron otras variables de resultado como la aparición de eventos adversos: desprendimiento de placenta, restricción de crecimiento intrauterino, parto prematuro, muerte fetal, ingreso materno a unidad de cuidados intensivos, falla renal, hepática o cardíaca, coagulopatía, Accidente cerebrovascular (ACV), Edema agudo de Pulmón (EAP) y muerte materna. Se contempla el valor del cociente según el tiempo transcurrido al nacimiento, si fue dentro de la primera semana o después de ella.
Se consideraron variables caracterizadoras de la muestra como: edad materna, embarazos previos, antecedentes familiares y personales de PE, edad gestacional a la solicitud del cociente, realización del screening del 1er trimestre, tratamiento con aspirina a baja dosis, índice de pulsatilidad (IP) de arterias uterinas, presencia de sintomatología clínica (registros tensionales elevados, edema, visión borrosa, epigastralgia, etc). Además se registró la edad gestacional a la finalización del embarazo, el peso del recién nacido, ingreso a terapia neonatal y muerte perinatal (fetal o neonatal).
Las variables cuantitativas se presentan como medidas de tendencia central y sus dispersiones según corresponda la distribución muestral comparándose con test paramétricos/no paramétricos. Las variables categóricas se muestran con frecuencias absolutas/relativas comparándose con test chi2 y Fisher exact test según conformación de tabla de doble entrada. Se consideraron diferencias estadísticas con un p valor<=0.05.
Se evaluó la capacidad operativa del cociente para la predicción de preeclampsia a través del cálculo del mejor punto de corte y curva ROC para la muestra estudiada. Se utilizó como software STATA 14.0.
Aspectos éticos
Este protocolo fue presentado y aprobado por el Comité de Ética en Investigación del Hospital Nacional Prof. A. Posadas bajo el código 945 LUP0S0/25.
En esta investigación se ratifica y defiende el principio del derecho del paciente a la protección contra la invasión de su privacidad tratando toda la información personal con absoluta confidencialidad.
El estudio se realizará conforme a la Ley Nacional de Protección de Datos Personales (Ley de Habeas Data 25326/2000), los datos personales de los pacientes serán utilizados solo con los fines de la investigación.
Resultados
Durante el período de estudio se registraron 3377 nacimientos de los cuales 1559 tuvieron su control prenatal en el servicio de Obstetricia del Hospital Nacional Prof. A. Posadas (HNPAP) siendo 122 potencialmente elegibles, para finalmente ingresar al estudio 81 pacientes (ver figura 1).
La edad promedio de las pacientes que ingresaron al estudio fue de 30.6 años (Desvío Estándar –DE 7), presentando una media de 3 embarazos (DE 1.5) y como antecedentes más frecuentemente encontrados, en un 37%, fueron procesos hipertensivos crónicos y/o hipertensión gestacional. (Tabla1)
Gráfico 1: Flujograma de ingreso al estudio
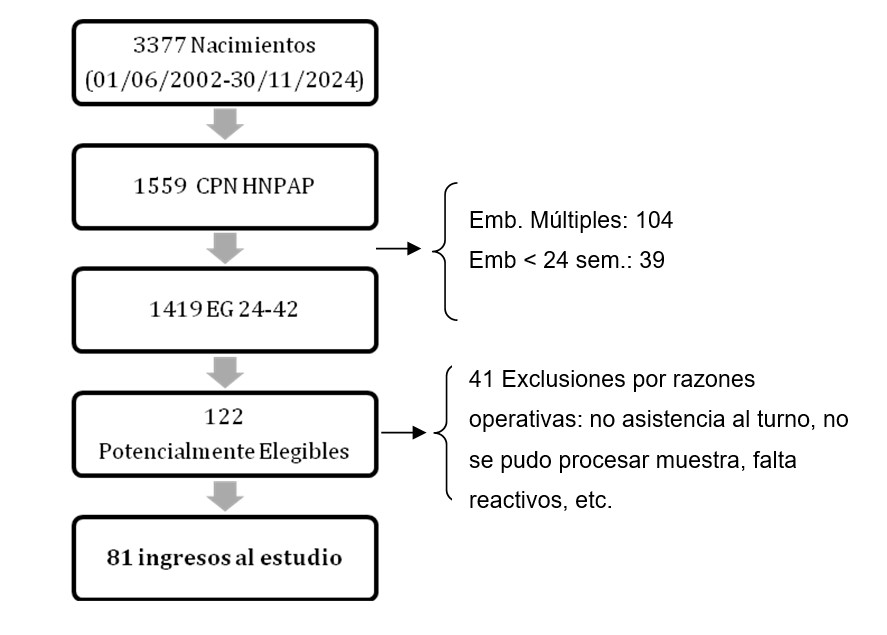
Tabla 1: Características Basales de la población estudiada
|
Variable (N=81) |
Frecuencias (%)/ Media (DS) |
|
Edad |
30.6 (7) |
|
Gestas |
3 (1.5) |
|
Antec. Fliar. HTA |
41% |
|
Antec. Personales HTA crónica HIE Preeclampsia/Eclampsia DBT |
28% 9% 9% 6% |
En la tabla 2 se presentan los valores de laboratorio al momento del ingreso al estudio con la extracción de sangre para determinar el cociente; el promedio de hematocrito fue de 35.1% (DE 3.7) y de plaquetas de 253.854 u/L (DE 78.196), no hubo alteración del perfil hepático ni el renal. El valor promedio de ácido úrico fue de 4.6 (DE 1.7) y la mediana de proteinuria fue de 188 mg/24 hs (Tabla 2).
Tabla 2: Determinaciones de laboratorio al ingreso del estudio
|
Variable (N=81) |
Media (DS)/ Mediana (rango) |
|
Hematocrito (%) |
35.1 (3.7) |
|
Hemoglobina (gr/dl) |
11.6 (1.2) |
|
Plaquetas (u/L) |
253.854 (78.196) |
|
Bilirrubina Total (mg/dl) |
0.3 (0.2) |
|
Glutámico Oxalacético Transaminasa (GOT) (UI/L) |
26.1 (17.9) |
|
Glutamato-Piruvato Transaminasa (GPT) (UI/L) |
22.4 (30.3) |
|
Lactato Deshidrogenasa (LDH) (n=44) (UI/L) |
224.8 (64) |
|
Ácido Úrico (mg/dl) |
4.6 (1.7) |
|
Creatinina (mg/dl) |
0.61 (0.16) |
|
Urea (g/L) |
0.23 (0.12) |
|
Proteinuria (mg/24 hs) |
188 (0.07-9312) |
De la población estudiada, 77 pacientes realizaron el screening de PE en el 1 trimestre. El 23.5% tuvo riesgo elevado de desarrollo de preeclampsia. El 88% de las pacientes presentaron alguna sintomatología clínica siendo la más frecuente HTA (Tabla 3)
Tabla 3: Características del embarazo Actual
|
Variable (N=81) |
Frecuencias (%) |
|
Riesgo aumentado de PE 1 Trimestre |
23.5% |
|
Tratamiento preventivo con AAS en baja dosis |
76% |
|
Doppler Art uterinas Patológico |
30% |
|
Sintomatología Clínica |
88% |
Como resultados adversos perinatales, el 53 % de la población estudiada desarrolló algún trastorno hipertensivo del embarazo.
El 43% de las pacientes presentaron parto prematuro, definido como el nacimiento antes de las 37 semanas de gestación. Se registró un 10% restricción de crecimiento intrauterino y una muerte fetal.
No hubo casos de desprendimiento placentario, falla renal, hepática o cardíaca y coagulopatía. Tampoco hubo casos de ACV, EAP o muerte materna y no se registraron ingresos maternos a la Unidad de Terapia Intensiva (UTI). (Tabla 4)
Tabla 4: Resultados Adversos Perinatales
|
Variable (N=81) |
Frecuencias (%) |
|
Trastornos Hipertensivos del Embarazo PE HIE |
31% 22% |
|
Restricción de Crecimiento Intrauterina (RCIU) |
10% |
|
Desprendimiento de Placenta Normoinserta (DPPNI) |
-- |
|
Muerte Fetal |
1.2% |
|
Parto Prematuro |
43% |
En el 90% de los casos la vía de finalización del embarazo fue por cesárea, con una media de edad gestacional al nacimiento de 35.3 semanas (DE 3.8) y un peso al nacer de 2587 gramos (DE 942). Ingresaron a la unidad de terapia intensiva neonatal el 42% de los recién nacidos.
Al evaluar en forma general el cociente, la mediana fue de 21.93 pg/ml con un rango 0.10 a 962.86. La media de edad gestacional a la solicitud fue de 29.6 semanas (DS 5.44).
Al categorizar el tiempo transcurrido entre la solicitud del cociente y el momento del nacimiento, en mayor o menor a 1 semana, se pudo observar que en aquellas pacientes que finalizaron dentro de la primera semana, tuvieron una mediana de cociente de 111.9 (rango 10.9-962.8; n=20).
Este valor fue mayor y estadísticamente significativo, que en aquellas que finalizaron el embarazo después de la primera semana (mediana 11.45; rango 0.1-585.6, n=61); p valor= 0.0001.
En aquellas pacientes que desarrollaron PE se pudo observar una mediana de 77.12 pg/ml (rango: 2.4-962.8) y en quienes no la desarrollaron, la mediana fue de 12.2 pg/ml (rango: 0.1-686), siendo esta diferencia también, estadísticamente significativa (p= 0.0016).
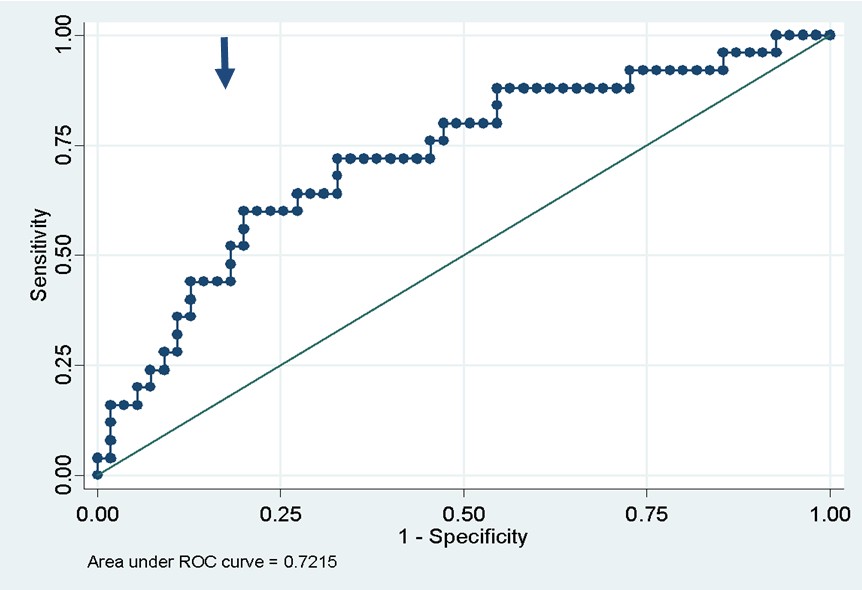
El gráfico 2 muestra la curva ROC (Receiver Operating Characteristic). En la misma se puede identificar como el mejor punto de corte al valor de 34.87 pg/ml., con una sensibilidad del 72%, especificidad 67%.
La precisión del diagnóstico correcto fue de 69% en la muestra y se obtuvo un área bajo la curva (ABC) de 0.72 (IC 95% 0.60-0.84) .
Gráfico 2: Curva ROC
El 64% (N=16) de las pacientes que desarrollaron PE lo hicieron en forma precoz, antes de las 34 semanas.
El 87.5% de las pacientes que desarrollaron PE precoz, presentaron un cociente mayor a 34.87; a diferencia de quienes presentaron PE de inicio tardío en que solo el 44% presentaron valores mayores a este punto de corte (Fisher Exact test: p=0.05).
Al comparar la frecuencia de resultados adversos perinatales, se pudo observar que aquellas con valores superiores al 34.87 pg/ml tuvieron mayor frecuencia de preeclampsia y parto prematuro siendo esta diferencia estadísticamente significativa. Fue más importante la aparición de RCIU en el grupo con mayor punto de corte; pero estadísticamente no significativa (tabla 5)
Tabla 5: Resultados Adversos Perinatales según el punto de corte (>34.87 pg/ml)
|
Variable |
>34.87 pg/ml N=37 |
<=34.87 pg/ml N=44 |
p valor |
|
Preeclampsia |
18 |
7 |
0.001 |
|
Restricción de Crecimiento Intrauterino |
7 |
2 |
0.07 |
|
Parto Prematuro |
23 |
11 |
0.0001 |
|
Muerte Fetal |
1 |
---- |
NA |
|
Desprendimiento de Placenta Normoinserta |
---- |
---- |
NA |
Discusión
En países en vías de desarrollo, la PE contribuye al aumento de la mortalidad materna a partir de complicaciones que aparecen durante el transcurso de la enfermedad.
El diagnóstico continúa siendo un desafío; parámetros clínicos como el aumento de la TA, cefalea, fotofobia; como determinaciones alteradas en la cantidad de plaquetas, el hepatograma, aumento del ácido úrico y aparición de proteinuria indican gravedad de la enfermedad. La finalización del embarazo es mandatoria en estos casos.
El descubrimiento de factores antiangiogénicos como el sFlt-1, liberado por el endotelio hipóxico placentario abre un nuevo paradigma para el diagnóstico y puede dar un paso más allá, como pronosticar el futuro de ese embarazo.
La determinación del sFlt-1, (factor tóxico endotelial) se debe evaluar en conjunto con el PlGF (factor de crecimiento placentario) que brinda información del funcionamiento y volumen placentario. Al realizar el cociente sFlt-1/PlGF se determina el desequilibrio entre ambos y la progresión de la enfermedad.
A partir de la publicación del trabajo PROGNOSIS se concluyó que el cociente se comporta como un predictor confiable fundamentalmente para descartar preeclampsia y resultados maternos-fetales adversos.
En la Maternidad del Hospital Nacional Prof. A. Posadas comenzamos su utilización en el 2023 en pacientes ambulatorias, con algún factor de riesgo o condiciones maternas sospechosas. Durante el control prenatal se tomó la decisión de realizar el cociente en pacientes con antecedentes personales o familiares de HTA o que presentaban algún signo sospechoso de PE.
En el momento de tomar una muestra de sangre para la determinación del cociente, se realizaron otras determinaciones de laboratorio no encontrándose alteraciones del perfil hepático y/o renal.
Es de resaltar que el estudio se realizó en pacientes con algún tipo de riesgo para PE; un 76% estaba recibiendo AAS en forma preventiva.
Para quienes desarrollaron PE la mediana del cociente fue 77.12 con amplio rango de dispersión (entre 2.4-962.8). Para quienes no la desarrollaron la mediana fue de 12.2.
Se identificó el mejor punto de corte de 34.87 pg/ml en la curva ROC con una sensibilidad del 72% y una especificidad del 67% dando una precisión diagnóstica del 69%.
En relación con los resultados adversos, aquellas pacientes que presentaron un punto de corte >34.87 tuvieron una mayor frecuencia de PE, parto prematuro y RCIU.
Como otro punto destacable en esta investigación, se pudo observar una diferencia significativa en el tiempo de transición entre la solicitud del cociente y el nacimiento. Los que finalizaron dentro de la primera semana tuvieron una mediana de 111.9 a diferencia del 11.45 en quienes finalizaron después de la primera semana.
Las pacientes que desarrollaron PE precoz, antes de la 34 semanas, presentaron un cociente más alto que aquellas de inicio tardío. Sin embargo estos resultados deberían tomarse con cautela dado el carácter retrospectivo del estudio.
La aplicación del cociente representa un nuevo paradigma en relación al diagnóstico y pronóstico de la PE.
La PE no tiene un tratamiento específico. El sulfato de Magnesio y las drogas antihipertensivas brindan una mejoría del cuadro solo en forma transitoria.
El poder analizar el valor específico del Sflit-1, factor endotelial tóxico, relacionado con el PlGF, abre una nueva estrategia en el manejo de la misma permitiendo evaluar la progresión de la enfermedad.
Esta investigación ha confirmado el punto de corte <38 del estudio PROGNOSIS. En nuestra serie, un valor menor a 34.87 presentó menos resultados perinatales adversos.
En otro punto de vista, las pacientes que desarrollaron PE presentaron una mediana de 77.12 pero con una amplia dispersión de datos (rango 2.4-962.8).
Consideramos la utilidad del cociente para distinguir la PE de otros trastornos hipertensivos proteinúricos y predecir a corto plazo la progresión de la misma.
La aplicación del cociente, en pacientes de riesgo, podría detectar con anticipación aquellas que progresaron a cuadros más graves como la Eclampsia o el Síndrome HELLP.
Por otro lado, también indicaría el estado de salud del endotelio placentario, previniendo complicaciones como el RCIU y el desprendimiento placentario.
El cociente no reemplaza por el momento otras medidas de diagnóstico como la toma de la tensión arterial y el laboratorio de PE. En un futuro inmediato, tal vez, el cociente será de uso rutinario para el manejo de pacientes de riesgo.
Conclusiones:
La predicción de la PE representa un importante tema de investigación por los numerosos beneficios que aporta una mejor estratificación del riesgo y la posibilidad de implementar programas de seguimiento personalizados, más intensivos y evitar o reducir significativamente la posibilidad de complicaciones como la evolución a eclampsia, ACV, infarto de miocardio, desprendimiento de placenta o muerte fetal anteparto. Por otro lado también, poder seguir las complicaciones fetales, como la restricción del crecimiento fetal seleccionando cuidadosamente el momento y la vía del parto.
Nuestro estudio brinda una precisión predictiva significativamente mayor en comparación con el criterio clínico: valores de sFlt-1/PlGF ≤34.87 clasificaron el embarazo como de bajo riesgo de complicaciones, con una sensibilidad del 72% y una especificidad del 67% dando una precisión diagnóstica del 69%.
El cociente sFlt-1/PlGF no reemplaza a otras herramientas diagnósticas, aunque, en el futuro, tal vez, podría utilizarse rutinariamente en la evaluación del pronóstico en pacientes de riesgo
Colaboradores:
Dr Mariano Lorea, Jefe de Sección Alto Riesgo. Servicio de Obstetricia. Hospital Nacional Prof. A. Posadas
Dra Stella Carral, Médica de Planta. Servicio de Obstetricia. Hospital t Nacional Prof. A. Posadas
Bioquimico Eduardo Moratto, Bioquímico del Laboratorio del Hospital Nacional Prof. A. Posadas
Agradecimientos:
A todas las pacientes que nos permitieron realizar esta investigación con la aceptación de su participación en la misma.
Bibliografía
- Harald Zeisler H. , Llurba E. et. al. Predictive Value of the sFlt-1:PlGF Ratio in Women with Suspected Preeclampsia. N Engl J Med. 2016 Jan 7;374(1):13-22
- Bian X, Biswas A, Huang X, Lee KJ, Li TK, Masuyama H, Ohkuchi A, Park JS, Saito S, Tan KH, Yamamoto T, Dietl A, Grill S, Verhagen-Kamerbeek WDJ, Shim JY, Hund M. Short-Term Prediction of Adverse Outcomes Using the sFlt-1 (Soluble fms-Like Tyrosine Kinase 1)/PlGF (Placental Growth Factor) Ratio in Asian Women With Suspected Preeclampsia. Hypertension. 2019 Jul;74(1):164-172.
- Cerdeira AS, O'Sullivan J, Ohuma EO, Harrington D, Szafranski P, Black R, Mackillop L, Impey L, Greenwood C, James T, Smith I, Papageorghiou AT, Knight M, VatishM . Randomized Interventional Study on Prediction of Preeclampsia/Eclampsia in Women With Suspected Preeclampsia: INSPIRE. Hypertension. 2019;74(4):983. Epub 2019 Aug 12.
- Thadhani R, Lemoine E, Rana S, Costantine MM, Calsavara VF, Boggess K, Wylie BJ, Moore Simas TA, Louis JM, Espinoza J, Gaw SL, Murtha A, Wiegand S, Gollin Y, Singh D, Silver RM, Durie DE, Panda B, Norwitz ER, Burd I, Plunkett B, Scott RK, Gaden A, Bautista M, Chang Y, Diniz MA, Karumanchi SA, Kilpatrick S. Circulating Angiogenic Factor Levels in Hypertensive Disorders of Pregnancy. NEJM Evid. 2022 Dec;1(12):EVIDoa2200161.
- Lim S, Li W, Kemper J, Nguyen A, Mol BW, Reddy M. Biomarkers and the Prediction of Adverse Outcomes in Preeclampsia: A Systematic Review and Meta-analysis. Obstet Gynecol. 2021;137(1):72.
- Bokuda K, Ichihara A . Preeclampsia up to date-What's going on? Hypertens Res. 2023;46(8):1900. Epub 2023 Jun 2.
- Yang M, Bai Y, Li M, et al. Predictive value of the soluble fms-like tyrosine kinase 1 to placental growth factor ratio for preeclampsia in twin pregnancies: a systematic review and meta-analysis. Am J Obstet Gynecol MFM 2024; 6:101290.
- ACOG Practice Bulletin, Number 222. Gestational Hypertension and Preeclampsia: Obstet Gynecol 2020; 135:e237. Reaffirmed 2023.
- Basualdo N, Brenzoni P, Casale R, Di Marco I, Moran R, Ojeda L, Olea C, Perez M, Sosa L, Vitureira G, Voto L, Zamori S. Consenso Argentino Uruguayo sobre la utilización del cociente de biomarcadores sFlt-1/PlGF para preeclampsia en el 2do y 3er trimestre del embarazo.
- Jefe del Departamento Perinatal Hospital Nacional Prof. A. Posadas
- Magister en Efectividad Clínica. Hospital Nacional Prof. A. Posadas
- Médico de Planta. Servicio de Obstetricia Hospital Nacional Prof. A. Posadas
- Jefe de Servicio de Obstetricia. Hospital Nacional Prof. A. Posadas
- Jefa de Laboratorio del Hospital Nacional Prof. A. Posadas