Consenso Osteoporosis - FASGO 2025
Directora
Dra. María Susana Moggia
Médica Ginecóloga. Especialista en Endocrinología Ginecológica y Reproductiva. Docente Adscripta de Ginecología Facultad de Medicina, UBA. Médica de Planta, Hospital Parmenio Piñero Gobierno de la Ciudad Autónoma de Buenos Aires. Miembro de Comisión Directiva Sociedad Argentina de Osteoporosis, AMADA y AACOG. Directora Curso Osteoporosis SOGIBA
Expertos
Dr. Rubén Abdala
Médico Endocrinólogo, Especialista en Medicina Interna. Coordinador del Departamento de Osteología de la Federación Argentina de Sociedades de Endocrinología (FASEN). Miembro de Comisión Directiva de Sociedad Argentina de Osteoporosis (SAO). Responsable del Sector de Densitometría del Instituto de Diagnóstico e Investigaciones Metabólicas (IDIM). Responsable del Sector de Densitometría de CICEM, Posadas. Médico de Planta y Coordinador del Sector de Andrología, Hospital Carlos G. Durand. Gobierno de la Ciudad de Buenos Aires
Dra. María Alejandra Belardo
Jefa de la Sección Endocrinología Ginecológica y Climaterio del Servicio de Ginecología del Hospital Italiano de Buenos Aires. Ex Presidenta de AACOG. Vicepresidenta 2da de AAMA. Miembro de Comisión Directiva SOGIBA. Magister en PINE. Prof adjunta Instituto Universitario Hospital Italiano
Dr. Daniel De Zordo
Especialista en TocoGinecología Docente Adsc. F. Medicina- UBA. Especialista en Medicina Farmacéutica-UBA. División Médica y Científica (DMyC) Lab. GADOR
Dra. Leticia Delfino
Médica especialista en Tocoginecología. Docente Adscripta de la F. Medicina- UBA. Médica de planta del Hospital P. Piñero Gobierno de la Ciudad de Buenos Aires.. Médica especialista certificada en Ginecología Infantojuvenil. Coordinadora Curso Osteoporosis SOGIBA. Miembro adherente SAGIJ
Dra. Alejandra Elizalde Cremonte
Especialista en Ginecología y Obstetricia, Prof. Titular Cátedra II Clínica Obst. Facultad de Medicina - Universidad Nacional del Nordeste (UNNE), Corrientes, Argentina. Miembro de la Comisión Directiva de FASGO. Miembro del Consejo Académico Nacional.Presidenta de la Asociación de Ginecología y Obstetricia de Corrientes (AGOC).Vicepresidenta 1ª de la Asoc. Arg. de Menopausia y Andropausia (AAMA).Ex Presidenta Asoc. Latinoamericana de Endocrinología Ginecológica (ALEG).Ex Presidenta Asoc. Arg. de Perinatología (ASAPER)
Dr. David Jorge Fusaro
Médico ginecólogo. Director Médico del Instituto Ginecológico de Buenos Aires. Ex Jefe del Servicio Hospital Universitario Fundación Favaloro.
Dra. Claudia Rey
Médica UBA. Especialista eh TocoGinecología. Maestría Universitaria en Osteopatías Metabólicas y Osteoporosis (USAL / IDIM). Especialista en Endocrinología Ginecológica (SAEGRE). Especialista Consultor en Climaterio. Experta Latinoamericana en Climaterio y Menopausia (FLASCYM). Ex Presidente de AAPEC (2019 -2020). AAPEC: Co-Directora Escuela Arg. de Climaterio de (2021-2026). Fellow American College OBGYN (ACOG). Miembro de SOGIBA, IMS, ISGE, EMAS, ESCHR.
Dra. María Angélica Rivoira
Bioquímica, Esp. en Endocrinología y Dra en Ciencias de la Salud. Prof. Adjunta de la Cátedra de Bioquímica y Biología Molecular de la FCM-UNC; Prof. Titular de la Asignatura Química Biológica de la Escuela de Tecnología Médica, FCM-UNC. Miembro de AAOMM y SEMCO.
Dra. Fabiana Sayegh
Médica Ginecóloga, Especialista en Endocrinología Ginecológica, Climaterio y Osteopatías Metabólicas. Magister en Investigación Clínica. Docente de la Universidad Nacional de Cuyo. Médica del Hospital Universitario. Coordinadora de la Actividad Científica de la Sociedad de Obstetricia y Ginecología de Mendoza. Coordinadora del Servicio de Ginecología y Obstetricia del Hospital Universitario
Dra. Karina Sternberg
Médica Tocoginecóloga. Especialista en Endocrinologia Ginecologica. Ex. Medica de Planta Hospital de Clinicas “Jose de San Martin”. Miembro de Comision Directiva SAEGRE. Miembro Titular SOGIBA.Coordinadora Curso Osteoporosis SOGIBA
Secretaria
Dra. Magali Galarza Taborda
MédicaTocoginecóloga. Médica de la Sección Endocrinología Ginecológica y Climaterio del Hospital Italiano de Buenos Aires. Médica de planta, CeSac 49. Gobierno de la Ciudad de Buenos Aires
Abreviaturas
1,25(OH)2D3: calcitriol
BALP: fosfatasa alcalina isoenzima ósea BIA: análisis de impedancia bioeléctrica BP: bisfosfonatos
BTMs: marcadores de remodelado óseo CF: cuello de fémur
CL: columna lumbar CT: cadera total
DMO: densidad mineral ósea
DXA: absorciometría dual de rayos X EEC: estrógenos equinos conjugados ERC: enfermedad renal crónica
FFA: fractura femoral atípica
FOM: fractura osteoporótIca mayor FV: fracturas vertebrales
FX: fractura por fragilidad HPD: hipovitaminosis D
IMLG: índice de masa libre de grasa MCS: mínimo cambio significativo OMS: organización mundial de la salud ONM: osteonecrosis de mandíbula
OP: osteoporosis OPG: osteoprotegerina
P1NP: propéptido amino-terminal del procolágeno tipo I) y la PTHi: PTH intacta
PTHrP: parathyroid hormone related peptide
RANK-L: receptor activador del factor nuclear kβ ligando ROI: región de interés
SARC-F: Strength, Assistance in walking, Rise from a chair, Climb stairs and Falls
SERMs: moduladores selectivos del receptor de estrógeno SPPB: short physical performance battery
STEAR: reguladores selectivos de la actividad estrogénica tisular TBS: puntaje óseo trabecular
THM: terapia hormonal de la menopausia TPTD: teriparatida
TRACP5b: Isoforma 5b de la fosfatasa ácida resistente al tartrato UMB: unidades multicelulares básicas
VD: vitamina D VD2: ergocalciferol VD3: colecalciferol
VFA: evaluación de fracturas vertebrales
Definición
La osteoporosis (OP) es un trastorno esquelético sistémico, caracterizado por baja masa ósea y deterioro de la microarquitectura del tejido óseo, con incremento en la fragilidad ósea y aumento del riesgo de fractura. La fortaleza ósea consiste en la integración de la densidad y de la calidad del hueso (1).
La OP primaria es aquella que se produce a partir de la menopausia, causada en un primer momento por el déficit estrogénico y, más avanzada la edad, por un conjunto de factores, como el déficit de vitamina D, la menor absorción intestinal de calcio, el aumento de PTH entre otros (2, 3).
La OP secundaria es aquella en la que se produce desmineralización ósea, causada por otras patologías (1). Está presente en el 20 a 30% de las pacientes con OP, por lo que es necesario descartarla antes de comenzar un tratamiento (4, 5).
El diagnóstico de OP se realiza según la clasificación de los valores de densidad mineral ósea (DMO) de la Organización Mundial de la Salud (OMS). La misma se basa en comparar los valores de DMO del paciente adulto con los valores de la media del adulto joven del mismo sexo y etnia: normal (T-score >-1), osteopenia (T -score entre -1 y -2,4) y osteoporosis (T-score <-2,5). La DMO mide el calcio y otros minerales de los huesos.
Actualmente existe un criterio más amplio que incorpora aspectos clínicos, como la presencia de fracturas por fragilidad como la de cadera o vertebral (con cualquier valor de DMO) o factores de riesgo que incrementan el riesgo de fractura, medidos con la herramienta FRAX®, aún en pacientes con osteopenia (6).
Epidemiología
De acuerdo a los criterios de la OMS, se estima que en la Argentina una de cada 4 mujeres mayores de 50 años presenta un valor de densitometría normal, 2 tienen osteopenia y 1 osteoporosis (7).
En la Argentina la tasa media anual de fracturas de cadera es de 298 cada 100.000 mujeres mayores de 50 años y 118 en varones (8, 9,10). Esto implica una relación mujer/varón de 2,5/1. De esta manera son más de 34.000 fracturas de cadera las que ocurren cada año en esta población, lo que representa un promedio aproximado de 90 fracturas por día. En los países desarrollados la incidencia de fractura de cadera es máxima a la edad de 75-79 años. Según el estudio más numeroso publicado en nuestro país, la edad promedio de los pacientes con fractura de cadera fue de 82 años en mujeres, y 79 años en varones; la mayoría de las fracturas ocurrieron durante el día y en la casa. Más del 40% de los pacientes habían sufrido fracturas previas (11).
Un estudio más reciente, realizado por el Comité de Morbi-Mortalidad de la Asociación Argentina de Ortopedia y Traumatología, analizó 1.000 casos de fracturas de cadera y confirmó que la tasa de fracturas se mantiene estable, con una relación mujer/varón muy similar (2,7/1). Además, el 80% de los pacientes tenía más de 70 años y el 51% supera los 80 años, reafirmando el perfil etario de riesgo observado previamente (12).
Se estima que solo una de cada tres fracturas vertebrales recibe atención clínica. El estudio LAVOS (Latin American Vertebral Osteoporosis Study), un tamizaje radiológico en mujeres latinoamericanas de 50 años o mayores, encontró una prevalencia global de fracturas vertebrales del 16,2% en la Argentina (13). Estas fracturas aumentaban con la edad, y en la población de más de 80 años, una de cada cuatro mujeres tenía una fractura vertebral prevalente. Los dos factores de riesgo más importantes que este estudio develó fueron el antecedente de fractura y la pérdida de talla.
Factores de riesgo
La evaluación de los pacientes con OP comienza con una cuidadosa historia clínica incluyendo la búsqueda de factores de riesgo. El examen físico será acompañado de estudios complementarios para valorar la masa ósea y descartar causas secundarias.
La OP secundaria puede estar presente tanto en mujeres pre y posmenopáusicas como en hombres. Se ha observado que el 30% de las mujeres posmenopáusicas y el 50-80% de los hombres con OP presentan una causa subyacente cuando son evaluados (14,15). Es muy importante poder identificar estas causas, ya que el abordaje terapéutico de estos pacientes será diferente como así también, la respuesta al mismo podría estar limitada si la condición subyacente no se identifica y se trata (16).
Los factores de riesgo para presentar una fractura por fragilidad (FX) pueden resumirse en aquellos cuantificados en el FRAX®. Esta herramienta se basa en modelos individuales que combinan e integran factores clínicos de riesgo con la DMO del cuello femoral, que se han desarrollado a partir del estudio de grupos poblacionales de Europa, América, Asia y Australia. Argentina ha aportado información, por lo que es posible utilizar la herramienta de cálculo con las particularidades propias de nuestro país. La herramienta FRAX® es un programa informático que se encuentra disponible en la web.
Los algoritmos de FRAX® calculan la probabilidad de fractura a 10 años, proporcionando la probabilidad de fractura de cadera y de fractura osteoporótica mayor (FOM) a 10 años (fractura clínica vertebral, antebrazo, cadera u hombro). Un valor > 20% para FOM y >3% para fractura de cadera, indican que deberíamos realizar tratamiento a pesar de una DMO con osteopenia.
Recientemente, se revisaron algunos factores de riesgo que se hallaban subestimados (por ejemplo, la frecuencia de fracturas o caídas en el último año) y se agregó al FRAXplus®. Una vez que el sitio web de FRAXplus® esté disponible en todos los idiomas del FRAX®, el sitio web de FRAX® se retirará (https://frax.shef.ac.uk/FRAX).
A continuación, mostramos los factores de riesgo incluidos en el FRAX®, indispensables en la anamnesis de una paciente para evaluar el riesgo de fractura (Figura 1).
Figura 1. Imagen de los factores de riesgo de fractura incluidos en el FRAX®.
Debemos resaltar que la edad es un factor de riesgo importante para presentar una fractura, y se va incrementando a lo largo de la vida, así como la presencia personal de fracturas atraumáticas. Éstas aumentan el riesgo de una nueva fractura en los 2 años siguientes.
Para los ginecólogos, el antecedente de amenorreas secundarias, hipogonadismo o menopausia prematura (<45 años), o uso de inhibidores de la aromatasa constituyen un factor de riesgo frecuente, que deberá imputarse a OP secundaria.
Otros antecedentes de importancia son la presencia de diabetes mellitus, hipertiroidismo no tratado durante largo tiempo, malnutrición o malabsorción crónicas o hepatopatía crónica (Tabla 2). Algunas drogas que se especifican en la Tabla 3 pueden aumentar el riesgo OP o FX.
Tabla 2. Causas secundarias de OP (1)
|
Categoría |
Enfermedad |
|
Endocrinopatías |
Diabetes mellitus, hipertiroidismo no tratado, hipertiroidismo subclínico prolongado, retraso puberal, hipogonadismo (primario-secundario), insuficiencia ovárica prematura, deficiencia de hormona de crecimiento, acromegalia, hipercortisolismo, hiperparatiroidismo, hiperprolactinemia. |
|
Desnutrición/ Malabsorción |
Malnutrición crónica, malabsorción intestinal (como celiaquía, cirugía digestiva, insuficiencia pancreática, intolerancia a la lactosa). |
|
Enfermedad hepática crónica |
Hepatopatía crónica (incluyendo cirrosis, colangitis primaria) |
|
Enfermedades inflamatorias crónicas |
Artritis reumatoidea, lupus eritematoso sistémico, espondiloartritis, espondilitis anquilosante. |
|
Enfermedades hematológicas/ neoplásicas |
Mieloma múltiple, leucemias, mastocitosis, talasemia, linfoma, hemofilia, sarcoidosis. |
|
Insuficiencia renal crónica |
Enfermedad renal crónica, acidosis tubular renal, hipercalciuria idiopática. |
|
Medicamentos/ fármacos |
Glucocorticoides prolongados, antiepilépticos, inhibidores de aromatasa, heparina, inhibidores de la bomba de protones, inhibidor selectivo de la recaptación de serotonina. |
|
Inmovilización prolongada y factores tóxicos |
Inmovilización, consumo crónico de alcohol, tabaquismo, bajo índice de masa corporal. |
Tabla 3. Drogas relacionadas con OP y/o FX (17)
|
DROGAS |
EJEMPLO |
INDICACIÓN |
|
Glucocorticoides |
Prednisolona |
Enfermedades Autoinmunes |
|
Inhibidores de calcineurinas |
Ciclosporina A |
Trasplante de órganos |
|
Quimioterapicos |
Metrotexate, Ciclosfosfamida |
Tratamiento oncológico |
|
Inhibidores de la tirosina quinasa crónica |
Imatinib |
Leucemia mieloide |
|
Agonistas de GnRH |
Goserelin, Buserelin, Leuprolide |
Endometriosis, cáncer |
|
Inhibidores de la aromatasa |
Anastrozol, letrozol, exemestano |
Cáncer de mama RE + |
|
Medroxiprogesterona |
Acetato de medroxiprogesterona de depósito |
Anticoncepción |
|
Inhibidores bomba de protones a,b |
Omeprazol y Pantoprazol |
Úlcera péptica, reflujo |
|
Heparinas no fraccionadas a,b |
|
Enfermedad tromboembólica |
|
Inhibidor de la lipasa |
Orlistat |
Obesidad mórbida |
|
Hormona tiroidea b |
Levotiroxina |
Hipotiroidismo, cáncer de tiroides |
|
Anticonvulsivantes a |
Fenobarbital, Difenilhidantoina, Carbamazepina |
Trastornos convulsivos crónicos |
|
Antidepresivos a,b |
Inhibidores selectivos de la recaptación de Serotonina |
Depresión crónica |
|
Drogas antirretrovirales |
Tenofovir |
HIV |
a Sólida evidencia
b La droga se asocia con aumento de fracturas
Estratificación de riesgo
El riesgo de una nueva fractura es particularmente alto inmediatamente después de una fractura y disminuye progresivamente con el tiempo (18). Este altísimo riesgo de fractura se denomina "riesgo inminente de fractura" debido a la asociación temporal, y sugiere que el tratamiento preventivo administrado lo antes posible después de la fractura evitaría un mayor número de nuevas fracturas y reduciría la morbilidad asociada, en comparación con el tratamiento administrado posteriormente. Esto justifica la intervención muy temprana, inmediatamente después de una fractura centinela y requiere tratamiento con agentes que tengan el efecto más rápido en la reducción de las mismas.
Otro avance reciente es la demostración de una reducción más rápida y mayor del riesgo de fractura con anabólicos en comparación con los tratamientos antirresortivos, con el potencial de revolucionar las estrategias de tratamiento, especialmente en personas con un riesgo de fractura muy alto (18).
Existen varias guías que nos permiten estratificar el riesgo de presentar una FX y orientar la elección de tratamiento de inicio.
La Guía de la International Osteoporosis Foundation (IOF) y de la European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases (ESCEO) (19,20) considera:
Riesgo Alto (Indicación de iniciar tratamiento farmacológico)
- Osteopenia + FX previa
- Osteopenia + FRAX alto
- Osteoporosis (T-2,5)
Riesgo Muy alto (indicación de comenzar con antirresortivos potentes o anabólicos):
- FX Reciente (dentro de los 12 meses)
- Múltiples FX
- 2 o más FX bajo tratamiento de OP
- FX bajo drogas tóxicas para el hueso (glucocorticoides, inhibidores aromatasas)
- T score <-3 ,0
- Alto riesgo de caídas
- FRAX muy alto ( FOM >30% ,CF >4,5% )
La guía de la Endrocrine Society presenta la siguiente estratificación de riesgo (21) (Tabla 4).
Tabla 4. Estratificación del riesgo de presentar FX según la Endocrine Society
|
Riesgo |
Fracturas |
Densitometría |
FRAX |
|
Bajo |
No |
Normal (T-score > -1) |
Bajo <20%/<3% |
|
Moderado |
No |
Osteopenia (T-score > -2,5) |
Bajo <20%/<3 |
|
Alto |
Si |
Osteoporosis (T-score <-2,5) |
Alto ≥20%/ ≥3% |
|
Muy alto |
Múltiples |
Osteoporosis (T -score< -2,5) |
|
Métodos Diagnósticos para OP
Densitometría ósea
La absorciometría dual de rayos X (DXA), es una técnica de imagen mediada por rayos X que permite cuantificar la masa de un material a través de la atenuación de los mismos. Por su exactitud y precisión, la DXA es uno de los métodos más difundidos para evaluar la DMO in vivo. Por lo tanto, permite la evaluación de la cantidad de tejido óseo sin tener implicancias sobre la mineralización (22,23). La evaluación de la DMO es esencial para establecer un enfoque diagnóstico y terapéutico de la OP. A partir de los resultados obtenidos de la DMO, surgieron diferentes umbrales para definir la enfermedad en mujeres posmenopáusicas. Sin embargo, el más apropiado surgió en 1994, donde un grupo de expertos de la OMS recomendaron valores de desvíos estándar (DE) de DMO en comparación con una población de referencia joven. A este nuevo concepto matemático se le llamó “T-score” que enmarca a la enfermedad desde un punto de vista operacional o densitométrico (24,25). Estos criterios que en un principio fueron destinados únicamente para mujeres posmenopáusicas fueron extendidos posteriormente a hombres mayores de 50 años. El uso del T-score en comparación de unidades de masa ósea gr/cm2 permite una interpretación clínica más fácil y evita las diferencias absolutas entre los fabricantes de equipos DXA. A continuación, se describen los umbrales propuestos por la OMS de acuerdo con los valores de T-score (Tabla 5).
Tabla 5. Clasificación de los valores de DMO según la OMS
|
T-score |
Categoría |
|
≥ -1.0 |
Normal |
|
≤ -1.0 y > -2.5 |
Osteopenia o baja masa ósea |
|
≤ -2.5 |
Osteoporosis |
Principios básicos de la técnica
La finalidad de la densitometría es evaluar la DMO, la cual está compuesta principalmente por los cristales de hidroxiapatita [Ca10(PO4)6(OH)2]. Utiliza fotones de rayos X de alta y baja energía que son atenuados por los tejidos evaluando la absorción o remoción de los mismos al atravesar las diferentes estructuras. La DXA genera una imagen planar o de dos dimensiones, por lo tanto, sólo puede medir la masa ósea por unidad de área (gr/cm2), diferente a otras técnicas que tienen la capacidad de medirla por unidad de volumen. En la actualidad, existen diferentes equipos de densitometría que incorporan tecnología específica (software y hardware) que permiten ciertas ventajas en la adquisición de las imágenes. Los sistemas de “haz de lápiz” contiene un único detector, recolecta un pixel a la vez. El tiempo promedio para la evaluación de una cadera y la columna es de 3 a 5 minutos, mientras que el sistema de haz de abanico puede adquirir la imagen en menos de 30 segundos (Figura 2)

Figura 2. Principios básicos de la DXA.
De acuerdo con las recomendaciones 2023 de la ISCD (International Society for Clinical Densitometry) (26), las indicaciones para solicitar la evaluación de la DMO son:
- Mujeres ≥ 65 años
- En mujeres posmenopáusicas menores de 65 años, una prueba de DMO está indicada si presentan un factor adicional de baja masa ósea:
- Bajo peso
- Fractura
- Uso de medicación de alto
- Enfermedad o condición asociada con pérdida ósea.
- Mujeres durante la transición menopáusica con factores de riesgo clínico para fractura, como bajo peso corporal, fractura previa o uso de medicación de alto riesgo.
- Adultos con una FX
- Adultos con una enfermedad o condición asociada con baja masa ósea o pérdida ósea.
- Adultos que toman medicamentos asociados con baja masa ósea o pérdida ósea.
- Cualquier persona que esté siendo considerada para terapia farmacológica.
- Cualquier persona que esté bajo tratamiento, para monitorear el efecto del tratamiento.
- Cualquier persona que no esté recibiendo tratamiento y en la que la evidencia de pérdida ósea llevaría a iniciar tratamiento.
Regiones recomendadas para realizar DXA.
La OP puede diagnosticarse en mujeres posmenopáusicas si el T-score de la columna lumbar (CL), cadera total o cuello femoral es ≤ -2.5. Sin embargo, existen ciertas circunstancias donde se puede utilizar el radio al 33 % (también llamado radio 1/3). Entre estas situaciones se pueden mencionar:
- Cuando la cadera o CL no pueda ser evaluada
- Pacientes que superen el peso soportado por el equipo
- Hiperparatiroidismo
Adquisición de la región de interés (ROI) de la CL posteroanterior
El posicionamiento del paciente es fundamental para una correcta adquisición. El mismo, se lleva a cabo en posición supina sobre la mesa del equipo, con las rodillas flexionadas y las piernas elevadas apoyadas sobre un posicionador o cubo. El barrido comienza generalmente desde L5 a D12 y resulta en la DMO promedio y T-score derivado de L1-L4. Existen fuentes de error o artefactos como los materiales extraños o procesos degenerativos que pueden alterar la correcta valoración de la masa ósea. En estos casos, las vértebras que estén afectadas por artefactos o cambios estructurales deberían ser excluidas del análisis. Inclusive, se recomienda la exclusión de aquellas anormales anatómicamente si hay una diferencia de más de 1.0 en el T-score entre la vértebra en cuestión y las vértebras adyacentes.
Es importante destacar que el diagnóstico no puede ser realizado con una sola vértebra y que la proyección lateral no se recomienda para el diagnóstico de OP.
La ISCD recomienda que los fabricantes deben continuar utilizando sus propias bases de datos para la CL como estándar de referencia para los T-scores. Se recomienda usar una base de datos normativa uniforme de mujeres caucásicas para mujeres de todos los grupos étnicos (sin ajuste por raza).
Adquisición de ROI de la cadera
Las regiones de interés de la cadera que son utilizadas para el diagnóstico son el cuello de fémur (CF) y la cadera total (CT). El médico debería seleccionar aquella que presente menor valor y la cadera elegida (izquierda o derecha) es indistinta para la interpretación. Para explorar la cadera, la pierna se coloca ligeramente abducida y en rotación interna, utilizando un elemento de posicionamiento que permite maximizar la proyección del cuello femoral. Si la rotación es insuficiente, el cuello se acorta y la DMO resultante suele variar. Para diagnóstico, se considerará el valor más bajo en cuello femoral o fémur proximal total. Se preferiría utilizar CT para monitoreo. La ISCD recomienda que los fabricantes deben continuar utilizando los datos de NHANES III como el estándar de referencia para los T-scores del CF y CT.
Adquisición de ROI del antebrazo
La medición de DMO en el antebrazo se realiza con el paciente sentado junto a la mesa del escáner, colocando el antebrazo sobre una plataforma de posicionamiento, que en algunos equipos incluye una correa de sujeción para garantizar la estabilidad. Para el diagnóstico, se recomienda utilizar el radio al 33 % (o radio de un tercio) del antebrazo no dominante.
Control de calidad de la DXA
La DMO, al igual que cualquier método de medición, presenta cierta variabilidad inherente; por ello, resulta indispensable implementar estrictos procedimientos de control de calidad y asegurar la adecuada capacitación de los técnicos responsables del posicionamiento del paciente. El control de calidad en DXA comprende un conjunto de acciones sistemáticas orientadas a garantizar que las mediciones de la DMO sean precisas, reproducibles y comparables a lo largo del tiempo, especialmente cuando se utilizan con fines diagnósticos y de seguimiento clínico.
Siempre que sea posible, los pacientes deben realizar sus estudios de seguimiento en el mismo equipo DXA utilizado en su evaluación previa más reciente, asegurando que los valores de precisión in vivo y el mínimo cambio significativo (MCS) de la institución sean conocidos y no superen los límites aceptados. La falta de estandarización entre dispositivos puede pasar inadvertida para médicos y pacientes, lo que conlleva el riesgo de tomar decisiones terapéuticas basadas en diferencias de calibración entre equipos o en valores de MCS más amplios, en vez de en verdaderos cambios en la densidad ósea. Es fundamental conocer que el MCS refleja la variabilidad combinada del equipo, del técnico y de la población evaluada, lo que lo convierte en un parámetro único para cada centro y dispositivo. Por ello, no es apropiado aplicar el MCS de una institución a estudios realizados en otra.
Además, debido a la variabilidad entre instrumentos, incluso varios escáneres dentro de un mismo centro requieren calibración cruzada antes de utilizar el MCS en el seguimiento.
DXA y calculadores de riesgo de fractura
El evento más importante a prevenir es la FX. Por lo tanto, la evaluación de la DMO por DXA debería cumplir un rol fundamental en la detección de pacientes vulnerables. Sin embargo, cabe destacar que existen otros factores de riesgo clínicos que contribuyen al suceso (27). Por ello, y con el fin de individualizar el riesgo de fractura, diferentes algoritmos fueron evaluados. Entre los más utilizados se mencionan: FRAX®, QFracture y GARVAN, siendo el primero el evaluado en mayor número de estudios independientes (28).
FRAX® es una herramienta utilizada para predecir la probabilidad individual de fractura mayor o cadera a 10 años. La misma puede ser calculada con el ingreso de la DMO de cadera o ajustada por el puntaje de hueso trabecular (29).
Reporte mínimo del informe del estudio basal y del seguimiento
El informe o reporte es una pieza fundamental del estudio. La ISCD recomienda que para un informe adecuado debería considerarse lo siguiente:
- Datos demográficos (nombre, número de historia clínica, fecha de nacimiento, sexo).
- Médico solicitante
- Indicaciones para el estudio
- Fabricante y modelo del equipo utilizado
- DMO en g/cm² para cada
- Sitios esqueléticos, ROI y, si corresponde, el lado que fue
- Los informes deben contener una descripción del motivo por el cual los exámenes adquiridos no fueron informados o cuándo un estudio DXA técnicamente aceptable presenta aspectos que podrían afectar los resultados de la DMO. Algunos ejemplos son: cambios degenerativos, prótesis o elementos extraños.
- Listar los factores de riesgo del calculador de riesgo de fractura, mencionando la herramienta utilizada.
- No es apropiado aplicar un MCS a estudios comparativos que no se hayan adquirido en el mismo equipo, a menos que se haya realizado una calibración cruzada.
- Al informar o referirse a la raza, se prefiere “Blanco” en lugar de “Caucásico”.
- Un informe DXA (basal y de seguimiento) debe indicar que se recomienda un examen de seguimiento siempre que haya una comparación válida disponible; el momento preciso depende de las circunstancias clínicas particulares. Las recomendaciones deben ser generales en caso de que se desconozcan los antecedentes.
Criterios opcionales
- Criterios de la OMS en base al T-score para el diagnóstico en mujeres posmenopáusicas y hombres de 50 años o más.
- En las recomendaciones actuales de la ISCD se sugiere que un informe de DXA basal puede tener una declaración general donde se indica que puede ser apropiada una evaluación médica para causas secundarias de baja DMO.
La DMO seriada puede usarse para determinar cuándo comenzar el tratamiento, porque la pérdida de masa ósea puede ser indicación para ello. También puede servir para monitorear la respuesta al tratamiento y la reevaluación del mismo.
Puede repetirse una vez por año, pero en condiciones de pérdida acelerada, tales como el uso crónico de corticoides o el hiperparatiroidismo primario puede testearse cada 6 meses.
Puntaje óseo trabecular (TBS)
El TBS es un índice de textura en escala de grises que evalúa la microarquitectura ósea a partir de imágenes densitométricas obtenidas por DXA en CL. Se efectúa a través de un software integrado al densitómetro, que permitiría estimar riesgo de fractura. El TBS puede ser aplicado sobre una densitometría de CL de reciente adquisición o previamente adquirida. Los valores altos de TBS reflejan una microarquitectura densa, que hay buena conectividad y que están disminuidos los espacios intertrabeculares, mientras que valores de TBS bajos implican una arquitectura ósea de mala calidad, baja conectividad y amplios espacios intertrabeculares. El TBS permite predecir fracturas independientemente de la DMO. Los pacientes en el tercio más bajo de TBS presentan un riesgo de fractura más alto, independientemente del valor de DMO. EL TBS se asocia con el riesgo de fractura vertebral, cadera y mayor en mujeres posmenopáusicas y con el riesgo de fractura de cadera y fracturas mayores en hombres mayores de 50 años. La combinación de DMO y TBS mejora la valoración del riesgo de fractura sobre todo en aquellos pacientes con T-score en rango de osteopenia. También se ha demostrado que el TBS es un predictor significativo de fracturas independiente del cálculo de riesgo de fractura estimado por FRAX. El TBS puede ser utilizado en asociación con el FRAX® y la DMO para ajustar la probabilidad del FRAX® en el riesgo de fractura en mujeres posmenopáusicas y hombres añosos. El TBS se asocia con el riesgo de fractura por OP en mujeres posmenopáusicas con diabetes mellitus de tipo 2. El TBS no debe ser usado como única herramienta para determinar recomendaciones de tratamiento en la práctica clínica (30)
Evaluación de fracturas vertebrales (VFA)
VFA es el término correcto para denominar la imagen densitométrica de la Columna realizada con el propósito de detectar fracturas vertebrales (FV).
Indicaciones para la VFA
La imagen lateral de columna mediante VFA densitométrica está indicada ante la presencia de un T-score < –1,0 y la presencia de al menos una de las siguientes condiciones:
- Mujeres de ≥ 70 años o varones de ≥ 80 años.
- Pérdida de estatura histórica > 4 cm (>1,5 pulgadas).
- Fractura vertebral previa autoinformada pero no
- Tratamiento con glucocorticoides equivalente a ≥ 5 mg de prednisona (o equivalente) por ≥ 3 meses.
Métodos para definir e informar fracturas en VFA
El método visual semicuantitativo de Genant (31) es la técnica clínica de elección actual para diagnosticar FV mediante VFA. Por otro lado, la severidad de la deformidad puede confirmarse mediante medición morfométrica si se desea.
Radiología convencional
Esta modalidad permite detectar la pérdida ósea cuando existe una disminución de la masa ósea mayor al 30%, pero la variabilidad de los factores técnicos tales como la exposición radiográfica y el engrosamiento de los tejidos blandos pueden dificultar el diagnóstico.
Los principales rasgos radiográficos de la OP generalizada son el aumento de la radiolucidez y el adelgazamiento de la cortical. La primera resulta de la resorción ósea y del adelgazamiento trabecular.
El hueso trabecular responde más rápidamente a los cambios metabólicos y es más prominente en el esqueleto axial y en la diáfisis de los huesos largos (ejemplo: fémur proximal y radio ultradistal).
Los primeros cambios en el hueso trabecular de la columna lumbar incluyen la rarefacción de las trabéculas horizontales acompañado de la acentuación de las trabéculas verticales; mientras que el adelgazamiento cortical se produce por la resorción ósea de la cortical tanto endosteal, intracortical o periosteal.
La pérdida de las estructuras trabeculares en la OP vertebral acentúa el contorno cortical, produciendo una imagen radiológica conocida como enmarcación. La radiología de columna continúa siendo de ayuda en el diagnóstico y seguimiento de las FV y sirve como complemento de varios métodos morfométricos cuantitativos que han sido introducidos para reducir la subjetividad del radiólogo en la lectura de la altura vertebral.
Las FV se localizan usualmente en la unión dorsolumbar, pero pueden ocurrir en cualquier vértebra, pudiendo ser múltiples en el 20-30% de los casos. Las fracturas aisladas localizadas por encima de la dorsal 7 infrecuentemente son osteoporóticas y pueden alertar a la búsqueda de causas secundarias.
Eventualmente el cuerpo vertebral se deforma, pero no todas las deformidades vertebrales son debidas a OP. Las FV moderadas o severas son reconocidas con facilidad con los métodos radiológicos convencionales, pero las deformidades leves son más difíciles de reconocer. Las fracturas pueden ser bicóncavas, en cuña o por aplastamiento. (32)
Varios métodos han sido desarrollados para diagnosticar las FV en la radiografía de columna de perfil. Genant describió la siguiente escala (31).
- Grado 0: normal
- Grado 1: deformidad leve. Una reducción de la altura anterior, media o posterior del cuerpo vertebral, de aproximadamente 20% a 25% y/o una reducción del área de 10% a 20%.
- Grado 2: deformidad moderada. Una reducción de cualquier altura del cuerpo vertebral de 25% a 40% y /o una reducción del área de 20% a 40%.
- Grado 3: deformidad severa. Una reducción ≥ 40% en cualquier altura y/o área del cuerpo vertebral.
Los cambios en el esqueleto apendicular son más precoces en las diáfisis de huesos largos y huesos tubulares (manos, fémur proximal, calcáneo) debido al predominio de hueso trabecular
Laboratorio
El diagnóstico de OP se basa principalmente en criterios densitométricos, estas evaluaciones proporcionan mediciones estáticas como la cantidad de hueso y reflejan los efectos de cambios ocurridos en el pasado. En cambio, las determinaciones de laboratorio, como los marcadores óseos entre otras, son mediciones dinámicas que brindan información en tiempo real sobre el estado metabólico del hueso, permitiendo identificar si existe pérdida de matriz ósea o formación de hueso nuevo. La evaluación de laboratorio se recomienda habitualmente en mujeres posmenopáusicas y en varones mayores de 50 años con riesgo aumentado de fracturas osteoporóticas y caídas (33). Además, la valoración bioquímica permite identificar causas secundarias, valorar el metabolismo óseo y mineral, y monitorear el tratamiento.
En un centro privado especializado de la República Argentina, se encontró que el 26,3% de la OP diagnosticada presentaban causas secundarias utilizando una evaluación bioquímica mínima (5), por otra parte el Servicio de Endocrinología del Hospital Durand encontró un 20% utilizando determinaciones básicas de cálcio y fósforo, aumentando el diagnóstico al 40% si agregaba PTH, 25 (OH) vitamina D (25OHD) y ecografía renal (34).
Este consenso busca estandarizar la solicitud e interpretación de estudios de laboratorio en pacientes con osteoporosis o con riesgo aumentado de fracturas (35).
Indicaciones para estudios de laboratorio
Se recomienda solicitar estudios bioquímicos en:
- Pacientes con diagnóstico densitométrico de OP (T-score ≤ -2,5).
- Pacientes con FX, independientemente del valor densitométrico.
- Pacientes con osteopenia y factores de riesgo clínico de
- Antes de iniciar tratamiento farmacológico antiosteoporótico.
- Durante el seguimiento del tratamiento, según indicación clínica.
Estudios Bioquímicos Básicos
Hemograma completo: puede evidenciarse anemia o mieloma múltiple. Si bien la anemia no está directamente vinculada a la osteoporosis, su presencia podría ser indicativa de malnutrición (33).
Calcemia (corregido por albúmina): el calcio sérico desempeña un papel fundamental en el metabolismo óseo. En adultos, los valores normales de calcio en sangre oscilan entre 8,5 y 10,5 mg/dL. En condiciones de hipoalbuminemia el calcio total disminuye, es por ello que hay que corregirlo: por cada descenso de albúmina de 1,0 g/dL se aumenta el calcio total 0,8 mg/dL. Por ejemplo: calcio total: 7.5 mg/dL y albúmina: 2.0 g/dL, el calcio total será: 7,5 + (2 x 0.8) = 9.1mg/dL. Considerando un valor de referencia de albúmina de 3,5 – 5,5 g/dL).
Calcio iónico: su valor es independiente de los valores de albúmina sérica, es la forma biológicamente activa. Aproximadamente el 40-50% del calcio circulante está unido a proteínas, y solo el calcio iónico es metabólicamente activo. Valor de referencia: 1,10 a 1,30 mmol/L.
Fosfatemia: aproximadamente el 85% del fósforo corporal se almacena en los dientes y los huesos, mientras que solo el 1% se encuentra en el líquido extracelular. El fósforo, junto con el calcio, constituye la hidroxiapatita, que es el principal componente estructural del hueso. Los niveles de fósforo pueden evaluarse tanto en suero como en orina. Estos valores pueden disminuir en el hiperparatiroidismo y elevarse en la enfermedad renal crónica. Los valores de referencia son 2,5 a 4,5 mg/dL, estos pueden cambiar en condiciones de mayor actividad ósea (36).
Fosfatasa alcalina total: es una enzima que se presenta en múltiples formas isoenzimáticas. Las principales isoenzimas detectadas en sangre provienen del hígado y del hueso. En la evaluación de la osteoporosis, la fosfatasa alcalina total carece de especificidad, ya que se superpone con las isoformas hepáticas y puede elevarse levemente en pacientes con fracturas. El aumento de aminotransferasas, fosfatasa alcalina total y gamma-glutamil transferasa puede sugerir consumo excesivo de alcohol. Por otro lado, una elevación de esta fosfatasa total con valores normales de calcio y fósforo debería hacer sospechar enfermedad de Paget. En la osteoporosis primaria, los niveles séricos de fósforo, calcio y fosfatasa alcalina total suelen encontrarse dentro de rangos normales.
Proteinograma por electroforesis: la electroforesis de proteínas séricas es una herramienta fundamental en la evaluación de pacientes con osteoporosis o fracturas por fragilidad, porque permite detectar causas secundarias, en particular gammapatías monoclonales que pueden manifestarse inicialmente con afectación ósea (19).
Creatinina y filtrado glomerular: la función renal está íntimamente relacionada con el metabolismo fosfocálcico y la homeostasis ósea. Alteraciones en el filtrado glomerular y los niveles de creatinina sérica impactan directamente sobre parámetros como el calcio, el fósforo, la vitamina D y la PTH, determinando cambios en la remodelación y mineralización ósea. Por lo tanto, es indispensable su determinación cuando se evalúa el metabolismo fosfocálcico del paciente (37).
Calciuria: la excreción urinaria de calcio en 24 horas varía según los cambios dietarios. En condiciones de dieta libre, pacientes de ambos sexos pueden eliminar hasta 300 mg de calcio en 24 horas. Se aconseja expresar los valores por kg de peso corporal para ambos sexos: hasta 4 mg/kg/día. Su medición es útil en la evaluación de osteoporosis de alto recambio (38).
Nota: los valores de referencia de cada analito pueden variar levemente según el laboratorio y la técnica utilizada, pero el descrito es el rango de referencia aceptado en la mayoría de las guías clínicas.
Estudios Bioquímicos Complementarios
PTH: la PTH intacta (PTHi), es la forma biológicamente activa, ejerce su acción principalmente sobre el hueso y el riñón, de manera independiente del índice de filtración glomerular. La disminución del calcio plasmático estimula la secreción de PTH, lo que conduce a la movilización del calcio almacenado en el esqueleto. Además, la PTH aumenta la absorción intestinal de calcio al promover la síntesis de 1,25- dihidroxivitamina D (1,25(OH)₂D) en los túbulos renales. También favorece la reabsorción de calcio en la porción ascendente del asa de Henle y facilita la excreción de fósforo. En conjunto, la PTH actúa como un regulador fundamental del remodelado óseo y de la actividad de los osteoclastos. Su valoración permite diagnosticar y diferenciar causas de hiperparatiroidismo (primario, secundario y terciario), que afectan la remodelación ósea y la homeostasis mineral (39). Además, es muy útil para el monitoreo de pacientes con enfermedad renal crónica, la cual juega un rol significativo en la etiología y desarrollo de la misma.
25OHD es el biomarcador aceptado para evaluar en los pacientes el estado nutricional de vitamina D. Sin embargo, la metodología de los ensayos, su estandarización y los niveles deseables, que pueden variar según la condición clínica subyacente, siguen siendo desafíos importantes. Se considera una práctica clínica inadecuada la solicitud reiterada de determinaciones de 25OHD en un mismo paciente a lo largo de un año sin una situación clínica que lo justifique (40).
Marcadores de Remodelado Óseo: los marcadores de remodelado óseo (BTMs) son metabolitos presentes en suero u orina que se generan durante el ciclo de remodelación ósea. La evaluación de estos marcadores ofrece información dinámica sobre el proceso de remodelado, ayudando al diagnóstico y al manejo de enfermedades esqueléticas (35). Se clasifican tradicionalmente en marcadores de formación ósea y marcadores de resorción ósea. Estos se integran dentro del concepto más amplio de Índices de Estado Óseo (Bone Status Indices, BSIs), que abarcan el conjunto de moléculas que contribuyen a definir el estado del esqueleto. Los BSIs incluyen no solo los BTMs, sino también componentes estructurales, subproductos de las actividades anabólicas y catabólicas, moléculas reguladoras, enzimas y hormonas implicadas en el metabolismo óseo. Los BTMs más relevantes desde el punto de vista clínico son, marcadores de formación: P1NP (propéptido amino-terminal del procolágeno tipo I) y la fosfatasa alcalina isoenzima ósea (BALP) y marcadores de resorción: telopéptido C-terminal β isomerizado del colágeno tipo I (β-CTX-I) y la Isoforma 5b de la fosfatasa ácida resistente al tartrato (TRACP5b) (41).
La determinación de los BMTs puede servir para:
- Monitorear respuesta al tratamiento (ej. antiresortivos o anabólicos)
- Evaluar actividad metabólica en casos
Recientemente, la IOF (International Osteoporosis Foundation) y la IFCC (International Federation of Clinical Chemistry and Laboratory Medicine) han propuesto las siguientes recomendaciones (41):
♣ Uso de PINP sérico y β-CTX-I en plasma EDTA como los marcadores de referencia de remodelado óseo en OP.
♣ Uso de BALP como marcador de formación ósea y TRACP5b como marcador de resorción ósea en la OP asociada a enfermedad renal crónica (ERC). La PTH sola no es suficiente para evaluar o tratar los trastornos del remodelado óseo en el contexto de ERC. En nuestro país no se encuentra disponible la determinación de TRACP5b.
♣ Los BTMs muestran su potencial como predictores independientes de fracturas, pero se requieren estudios de cohortes prospectivos adicionales —incluyendo OP asociada a ERC— para evaluar su interacción con factores de riesgo establecidos y su posible incorporación en herramientas de estimación de riesgo de fractura.
♣ Es necesario realizar estudios que relacionen los cambios en BTMs con la reducción del riesgo de fractura, a fin de definir objetivos terapéuticos óptimos para el seguimiento de la eficacia del tratamiento y la gestión de la suspensión o pausas terapéuticas.
♣ La mejor aplicación clínica de los BTMs debería ser coordinada conjuntamente por sociedades clínicas y de laboratorio, así como por organizaciones dedicadas a las enfermedades óseas y minerales, a nivel nacional, continental y global.
Interpretación y Derivación
Los hallazgos bioquímicos deben interpretarse en contexto clínico y densitométrico. En caso de resultados alterados (hipercalcemia, hipovitaminosis D grave, disfunción renal, proteinemia monoclonal, hipercortisolismo, etc.) se sugiere derivación a endocrinología, nefrología o reumatología para completar estudios y definir tratamiento.
Recomendaciones
- Solicitar siempre laboratorio de base al diagnosticar
- Individualizar estudios complementarios según antecedentes, examen físico y resultados iniciales.
- Controlar niveles de 25OHD previo a iniciar y durante
- Utilizar BTMs sólo en situaciones específicas.
Músculo: actividad física y sarcopenia
Introducción
El músculo y el hueso están estrechamente relacionados anatómica y funcionalmente. Variaciones en la masa y fuerza muscular se reflejan en modificaciones en la masa y estructura ósea (42).
La sarcopenia es reconocida como un problema de magnitud en el ámbito de la salud pública dado el crecimiento poblacional de individuos añosos y sus consecuencias clínicas, económicas y sociales (43, 44).
El ejercicio físico construye huesos sanos en los niños, fortalece músculos y huesos en niños y adultos, previene la pérdida ósea en adultos, aumenta la densidad ósea, mejora el equilibrio y la coordinación, ayuda a prevenir caídas y fracturas y finalmente es un recurso efectivo para tratar la sarcopenia y la OP (45).
La sarcopenia afecta hasta un 10% de los individuos mayores de 60 años y hasta un 50% de los mayores de 80 años (43,46). La sarcopenia, principalmente la pérdida de fuerza muscular, es un predictor significativo de mortalidad, calidad de vida, caídas y fracturas. (43,46)
Definiciones
La sarcopenia es un desorden músculo-esquelético progresivo multifactorial y generalizado definido por 3 criterios:
- 1-Baja Fuerza muscular
- 2-Baja cantidad o calidad muscular
- 3-Bajo rendimiento físico
Cuando se cumple el CRITERIO 1 el diagnóstico de sarcopenia es probable. Cuando se cumple el CRITERIO 1 + 2 se confirma el diagnóstico de sarcopenia.
Cuando se cumple el CRITERIO 1 + 2 + 3 se diagnostica sarcopenia severa. (43,47-50).
Etiología y Fisiopatología
La sarcopenia se clasificar en:
- Primaria: asociada al envejecimiento
- Secundaria: asociada a enfermedades, malnutrición o inmovilización. (47,48,51).
Los músculos generan mayor fuerza sobre el hueso que la propia gravedad. En el mismo sentido, el ejercicio físico con carga debe imponer una mayor tensión al hueso, que la carga habitual, para generar una respuesta adaptativa osteogénica y cambios morfológicos en el mismo (52-54).
La disminución o ausencia de carga mecánica sobre el sistema músculo-esquelético (edad avanzada) lleva a atrofia muscular y caída de la fuerza contráctil por debajo del umbral de mínima fuerza efectiva para el remodelamiento (mayor resorción qué formación) y consecuente pérdida de masa ósea (48,55).
Diagnóstico
La disminución de la masa, fuerza y rendimiento muscular, cuando supera los límites medibles establecidos, instala el diagnóstico de sarcopenia. (44,46)
El screening para sarcopenia en personas mayores de 65 años debe realizarse en forma anual o ante sospecha clínica. (50)
Screening:
- Utilizar el SARC-F (Strength, Assistance in walking, Rise from a chair, Climb stairs and Falls), un cuestionario autoadministrado validado internacionalmente y en diferentes poblaciones. Consta de 5 items (a cada uno se le asigna un valor 0-1 o 2 puntos). Un valor mayor o igual a 4 puntos hace sospechar sarcopenia. (47,50,56-58).
- También puede utilizarse para screening la prueba de velocidad de la marcha (49).
Medición de parámetros musculares
Se sugiere que los profesionales de la salud basen el diagnóstico de sarcopenia en herramientas de medida objetivas (49)
Fuerza muscular
- Prueba de apriete del puño: con un dinamómetro de mano se realizan 2 mediciones de la fuerza del puño de la mano hábil y se selecciona el valor más alto para el registro (59). Punto de corte: Hombres < 27 kg / Mujeres < 16 kg (49,50).
- Prueba de pararse/sentarse: se toma el tiempo que demora en completarlo 5 veces. Punto de corte: > 15 segundos (47,56,57).
Masa muscular
- RNM y TC: son el gold estándar pero tienen mayor costo y requiere personal entrenado.
- La DXA es el método más utilizado para calcular la masa magra corporal total y apendicular (49).
- BIA (análisis de impedancia bioeléctrica): método no invasivo que envía una corriente eléctrica a través del cuerpo para estimar la composición corporal (50).
Punto de corte:
- Hombres <20 kg (RNM) o <7.0 kg/m2 (DXA: masa magra apendicular/estatura) o <7.0 kg/m² (BIA: IMLG = índice de masa libre de grasa).
- Mujeres <15 kg (RNM) o <5.5 kg/m2 (DXA: masa magra apendicular/estatura) o <5.7 kg/m² (BIA: IMLG) (47,56).
Rendimiento físico (locomoción)
- Velocidad de marcha: se toma el tiempo empleado para caminar 4 metros con marcha habitual, es el más utilizado.
Punto de corte: un valor ≤0.8 metros/segundo es indicativo de sarcopenia severa. (47,50,56,57,59).
- SPPB (Short Physical Performance Battery): son tres pruebas: equilibrio, velocidad de la marcha y levantarse/sentarse de una silla (59).
Punto de corte: ≤ 8 puntos (58).
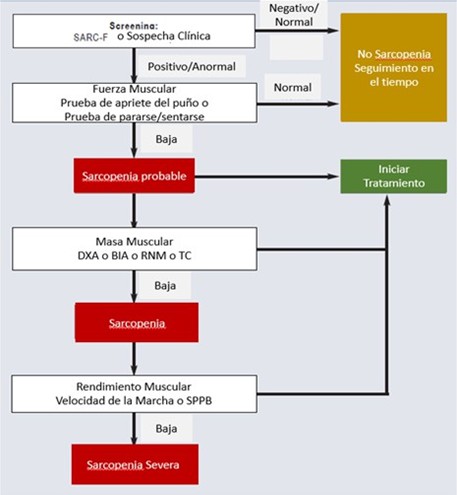
Figura 3. Algoritmo diagnóstico de sarcopenia en personas de edad avanzada (58)
Tratamiento
Las estrategias para prevenir y tratar la sarcopenia incluyen un abordaje integral:
- Adecuado aporte calórico y proteico: precedido de actividad física de resistencia. (48,50,56,59,60)
- 1-1,5 g de proteína/kg peso/día, excepto en insuficiencia renal grado (49,50,59)
- Aporte de Vitamina D:
- 800 -1000 UI/día (48,56,60).
La indicación debe evaluarse individualmente, suplementar cuando el dosaje 25OHD es < 30 ng/ml. (58,59).
- 800 -1000 UI/día (48,56,60).
- Ejercicio físico (Figura 4).
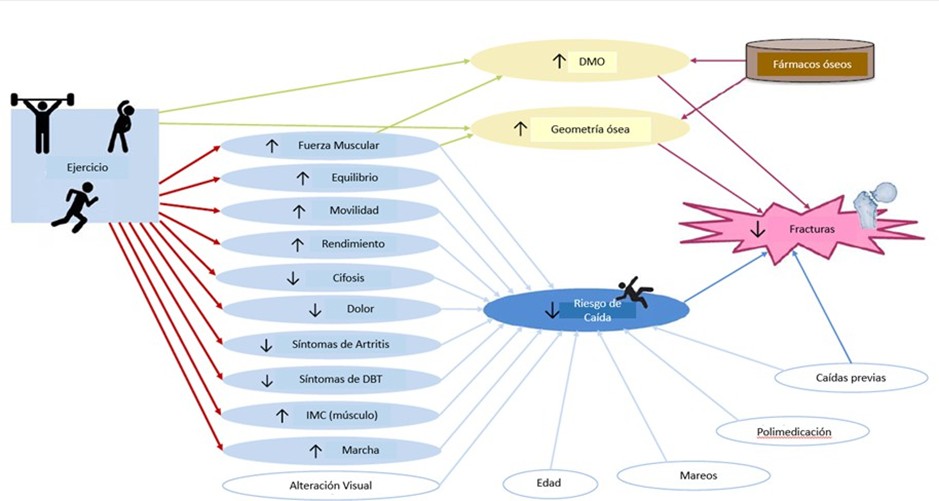
Figura 4. Beneficios del ejercicio sobre la salud muscular.
El ejercicio físico tiene múltiples beneficios en los pacientes con sarcopenia - osteoporosis/osteopenia (49,52,57,61).
- Ejercicios para mejorar la fortaleza muscular y ósea:
A) Ejercicios de impacto:
- Bajo impacto: ej: caminar
- Moderado impacto: ej: correr
- Alto impacto: ej: basquet
Variables a considerar para el ejercicio de impacto (52,54,61-63):
- 50 impactos/sesión
- Repartidos en 5 ciclos de 10 impactos/ciclo
- Al menos 2-3 días/semana
La actividad física de menor impacto como andar en bicicleta tiene menos beneficio sobre la DMO (55).
Caminar debería combinarse con otros ejercicios, de resistencia y/o impacto, para tener beneficio óseo (52).
En caso de OP evitar ejercicios de alto impacto, y en caso de FV se recomienda bajo impacto. (61,64)
Si el paciente elige ejercicios sin la carga del peso corporal, como nadar, incentivarlo a que lo combine con ejercicios de resistencia y equilibrio (62).
B. Ejercicios de resistencia: ejercicios que soportan el peso corporal, utilizan máquinas de pesas, bandas elásticas o mancuernas.
El ejercicio físico de resistencia es la primera línea de tratamiento en la sarcopenia ya que mejora la fuerza, la masa muscular y el rendimiento físico (49,50,58,59)
Fundamento del ejercicio osteogénico: a mayor carga sobre el hueso, menor cantidad de ciclos se necesitan para generar osteogénesis (levantar carga pesada)
El máximo beneficio osteogénico se obtiene con una magnitud de carga por encima del umbral de estímulo óseo, breve y repetida por un límite de ciclos (pocas repeticiones de alta intensidad), que se sostiene en el tiempo con regularidad semanal. (54)
Variables a considerar para el ejercicio de resistencia: (45,47,52,54,60,61,63,64,65,66)
- Trabajar al menos 3 grupos musculares mayores (miembro superior, inferior y tronco, incluyendo los músculos extensores de la columna)
- Comenzar con 40-60% y progresar a 70-85% de intensidad (% de la máxima intensidad posible en 1 sola repetición) (56)
- 5 a 12 repeticiones por ciclo
- 2 a 5 ciclos de cada ejercicio o región muscular
- 30-60 minutos/día
- Al menos 2 a 3 días/semana, en días no consecutivos (52,65) para lograr desensibilización a la sobrecarga (67).
C. Ejercicios de equilibrio: generan estabilidad y seguridad en los movimientos reduciendo el riesgo de caídas y lesiones. (52,64)
Algunos ejercicios de equilibrio: Tai-Chi, pararse en 2 o 1 pie, caminar sobre diferentes superficies / hacia atrás, estocadas, variar el punto de apoyo del peso corporal en bipedestación (45,54).
Variables a considerar para el ejercicio de equilibrio: (52,54,61-64)
- Progresar de menor a mayor dificultad
- Entorno seguro - con o sin apoyo
- Al menos 15-20 min/día
- 2-3 /semana
- 1 a 3 veces por
D. Ejercicios posturales
- Mantener los hombros hacia atrás
- Rotaciones cervicales
- Estiramiento de la columna en posición sentada o parada (64).
- Postura adecuada con el cuello y la columna alineados
- Involucrar a los músculos abdominales
- Efectuar movimientos suaves y controlados valorando el esfuerzo ante una carga (61).
- Evitar levantar o empujar elementos en flexión hacia adelante o rotación de la columna (47).
Variables a considerar para el ejercicio postural:
- 10 a 15 repeticiones
- 2 a 3 ciclos (54)
- 2 a 3 veces/semana
E. Ejercicio combinados: son los sugeridos en pacientes con osteoporosis y fracturas vertebrales osteoporóticas y tienen por objetivo combinar ejercicios que aumenten la fortaleza muscular/ósea y disminuyen el riesgo de caídas (52,54,56,61-63,66).
Variables a considerar para el ejercicio multicomponente:
- Combinación de ejercicios de impacto y resistencia (52,64).
- 30-40 minutos
- Al menos 3-4 veces/semana
- Incluir ejercicios de equilibrio y posturales
- Al menos 2 o 3 días/semana. (64)
- Considerar el agregado del ejercicio aeróbico (52,66)
II. Consideraciones generales:
Un terapista físico profesional indicará un programa a la medida de las necesidades, condiciones y riesgos del paciente, con especial atención en el caso de osteoporosis, caídas o antecedente de fractura vertebral. (50) Estimular en el paciente una actitud positiva y de autoconfianza para lograr adherencia al plan de entrenamiento y disminuir el miedo a caerse. (50) Aquellos pacientes con patologías crónicas o discapacidad que no puedan realizar la actividad física sugerida, deben mantenerse lo más activos posible dada su condición particular, independientemente de su edad y salud ósea (45,61).
Se requiere la intervención de un equipo multidisciplinario que ajuste gradualmente el programa de entrenamiento físico en su intensidad, duración y frecuencia para cada caso individual (50,54,63,65).
Dieta
“Comer bien y mantenerse físicamente activo son dos componentes esenciales de un estilo de vida saludable. Estos también son los pilares de la prevención de la osteoporosis en todas las etapas de la vida. Aunque la genética determina en gran medida el tamaño y la densidad de los huesos, factores del estilo de vida como el ejercicio regular y una buena nutrición también juegan papeles clave” (68).
El objetivo principal en los adultos es evitar la pérdida de masa ósea prematura y mantener el esqueleto sano. Dicho esto, describiremos cuáles serían los alimentos y suplementos que nos aportan beneficios comprobados en la prevención y tratamiento de la osteopenia /OP.
Los nutrientes principales para la salud ósea son el calcio, la vitamina D y las proteínas. También son importantes la incorporación de otros micronutrientes, entre ellos, la vitamina A, las vitaminas B, la vitamina K, el magnesio y el zinc.
Calcio
El calcio es un componente estructural clave del hueso, en él albergamos el 99% de las reservas de calcio. Se deposita como cristales de hidroxiapatita. El calcio también desempeña un papel importante en el funcionamiento nervioso y muscular, por lo que la calcemia debe estar muy controlada. Como consecuencia de ello, el esqueleto actúa como un “reservorio” de calcio. Si los niveles en sangre disminuyen, la PTH libera calcio del esqueleto al torrente sanguíneo para mantener la calcemia, entre otros mecanismos.
El calcio es importante para la salud ósea en todas las etapas de la vida, en especial, durante la adquisición del pico de masa ósea.
El calcio se absorbe en el intestino delgado tanto por difusión pasiva como por absorción activa regulada por la vitamina D. Las personas que tienen más vitamina D pueden absorber más calcio. Por lo tanto, en combinación con la vitamina D, se piensa que una ingesta total mínima de calcio de aproximadamente 800 mg por día puede ser suficiente. Esta cantidad de calcio se puede lograr mediante una dieta saludable que contenga una dosis diaria de alimentos ricos en calcio (por ejemplo: 1 vaso de leche o una rebanada de queso duro = 300 mg de calcio; 1 vaso de agua mineral rica en calcio = 200 mg de calcio; 4 sardinas = 500 mg; 28 gramos de almendras = 75 mg de calcio).
La fuente nutricional de calcio por excelencia son los lácteos, por su alto contenido (1000 -1300 mg/L) y por su mejor absorción intestinal por factores como los fosfopéptidos de la caseína o la lactosa. Por el contrario, otros factores (como los fitatos y oxalatos) dificultan la absorción del calcio de los alimentos de origen vegetal (legumbres, frutos secos, verduras y hortalizas) haciendo que su biodisponibilidad sea menor en algunos casos (69,70).
Se aconseja evitar la ingesta de productos lácteos junto con cereales integrales, legumbres, frutos secos o semillas oleaginosas, ya que estos alimentos son ricos en fitatos, los cuales disminuyen la biodisponibilidad del calcio presente en los lácteos. El contenido en fitatos disminuye con el proceso de remojo, de ahí la utilidad del remojo de las legumbres para favorecer la absorción del calcio. También, es necesario destacar, el elevado contenido de oxalatos existente en el cacao ya que, en muchas ocasiones, la leche que se consume es chocolatada y aporta menor cantidad de calcio que si se tomara de forma natural (71).
Tabla 6. Alimentos ricos en calcio (71).
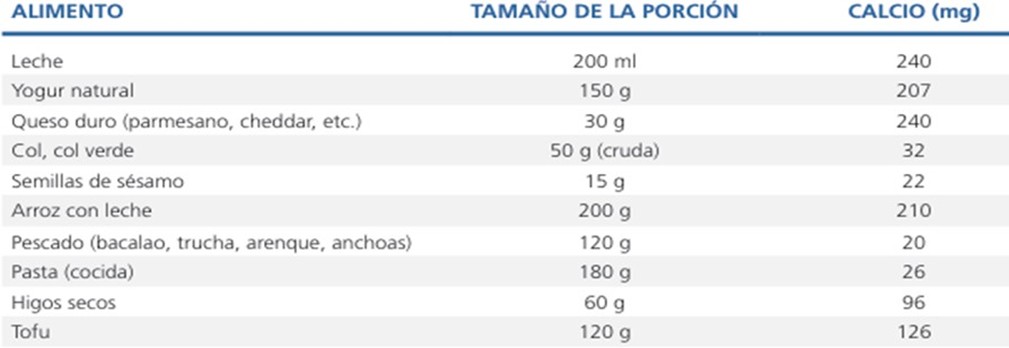
Alimentos vegetales ricos en calcio (71):
- Brasicáceas: brócoli, coliflor, coles de Bruselas, coles, berzas, col china, tienen mejor biodisponibilidad que la leche.
La limitación frente a los lácteos, en ocasiones, es por la tolerancia digestiva y que resultan más difíciles de tomar a cualquier hora del día y/o varias veces al día.
- Tofu: el contenido de calcio varía en función del coagulante (nigari) usado en su fabricación, cloruro de magnesio o sulfato de calcio.
- Legumbres en general, presentan una biodisponibilidad del 21 al 27% pero siguen siendo buenas fuente de calcio.
- Bebidas vegetales enriquecidas con calcio: 1 vaso contiene unos 300 mg de calcio. Su biodisponibilidad es similar a la leche de vaca cuando se usa carbonato cálcico y no fosfato tricálcico como fuente para enriquecer la bebida vegetal. Es importante agitar bien el envase porque el calcio se deposita en la base.
- Frutas desecadas: higos, albaricoque, pasas, así como pequeñas cantidades de algas (hiziki, wakame, kombu o dulse) ayudarán a completar la ingesta diaria de calcio.
- Frutos secos y semillas: 2 cucharadas de tahine (manteca/crema de sésamo) contiene 154 mg de calcio, pero con tasas de absorción relativamente bajas; el remojo de los frutos secos y semillas mejora su absorción.
Es importante interrogar el hábito alimentario para evaluar el consumo de calcio. La ingesta de calcio promedio en los adultos es alrededor del 50% de la recomendada Los pacientes con un consumo de calcio dietario insuficiente deberían modificar su dieta o recibir suplementos de calcio. Para alcanzar la óptima absorción, la cantidad de calcio administrado no debería exceder 500-600 mg/ dosis. En aquellos pacientes que requieran suplementar dosis mayores de 600 mg, esta debería ser dividida. Tanto el carbonato como el citrato de calcio ofrecen un alto contenido de calcio elemental por tableta (40 y 21% respectivamente).
Con respecto a la suplementación del Calcio, se prefieren los provistos por los alimentos antes que los suplementos dietarios, y las causas principales son:
- Los alimentos ricos en calcio, como los lácteos (leche, yogur, queso) y los frutos secos, contienen nutrientes adicionales valiosos para la salud ósea y muscular, especialmente proteínas de alta calidad.
- La suplementación de calcio en altas dosis puede no ser beneficiosa para la salud cardiovascular, mientras que los alimentos ricos en calcio no están asociados con un aumento del riesgo cardiovascular (72).
- Los suplementos de calcio pueden reducir la absorción intestinal de fosfato, lo cual puede ser perjudicial ya que se necesita una relación equilibrada de calcio-fosfato para la mineralización ósea. Cada aumento en la ingesta de suplementos de calcio de 500 mg/día disminuye la absorción de fósforo en 166 mg. Por el contrario, los productos lácteos proporcionan tanto calcio como fosfato.
Los suplementos de calcio pueden causar dispepsia de diversos grados, flatulencia, diarrea o constipación y aumentar el riesgo de litiasis de la vía urinaria en pacientes susceptibles. En pacientes con antecedentes de nefrolitiasis, las causas de la formación renal de cálculos o de hipercalciuria deberían ser evaluadas previa a la decisión de la suplementación de calcio En estos casos, conviene administrarlos junto con los alimentos, mantener un aporte abundante de líquidos y monitorear la calciuria. En el caso de antecedentes de litiasis renal, debe preferirse el citrato. Todo tratamiento farmacológico debe estar acompañado por una adecuada ingesta de calcio.
Los suplementos de calcio en edades adultas han mostrado un pequeño beneficio en la densidad mineral ósea, los suplementos de calcio en individuos con deficiencia de vitamina D no han demostrado reducir el riesgo de fracturas. Por lo tanto, la suplementación de vitamina D juega un papel clave en la salud ósea: la suplementación de calcio por sí sola es insuficiente para prevenir fracturas (73).
El enfoque en la prevención de fracturas ha cambiado hacia la suplementación de vitamina D en combinación con una dieta rica en calcio.
En 2011, el Institute of Medicine of The Nacional Academies (IOM) de los EEUU modificó las recomendaciones que existían desde 1994, disminuyéndolas en algunos períodos de la vida, donde pueden aparecer afectaciones cadiovasculares (74,75,6) (Tabla 7).
Tabla 7. Valores de calcio para los diferentes períodos de la vida determinados en 2011 por la Oficina de Suplementos Dietéticos del NIH (IOM) de los EEUU.
|
Edades |
Valores Sugeridos |
Límites Máximos |
|
Bebés hasta los 6 meses de edad |
200 mg |
1000 mg |
|
Bebés de 7 a 12 meses de edad |
260 mg |
1500 mg |
|
Niños de 1 a 3 años de edad |
700 mg |
2500 mg |
|
Niños de 4 a 8 años de edad |
1,000 mg |
2500 mg |
|
Niños de 9 a 13 años de edad |
1,300 mg |
3000 mg |
|
Adolescentes de 14 a 18 años de edad |
1,300 mg |
3000 mg |
|
Adultos de 19 a 50 años de edad |
1,000 mg |
2500 mg |
|
Hombres adultos de 51 a 70 años de edad |
1,000 mg |
2000 mg |
|
Mujeres adultas de 51 a 70 años de edad |
1,200 mg |
2000 mg |
|
Adultos de 71 o más años de edad |
1,200 mg |
2000 mg |
|
Adolescentes embarazadas o en período de lactancia |
1,300 mg |
3000 mg |
Cuando hablamos de las recomendaciones sobre el total de calcio diario de la ingesta, no se toma en cuenta la suplementación adicional de vitamina D. Como se sabe, las personas que tienen más vitamina D pueden absorber más calcio. Por lo tanto, en combinación con la vitamina D, una ingesta total de calcio más baja de alrededor de 800 mg por día es probablemente suficiente. Esta es la cantidad de calcio que se puede lograr a través de una dieta saludable que contiene una dosis diaria de alimentos ricos en calcio. Los pacientes con un consumo de calcio dietario insuficiente deberían modificar su dieta o recibir suplementos de calcio.
Recomendación
Se aconseja una ingesta diaria de 700 mg-1200 mg de calcio elemental. Si no se alcanza con dieta, es necesario usar suplementos (76)
Vitamina D (VD)
Introducción
El rol de la VD en la regulación de la homeostasis del metabolismo fosfocálcico y su repercusión sobre la salud músculo esquelética ha sido bien establecido. Su principal función es promover la absorción intestinal de calcio para sostener la homeostasis ósea, siendo esencial una adecuada ingesta de calcio.
La VD es esencial en el desarrollo y mantenimiento óseo a lo largo de la vida y podemos nombrar varias funciones clave:
- Favorece la absorción intestinal de calcio y fósforo
- Inhibe la secreción de PTH, lo que resulta en una reducción de la pérdida ósea
- Asegura la correcta renovación y mineralización del hueso
- Aumenta la reabsorción tubular de calcio y fósforo, disminuyendo la eliminación renal.
- Tiene un efecto estimulante directo sobre el tejido muscular y, por lo tanto, reduce el riesgo de caídas
Actualmente la evidencia epidemiológica demuestra un mayor riesgo de diversas enfermedades vinculadas con la hipovitaminosis D como afecciones cardiovasculares, metabólicas, oncológicas, respiratorias, autoinmunes e infecciosas.
Así como se establecieron múltiples consensos sobre el uso de la VD para las acciones óseas, existe aún controversia sobre las acciones extraóseas.
Una vitamina es definida como “un nutriente que es requerido por el organismo y no se puede sintetizar endógenamente”, estrictamente hablando la VD no es una vitamina sino una hormona liposoluble. Tiene receptores hormonales específicos distribuidos por todo el organismo y actúa tanto mediante mecanismo intranuclear como de membrana, además tiene una proteína ligadora específica que pertenece a la familia de la albúmina.
La VD ya sea sintetizada en la piel o ingerida en alimentos naturales y/o enriquecidos o suplementos medicinales, se convierte en 25OHD en el hígado y luego en un segundo paso de hidroxilación (1-alfa) conduce a la formación del metabolito activo, 1,25-dihidroxivitamina D en muchos tejidos.
De esto se desprenden dos temas relevantes: la concentración plasmática de la 25OHD refleja con mayor precisión el estado nutricional de VD, es por ello que cuando debemos evaluar los niveles de VD se solicita el estudio de 25OHD.Las mutaciones genéticas con pérdida de función en las hidroxilasas de VD (aunque son muy poco frecuentes) y diversos agentes farmacológicos pueden afectar la actividad de la VD.
Factores de riesgo
La exposición solar adecuada puede generar niveles adecuados de VD, sin embargo existen una multiplicidad de factores de riesgo para hipovitaminosis D (HPD) entre ellos:
- Menor exposición al sol
El estilo de vida actual genera que la mayor cantidad de horas del día, especialmente en los horarios de mayor radiación ultravioleta, se desarrollen en el interior de las casas o en los lugares donde se trabaja. Las personas institucionalizadas u hospitalizadas por tiempo prolongado, son un importante grupo de riesgo.
La vestimenta y el uso de protectores solares, incluidos los productos de maquillaje también generan menor exposición solar
- Baja ingesta de VD
Son muy pocos los alimentos que contienen cantidades útiles de VD como el aceite de hígado de bacalao o el salmón nativo, el resto tiene cantidades insuficientes para lograr buenas concentraciones de VD (71) (Tabla 8).
Tabla 8. Fuentes naturales de vitamina D.
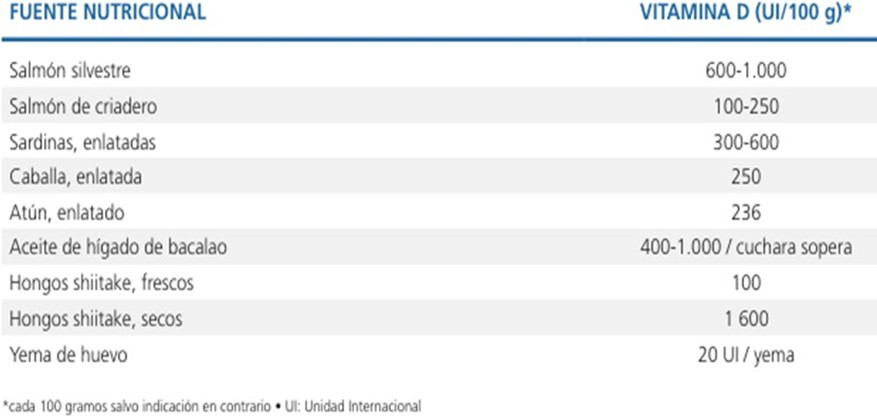
- Factores ambientales
La latitud en la que habitamos y los cambios estacionales condicionan las concentraciones de VD
- Factores Fisiológicos
El color de la piel, el embarazo y lactancia, el climaterio, adultos mayores (>65 años) y adultos mayores con antecedentes de caídas o fracturas no traumática
- Uso de medicamentos
Fármacos antiepilépticos, rifampicina, antirretrovirales, ketoconazol, glucocorticodies, colestiramina, anticoagulantes
- Enfermedades asociadas a alteraciones de los niveles de VD
- Músculo-esqueléticas: OP, osteomalacia, sarcopenia, antecedentes de fracturas
- Síndromes de malabsorción: enfermedad celíaca, enfermedad inflamatoria intestinal, enfermedad de Crohn, cirugía bariátrica, enteritis post radiación
- Enfermedades reumáticas: artritis reumatoidea, lupus eritematoso sistémico, fibromialgia
- Enfermedades neoplásicas
- Enfermedades formadoras de granulomas: sarcoidosis, tuberculosis, histoplasmosis, beriliosis, coccidiomicosis
- Enfermedades endócrinas y metabólicas: obesidad, diabetes, hipo
/hiperparatiroidismo, Hipo/hipertiroidismo, hiper/hipocalcemia, hipercalciuria, hiper/hipofosfatemia
- Insuficiencia hepática, renal o pancreática
- Enfermedades dermatológicas: dermatitis atópica, psoriasis
- Enfermedades del SNC y psiquiátricas: esclerosis múltiple, Parkinson, Alzheimer, déficit cognitivo, depresión, trastornos de la conducta alimentaria
- Personas trasplantadas o en proceso de trasplante
¿Cuándo medir VD?
La combinación y sumatoria de los factores de riesgo, han provocado que una gran parte de la población presente HVD.
De acuerdo a algunas publicaciones el 88 % de la población presenta niveles plasmáticos < 30 ng/ml, el 37 % de la población <20 ng/ml y el 7 % de la población <10 ng/ml (77)
Otros autores publican que el 50,8% de mujeres mayores de 50 años en Latinoamérica tienen deficiencia de VD, cifra que asciende al 59,3% cuando se considera a nivel global (78).
Es evidente que una parte muy importante de la población tiene HVD y un aspecto de suma controversia es a quién solicitar los dosajes de 25OHD y con qué frecuencia.
Recientemente fueron publicados varios consensos y guías internacionales
La guía de la Endocrine Society sugiere no medir de rutina niveles de 25OHD ni en las personas menores de 50 años como en las personas de 50 a 74 años (40,79).
El reciente consenso Mexicano sugiere medir niveles basales de 25OHD en adultos antes de iniciar la suplementación farmacológica con VD para permitir un diagnóstico apropiado y establecer la dosis terapéutica adecuada (80).
Realizar mediciones antes y durante la suplementación proporciona un control más preciso y permite una monitorización rigurosa del tratamiento y los ajustes necesarios. En los casos en que no sea posible evaluar la concentración sérica de 25OHD en grupos de alto riesgo, la suplementación con vitamina D debe realizarse según las recomendaciones establecidas para la población general, respetando las dosis máximas para el grupo de edad correspondiente
Suplementación
La suplementación farmacológica con VD no debe indicarse en adultos sanos con valores de 25OHD dentro de los parámetros óptimos
Existe controversia si se debe suplementar a las personas teniendo como objetivo las acciones extraóseas de la VD, con que dosificación, esquema y duración del tratamiento.
En el caso particular de este consenso de osteoporosis, existe acuerdo generalizado que todas las mujeres con reducción de la masa ósea u osteoporosis y bajos niveles de VD deben recibir suplementación con VD. Aquellas mujeres que presentan contraindicación para el uso de VD como hipercalcemia, enfermedad renal crónica avanzada, enfermedad hepática y, sarcoidosis, son del manejo del especialista.
Niveles adecuados de VD
Los niveles adecuados de VD para el tratamiento de la osteoporosis son un motivo de controversia y mucho más cuando se plantean los niveles para las acciones extraóseas.
Desde hace muchos años el IOM y la Endocrine Society dispusieron diferentes niveles de deficiencia e insuficiencia pero coincidían en los niveles óptimos de VD. Establecieron el valor de corte en >30 ng/ml (Figura 5).
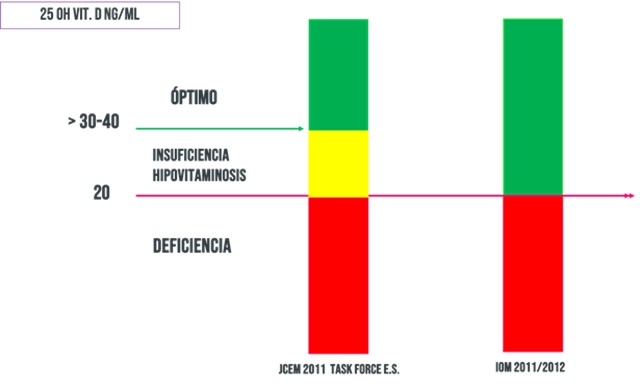
Figura 5. Niveles de Vitamina D
Además, el nivel de suficiencia se define en el rango de 30 ng/ml a 100 ng/ml. Algunos investigadores sugieren que existe evidencia que niveles inferiores a 20 ng/ml se asocian con el deterioro de la salud ósea, es por ello que este grupo de mujeres debería recibir suplementos de VD.
La VD es una molécula que tiene una ventana terapéutica muy amplia; el riesgo de toxicidad es muy bajo y excepcional con niveles inferiores a 100 ng/ml.
La hipervitaminosis D se manifiesta con náuseas, vómitos, dolor abdominal, fatiga y debilidad muscular, cefalea, confusión y desorientación y micción frecuente entre otros, esto debido a la hipercalcemia e hiperfosfatemia acompañada de hipercalciuria que producen los niveles plasmáticos excesivos de VD.
¿Cómo suplementar?
En nuestro país disponemos de una amplia gama de fármacos de VD, con presentaciones en gotas, comprimidos, soluciones bebibles; estos suplementos pueden administrarse en forma diaria, semanal, quincenal, mensual o en forma intermitente bimensual o trimestral.
La guía de la Federación Argentina de Sociedades de Endocrinología (FASEN) confeccionada en el 2015 que fue pionera en esta temática, estableció dos fases en el tratamiento de suplementación con VD: Una etapa de corrección del déficit que generalmente dura 2 a 3 meses y una segunda etapa de mantenimiento (81). La Tabla 9 resume los conceptos de esta guía
Tabla 9. Guía FASEN
|
Fase de Corrección |
Fase de Mantenimiento |
|
2000-5000 UI/día |
800-1200 UI/día |
|
50.000 UI/sem |
4.000 UI/día aceptada por expertos como aceptable |
|
100.000 UI/ cada 15-30 días |
100.000 UI/ cada 1 a 3 meses |
La Guía de Práctica Clínica de la Federación Latinoamericana de Endocrinología (FLASEN) para el uso de VD en el mantenimiento de la salud ósea: recomendaciones para el contexto latinoamericano, publica una sugerencia de tratamiento muy similar (78) (Tabla 10).
Tabla 10. Guía FLASEN
|
|
Dosis de Carga |
Duración |
Dosis de Mantenimiento |
Tiempo para evaluar respuesta desde el comienzo de la suplementación |
|
Colecalciferol |
4000-5000 UI/día |
2-3 meses |
800-1000 UI/día |
3-6 meses |
|
Colecalciferol |
25.000-50.000 UI/sem |
2-3 meses |
5000-10000 UI/sem |
3-6 meses |
|
Colecalciferol |
50000-100.000 UI/mes |
3 meses |
800-1000 UI/día |
3-6 meses |
|
Colecalciferol |
50000-100.000 UI única dosis |
|
800-1000 UI/día |
3-6 meses |
|
Calcifediol |
0.266 mg/cada 2 sem |
3 meses |
0.266 mg/mes |
3-6 meses |
De acuerdo con las publicaciones disponibles se recomienda como primera opción el uso del colecalciferol (VD3) para tratar y prevenir la HVD.
La suplementación con ergocalciferol (VD2) genera un menor incremento del nivel plasmático de 25OHD en comparación con la VD3; de todas formas dado el origen vegetal de la VD2 y su menor costo económico pueden utilizarse en mujeres veganas o vegetarianas o en aquellas que no tengan acceso a la VD3. En cuanto al calcitriol (1,25(OH)2D3) que es la forma activa de la VD se utiliza en pacientes con ERC que tienen dificultad para el segundo paso de hidroxilación renal.
En referencia al calcifediol, este fármaco tiene algunas ventajas como son: mayor biodisponibilidad y más rápida absorción con menor variabilidad en la respuesta terapéutica. Se reserva su uso en afecciones médicas específicas como la falta de respuesta a la VD3, o cuando se requiere un aumento inmediato de la concentración sérica de 25OHD, o cuando la capacidad de hidroxilación hepática está disminuida.
Recomendaciones
De acuerdo a los datos disponibles en la actualidad la evidencia es insuficiente para evaluar el balance riesgo/beneficio para realizar el dosaje de VD universalmente a todos los individuos; por lo que sugerimos solicitar la medición de 25OHD en mujeres posmenopáusicas con OP y también a todas las mujeres que presenten factores de riesgo.
Si es posible, medir VD antes de iniciar la suplementación y monitorizar el tratamiento por lo menos una vez por año
Todas las mujeres que presentan osteopenia u OP deben tener niveles apropiados de VD; si tienen niveles de 30 ng/ml o menos deberían recibir suplementos de VD excepto que presenten alguna contraindicación absoluta o relativa para su uso.
No superar los 100 ng/mL en los niveles plasmáticos de VD y, preferiblemente, mantenerlos > 30 ng/mL para la salud ósea y > 40ng / ml para las acciones extraóseas
Se debe seleccionar la dosis y la forma farmacéutica de la VD, ajustada a cada situación; asegurar la comprensión de la administración de VD tanto de la dosis como la frecuencia de la toma y pautar el seguimiento del tratamiento
Otras Vitaminas
Se considera que mantener una ingesta fisiológica de vitaminas es una estrategia nutricional para la prevención de la OP.
La ingesta excesiva de vitaminas también puede afectar negativamente la formación ósea, como se ha observado con la vitamina A. También se ha demostrado que las vitaminas E (tocoferoles y tocotrienoles), K2 (menaquinonas 4 y 7) y C promueven el desarrollo de osteoblastos a través de las vías de señalización de la proteína morfogenética ósea (BMP)/Smad y Wnt/β-catenina, así como la vía TGFβ/Smad (α-tocoferol). Ciertas vitaminas reducen significativamente la producción de activador del receptor del factor nuclear kappa-B ligando (RANKL) y la señalización RANKL/RANK, mientras aumentan el nivel de osteoprotegerina (OPG), reduciendo así la relación RANKL/OPG y ejerciendo efectos anti-osteoclastogénicos. El ácido ascórbico es un cofactor que participa en la hidroxilación de lisina y prolina y en la unión de las fibras de colágeno en el hueso; puede tanto promover como inhibir la señalización de RANKL, siendo esencial para la osteoclastogénesis. También se ha observado que la vitamina K2 previene la calcificación vascular al activar la proteína Gla de la matriz a través de su carboxilación. (82,83)
Se admite hoy en día que la vitamina K tiene un papel importante en la salud ósea. Es necesaria para la gamma-carboxilación de la osteocalcina (la proteína no colágena más importante en el hueso), activándola. Aunque la vitamina K previene las calcificaciones vasculares y de los tejidos blandos, también promueve la integración del calcio en el hueso. Estudios epidemiológicos sugieren que una dieta con niveles altos de vitamina K se asocia con un menor riesgo de fracturas de cadera en hombres ancianos y mujeres. Sin embargo, ensayos clínicos controlados y aleatorizados, realizados con suplementos de vitamina K1 o K2 en la población blanca, no muestran un aumento en la DMO ni disminución del riesgo de fractura (84).
Actualmente no existe una evidencia suficiente para recomendar el uso rutinario de suplementos de vitamina K para la prevención de la OP y las fracturas en mujeres posmenopáusicas.
Proteínas
La proteína de la dieta proporciona los aminoácidos necesarios para sostener el desarrollo de la matriz ósea. También tiene un efecto favorable sobre el hueso, ya que aumenta los niveles en sangre del IGF-I, que desempeña una función importante en la formación ósea. La variación en la ingesta proteica durante la niñez y la adolescencia puede afectar el crecimiento del esqueleto y puede modificar el potencial genético para alcanzar el pico de masa ósea. En los adultos mayores, la baja ingesta proteica se asocia con una pérdida de DMO en cadera y columna. En pacientes con fractura de cadera, se ha demostrado que el suplemento proteico reduce la pérdida ósea post fractura, las complicaciones médicas y la rehabilitación hospitalaria.
Al igual que la VD, la ingesta de proteínas tiene un doble beneficio, tanto a nivel óseo como muscular. Uno de los mecanismos mediante los cuales una mayor ingesta de proteínas puede tener una influencia positiva en la salud ósea y muscular es a través de un aumento en los niveles sanguíneos de IGF-1. La ingesta diaria regular de leche resulta en un aumento medible de los niveles de IGF-1 en la sangre en los niños. Esto también puede lograrse con suplementos de proteínas, como se demostró en un estudio entre pacientes mayores con fracturas de cadera. El IGF-1, producido por el hígado, promueve la formación ósea y muscular y apoya la conversión de la VD a su forma activa
Hasta el momento, la evidencia disponible indica que tanto las proteínas de origen vegetal como las de origen animal favorecen la salud ósea y muscular, contribuyendo así a la prevención de la OP.
Aumentar la ingesta de proteínas tiene un efecto beneficioso sobre la densidad mineral ósea en hombres y mujeres mayores que toman suplementos de VD más calcio, lo que sugiere un beneficio aditivo de estos nutrientes.
Es preciso asegurar la ingesta diaria de al menos 0,8 g de proteínas/kg de peso corporal. En adultos mayores, los requerimientos pueden ser mayores llegando a 1-1,2 g/kg/día, siempre controlando la función renal.
Fuentes nutricionales
Las proteínas como acabamos de mencionar, pueden ser de origen animal o vegetal. La carne, el pescado, los huevos o los lácteos son buenas fuentes alimentarias de proteína ya que contienen cantidades suficientes de los nueve aminoácidos esenciales. Sin embargo, otros alimentos, como las legumbres y el arroz, son deficitarios en algunos aminoácidos esenciales. En el caso de seguir un régimen vegano, una adecuada combinación de alimentos vegetales a lo largo del día permitirá complementar las deficiencias que presentan algunos alimentos en estos aminoácidos.
Tabla 10. Contenido de aminoácidos en distintas fuentes de alimentos.
Recomendación
Efectuar una dieta balanceada con adecuada ingesta de proteínas, calcio y VD y evitar el exceso de sal y alcohol
Tratamiento farmacológico
Cuando se inicia un tratamiento, es apropiado estratificar a los pacientes, de acuerdo al nivel de riesgo de fractura, ya que esto tendrá influencia en la selección del mismo.
Los medicamentos empleados en el tratamiento de la OP pueden clasificarse en:
- Antirresortivos o anticatabólicos: aumentan la resistencia ósea y reducen las fracturas, principalmente por la disminución del número de unidades multicelulares básicas (UMB), disminuyendo a mediano plazo la formación. Este desacoplamiento temporal explica la ganancia ósea de un 2 a 10% durante el primer año de tratamiento con los medicamentos antirresortivos. Reducen la resorción y preservan la microarquitectura ósea al prevenir un mayor daño estructural en el hueso trabecular y el aumento de la porosidad en el hueso cortical inducida por la elevada remodelación ósea. Algunas drogas anticatabólicas también pueden aumentar la fase de formación del ciclo de remodelación.
- Osteoformadores o anabólicos: aumentan la fortaleza y reducen las fracturas mediante un incremento sustancial de la masa ósea, resultado de un aumento general del número de UMB ; algunos aumentan el periostio por aposición y reparan la microestructura trabecular.
Terapia hormonal de la menopausia (THM)
La THM es considerada el tratamiento de elección para aliviar los síntomas asociados a la menopausia. Además de su efecto sobre los síntomas, la THM, en cualquiera de sus formas (estrógenos solos o combinados con gestágenos o con bazedoxifeno, y la tibolona) presenta un efecto antirresortivo, lo que hace que algunos de estos preparados también puedan utilizarse como una medida preventiva para la OP.
Tras la menopausia, se observa una disminución del hueso trabecular, seguida de una pérdida del hueso cortical a partir de los 70 años. La deficiencia de estrógenos provoca un aumento del recambio óseo, caracterizado por una resorción ósea acelerada mediada por los osteoclastos, junto con una formación ósea insuficiente. Este proceso conduce a una disminución de la masa ósea. Durante los primeros 5 a 7 años posteriores a la menopausia, la tasa de pérdida ósea varía entre el 1 % y el 5 % anual, lo que se debe principalmente a la caída de los niveles de estrógeno (85). Es bien sabido que la resorción ósea es especialmente rápida en los primeros 3 a 4 años de la menopausia, por lo que se recomienda considerar el inicio de la terapia hormonal en este período, aprovechando la denominada "ventana de oportunidad". Al detener y/o disminuir el aumento de la resorción ósea, se favorece el proceso de formación en la remodelación ósea, lo que resulta en un incremento significativo de la DMO.
Rol de la THM
El estrógeno es crucial para el desarrollo y el mantenimiento óseo, ya que el hueso es un tejido dependiente de estrógenos. Los estrógenos actúan sobre los osteoblastos a través de receptores específicos e influyen en los progenitores de osteoclastos, lo que provoca una reducción sustancial del crecimiento y de la actividad de los osteoclastos, esto es mediado por diversas vías, incluyendo el sistema del ligando del activador del receptor del factor nuclear kappa B (RANKL). Además, los estrógenos inhiben la apoptosis en osteoblastos y osteocitos, asegurando una síntesis ósea continua. La deficiencia de estrógenos durante la menopausia produce un aumento de la actividad de resorción osteoclástica, mientras que la actividad osteoblástica permanece relativamente constante, lo que en última instancia conduce a una pérdida neta de masa ósea (86).
Eficacia
Durante muchos años, los estrógenos se consideraron la terapia de elección para la prevención y tratamiento de la OP. El estudio PEPI (Postmenopausal Estrogen/Progestin Interventions) fue uno de los primeros ensayos clínicos aleatorizados que demostró que la THM preserva la DMO en mujeres posmenopáusicas evaluada mediante DXA. Se evidenció un aumento en la DMO a nivel de cadera y columna lumbar tras dos años de tratamiento, acompañado por una disminución en los BMTs, lo que sugiere que la THM reduce la tasa de remodelado óseo (87,88).
Posteriormente, el estudio WHI (Women’s Health Initiative), ensayo clínico aleatorizado, controlado y multicéntrico que incluyó más de 16.000 mujeres posmenopáusicas entre 50 y 79 años, demostró que la THM (estrógenos equinos conjugados (EEC) combinados con acetato de medroxiprogesterona ) disminuye de manera significativa el riesgo de fractura de cadera (34%), vertebral clínica (34%) y no vertebral (23%) en mujeres postmenopáusicas luego de 5 años de tratamiento(89). Un segundo análisis, con mayor seguimiento, confirmó nuevamente, una reducción estadísticamente significativa del riesgo de fracturas en el grupo tratado con THM. La reducción del riesgo fue consistente en todos los subgrupos evaluados, independientemente de variables como edad, índice de masa corporal, tabaquismo, antecedente de fractura, consumo de calcio, uso previo de THM o valores iniciales de DMO. Además, se documentó el incremento de la DMO en el grupo tratado respecto del placebo (90).
Estos resultados confirmaron que la THM incrementa la DMO y reduce el riesgo de fracturas en mujeres posmenopáusicas sanas. Desafortunadamente, la aceptación de la THM como tratamiento de primera línea se vió limitada por un análisis inicial que sugería que los riesgos asociados, principalmente cáncer de mama y enfermedad cardiovascular, superaban los beneficios en la prevención de fracturas. Análisis posteriores del estudio WHI indicaron que el riesgo cardiovascular puede minimizarse si la THM se inicia dentro de los 10 años posteriores a la menopausia o antes de los 60 años. A este intervalo, se lo denomina "ventana de oportunidad", ya que representa el período en el que los beneficios del tratamiento estrogénico superan los riesgos potenciales (91).
Dosis y vías de administración
La utilización de 1 mg de estradiol vía oral/día, 0,45 mg de EEC vía oral/día, 25 μg de estradiol administrado en parche transdérmico semanal han mostrado ser efectivas para la protección ósea, y existe evidencia que respalda el uso de dosis aún más bajas. La administración de dosis ultra baja (0,3 mg de ECE oral, 0,5 mg de 17β-estradiol oral y 14 μg de estradiol transdérmico) en mujeres posmenopáusicas tempranas (edad media: 51–52 años) como tardías (edad media: 67–74 años), incrementa de manera significativa la DMO en ambas poblaciones (92).
Tanto la administración oral como transdérmica de estrógenos demostró efectos positivos sobre la DMO. Se observó que el inicio temprano y el uso de dosis más altas tienen un mayor impacto, independientemente de la vía (93).
Indicación Clínica
Las guías de NAMS (North American Menopause Society), IMS (International Menopause Society), EMAS (European Menopause and Andropause Society) sostienen que la THM podría ser la terapia de primera línea para preservar la salud ósea en mujeres posmenopáusicas tempranas. La THM es una terapia adecuada para prevenir la pérdida de masa ósea en las mujeres menores de 60 años o que se encuentran dentro de los 10 años posteriores al inicio de la menopausia. Presenta una relación riesgo/beneficio favorable en esta población para el tratamiento de los síntomas de la menopausia y la prevención y tratamiento de la osteoporosis (91,94,95). La AACE (American Association of Clinical Endocrinology) también recomienda la THM pero que se utilice en la dosis más baja y durante el menor tiempo necesario para controlar los síntomas de la menopausia. Considera que la THM sólo está aprobada en EEUU para prevención de OP y su uso en el tratamiento, estaría reservado a pacientes con contraindicación a otras drogas osteoactivas (6). La Guía NICE (National Institute for Health and Care Excellence) del Reino Unido recomienda la THM para la prevención de la OP y las FX (96), La Endocrine Society recomienda el uso de THM en quienes los bisfosfonatos o el denosumab no son apropiados, es decir, como una segunda opción terapéutica (97).
El uso de la THM en mujeres con masa ósea disminuida, luego de 10 años de la menopausia podría considerarse como tratamiento, siempre que se realice un asesoramiento detallado sobre los riesgos y beneficios en comparación con otras alternativas terapéuticas disponibles para la OP. En estos casos particulares, es fundamental realizar una evaluación inicial cuidadosa y establecer un seguimiento anual durante la prescripción de la THM (85) así como referir a la paciente al especialista. Sin embargo, en las mujeres con riesgo aumentado de fractura, pero que ya reciben THM, se podría considerar su continuación después de los 60 años, por sus posibles beneficios a largo plazo en comparación con otras terapias no hormonales.
Si bien algunas directrices recomiendan iniciar la terapia preventiva de fracturas en función de la probabilidad estimada de fractura mayor mediante la herramienta FRAX®, este enfoque resulta limitado en mujeres posmenopáusicas sanas menores de 65 años, ya que el FRAX® no contempla el estado menopáusico ni el uso de THM (98).
El análisis del estudio NORA (National Osteoporosis Risk Assessment) reveló que un T-score ≤-1,8 en la DXA periférica se asocia con un mayor riesgo de fractura a corto plazo en mujeres posmenopáusicas ≥ 50 años (99). En este estudio, las fracturas que se presentaron en las mujeres de 50 a 64 años representaron un tercio de todas las fracturas y una quinta parte de las fracturas de cadera. Aunque la DMO se midió en sitios periféricos, este umbral de T-score se considera útil para identificar riesgo elevado, especialmente en mujeres menores de 65 años.
De forma consistente, un ensayo clínico en mujeres posmenopáusicas con un T-score ≤-1,84 en el cuello femoral mostró una incidencia acumulada de fracturas por fragilidad del 6,9 % en 3 años, respaldando el valor predictivo de este umbral (100).
Según los datos disponibles, un T-score ≤-1,8 periférico o de CF ofrece un punto de corte pragmático y conservador, a partir del cual, el riesgo de fractura aumenta en mujeres posmenopáusicas menores de 65 años.(98) Se ha demostrado que la THM previene la pérdida ósea y las FX en todas las mujeres posmenopáusicas, independientemente de la DMO y otros factores de riesgo. Por lo tanto, en mujeres posmenopáusicas asintomáticas menores de 65 años con un T-score ≤-1,8 es probable que el uso de THM reduzca fracturas futuras y que el beneficio supere cualquier riesgo potencial.
Las mujeres posmenopáusicas más jóvenes con bajo riesgo de fractura podrían presentar una alta probabilidad de fractura a lo largo de su vida y la THM retrasaría o evitaría su transición a un grupo de mayor riesgo, como resultado del envejecimiento y la disminución de la DMO (101).
Al suspender la THM, la pérdida ósea se reanuda, pero la protección contra las fracturas puede persistir durante varios años. A los pocos meses, los BMTs vuelven a los valores previos al tratamiento, mientras que la DMO alcanza los niveles previos entre 1 y 2 años después de suspender la terapia. En el WHI (Women's Health Initiative), tras la interrupción de la THM, el riesgo de fractura del grupo tratado volvió a los niveles observados en las mujeres que recibieron placebo, sin que se observara un riesgo excesivo de fractura tras la interrupción de la THM (91).
Un estudio que incluyó mujeres que habían participado previamente en un ensayo controlado con placebo, evaluó la masa ósea a los 5, 11 o 15 años de suspender la THM. Se observó que las tasas de pérdida ósea tras suspender la THM volvieron a los valores postmenopáusicos normales y la DMO de las mujeres tratadas previamente con THM continuaba siendo mayor que la de las mujeres que recibieron placebo, durante muchos años tras la interrupción del tratamiento. Además, el riesgo de fracturas osteoporóticas fue menor en el grupo tratado previamente con THM que en el grupo que recibió placebo. El estudio concluye que iniciar THM durante los primeros años de la posmenopausia, incluso por un periodo limitado, puede ofrecer protección ósea duradera y reducir el riesgo de fracturas (102).
Por todo lo expuesto, contamos con sólida evidencia que respalda el uso de la THM como terapia de primera línea en mujeres posmenopáusicas tempranas, con baja masa ósea y el manejo de la OP sin fracturas, especialmente en situaciones donde una terapia ósea dirigida, como los bifosfonatos, podría no ser apropiada.
Contraindicaciones
Las contraindicaciones más importantes descritas son: antecedentes personales de trombosis venosa profunda o embolia pulmonar,mutaciones heredadas predisponentes a trombosis (ej. factor V Leiden, protrombina G20210A), cáncer de mama, endometrio y tumores hormonodependientes, accidente cerebrovascular, infarto agudo de miocardio, enfermedad hepática activa, sangrado vaginal no evaluado, hipersensibilidad a los estrógenos o excipientes. Su uso no se recomienda en mujeres con antecedentes de enfermedades cardiovasculares, en la hipertensión arterial no controlada , en ciertos trastornos de la coagulación y en la litiasis biliar (85)
Tibolona
La tibolona es un esteroide sintético que pertenece al grupo de los reguladores selectivos de la actividad estrogénica tisular (STEAR), con propiedades estrogénicas, androgénicas y progestagénicas. Su efecto estrogénico le confiere la capacidad de reducir la actividad osteoclástica ósea, inhibiendo así la resorción ósea.
En el estudio LIFT (Long Intervention Fracture Trial), que incluyó a 4538 mujeres entre 60 y 85 años con diagnóstico de OP (T-score ≤ –2,5 en cadera o columna, o T- score ≤ –2,0 con FV), se comparó la tibolona (1,25 mg/día/vía oral) frente a placebo. Durante un seguimiento de 34 meses, se observó que el tratamiento con tibolona se asoció a una reducción significativa del riesgo de fracturas vertebrales de 45% y no vertebrales de 26%. Sin embargo, el estudio fue interrumpido de manera anticipada debido a un aumento del riesgo de accidentes cerebrovasculares en el grupo tratado con tibolona (103).
Por otro lado, un metaanálisis que comparó tibolona con placebo evidenció una disminución del riesgo de FV y no vertebrales, sin encontrar diferencias significativas en cuanto a las fracturas de cadera (104).
La tibolona presenta las mismas indicaciones y contraindicaciones a nivel óseo que la THM.
Moduladores selectivos del receptor de estrógeno (SERMs)
Los SERMs carecen de la estructura esteroide del estrógeno, pero pueden actuar como agonistas o antagonistas del receptor de estrógeno en diferentes tejidos. Inicialmente, los SERMs se desarrollaron para prevenir y tratar el cáncer de mama, pero posteriormente se descubrió que conservan la masa ósea (85).
Los SERMs que han sido aprobados por las autoridades regulatorias para la prevención y/o el tratamiento de la OP son el raloxifeno y el bazedoxifeno sólo o en combinación con EEC. Ambas drogas, no están disponibles en la Argentina
El efecto del raloxifeno sobre el riesgo de fractura se evaluó en el estudio MORE (Multiple Outcomes of Raloxifene Evaluation) (105). La dosis de 60mg/vía oral/día demostró que reduce el riesgo de FV, ≈ 30% en mujeres con FV previa y ≈ 55% en aquellas sin FV previa luego de 3 años de tratamiento. Su eficacia en la reducción de fractura de cadera y no vertebrales no ha sido documentada. Reduce el riesgo de cáncer de mama invasor en mujeres posmenopáusicas con OP y no reduce el riesgo de enfermedad coronaria. Aumenta el riesgo de trombosis venosa profunda de manera similar a lo observado con el uso de THM. Puede aumentar los sofocos y producir calambres.La consideración de los riesgos/beneficios extraesqueléticos es importante cuando se indica esta droga (106-109).
En el seguimiento a 4 años, el perfil de seguridad se mantuvo estable (110)
Al suspender el uso de raloxifeno, los beneficios óseos parecen perderse con relativa rapidez durante los siguientes 1 o 2 años.
En pacientes con baja DMO en columna vertebral, pero no en cadera, puede ser una opción inicial aceptable, y puede ser particularmente atractiva en pacientes con alto riesgo de cáncer de mama. También se sugiere su uso en pacientes con alto riesgo de fractura, en el período de descanso de los bisfosfonatos
El bazedoxifeno, 20 mg/día vía oral, demostró que reduce el riesgo de nuevas FV, con efectos favorables sobre la DMO y los BTMs(111). El estudio de fase III se prolongó hasta 7 años (112), durante este período, se mantuvo la eficacia y la seguridad del bazedoxifeno. En un estudio post hoc en un subgrupo de mujeres con mayor riesgo de fractura, el bazedoxifeno redujo el riesgo de fracturas no vertebrales. A diferencia del raloxifeno, la eficacia del bazedoxifeno depende del nivel de riesgo de fractura evaluado mediante FRAX® (113).
El metaanálisis que comparó bazedoxifeno con placebo mostró una reducción significativa del 39% en el riesgo de FV, pero no demostró un efecto significativo en la reducción del riesgo de fracturas de cadera o no vertebrales (104).
La combinación EEC 0,45mg/ bazedoxifeno 20mg, vía oral/día incrementó la DMO de columna 3,6 % luego de 24 meses de seguimiento, en mujeres que se encontraban entre 1 y 5 años después de la menopausia y 3,1 % en mujeres que habían pasado más de 5 años desde la menopausia (114). No se ha demostrado hasta el momento que esta combinación reduce el riesgo de fractura (97).
Las pacientes posmenopáusicas con OP y alto riesgo de fractura, en quienes los bifosfonatos o el denosumab están contraindicados o estén en periodo de descanso, con bajo riesgo de presentar trombosis venosa profunda, pueden ser candidatas a recibir SERMs. Un grupo particularmente beneficiado serían aquellas con alto riesgo de cáncer de mama.
Recomendaciones
- Terapia hormonal menopáusica y tibolona
La THM, incluyendo la tibolona, puede ser indicada en mujeres posmenopáusicas con riesgo de fractura u OP menores de 60 años o dentro de los 10 años de la menopausia. En ausencia de contraindicaciones y particularmente ante la presencia de síntomas vasomotores, se podría considerar a la THM como la droga osteoactiva de primera elección.
La THM reduce el riesgo de fracturas en mujeres posmenopáusicas sanas
La prevención de la pérdida de masa ósea con la THM es dosis dependiente, siendo menor la respuesta densitométrica cuando se utilizan las menores dosis, particularmente en mujeres menores de 40 años.
La THM en baja dosis ni la ultrabaja dosis han demostrado que reducen el riesgo de fractura.
La iniciación de THM después de los 60 años con la indicación de prevención de fractura es considerada una segunda línea terapéutica y requiere el cálculo individual de la relación riesgo/ beneficio, en comparación con las otras drogas aprobadas
Cuando los otros tratamientos están contraindicados o presentan eventos adversos, el uso extendido de la THM es una opción en mujeres con alto riesgo de fractura osteoporótica
La decisión de suprimir la THM debería ser tomada en base a la relación riesgo/beneficio extraesquelético
Cuando el THM es discontinuada, la pérdida ósea puede ser rápida y el uso de otro agente terapéutico debería ser considerado para mantener la DMO
- SERMs
En mujeres posmenopáusicas con OP y alto riesgo de fractura,con bajo riesgo de trombosis, se recomienda raloxifeno o bazedoxifeno para reducir el riesgo de FV y para quienes los bifosfonatos o el denosumab no son apropiados, o con alto riesgo de cáncer de mama.
Bisfosfonatos (BP)
Los BP, por su eficacia, especificidad ósea y escasos efectos colaterales, se han convertido en el tratamiento antirresortivo no hormonal de primera línea para los diferentes tipos de OP.
Se utilizan para el tratamiento de distintas enfermedades osteometabólicas como la enfermedad de Paget, osteogénesis imperfecta, displasia fibrosa, hipercalcemia maligna, metástasis óseas y OP primaria y secundaria.
Los distintos BP son frecuentemente prescritos como equivalentes e incluso suelen ser reemplazados indistintamente en las decisiones terapéuticas, aunque no lo son estrictamente en cuanto a efectividad y seguridad (115).
Su estructura química permite la unión del BP a la superficie ósea mineralizada, seguida de su captación por los osteoclastos durante la resorción. Dentro de estas células, los BP nitrogenados inhiben enzimas claves en la vía del mevalonato (farnesilpirofosfato sintetasa). Los metabolitos intermedios en esta vía son necesarios para la prenilación de proteínas intracelulares que controlan el paso de proteínas regulatorias de la membrana celular. La falta de prenilación lleva a la apoptosis del osteoclasto. Este proceso también ocurre en los precursores osteoclásticos, bloqueando su desarrollo. El orden de potencia de los distintos BP para inhibir la farnesilpirofosfato sintetasa es zoledronato > risedronato > ibandronato > alendronato (116).
Los BP se depositan en la superficie ósea y pueden permanecer por varios años, incorporándose a la matriz. Esta acción prolongada permite su administración intermitente.
Los cuatro BP nitrogenados más utilizados en la práctica clínica difieren en la fuerza de unión al hueso. El orden de afinidad de unión es zoledronato > alendronato > ibandronato > risedronato. Los BP con mayor afinidad se unirán con mayor avidez a la superficie ósea pero la difusión ósea será más lenta y tendrán menos acceso a la red de osteocitos. Los BP de menor afinidad se distribuirán más ampliamente en el hueso y también tendrán un menor tiempo de residencia una vez finalizado el tratamiento. Clínicamente esto podría explicar la diferente velocidad de comienzo del efecto antifractura (117).
Indicaciones clínicas
Las guías actuales recomiendan tratar con terapia farmacológica a las mujeres posmenopáusicas con alto riesgo de fractura, con diagnóstico de OP densitométrica (T-score ≤ –2.5) o con FX previas. Además, si la probabilidad de fractura a 10 años (por FRAX® u otras herramientas) es elevada, se justifica iniciar bisfosfonatos como primera línea (118,119,19,120). En mujeres posmenopáusicas jóvenes con menopausia quirúrgica ‒o supresión ovárica por cáncer de mama‒ se aplican los mismos criterios (121).
Eficacia
La evidencia de estudios clínicos y metaanálisis muestra que los BP reducen significativamente el riesgo de fracturas osteoporóticas (122).
Todos los BP aprobados para OP comparten eficacia antifractura vertebral. Las pruebas de alta calidad indican que alendronato, risedronato y zoledronato reducen tanto FV como no vertebrales (incluyendo cadera) de forma significativa (123).
En términos de efectividad global, no hay diferencias sustanciales en la reducción relativa de fracturas entre alendronato, risedronato y zoledronato cuando se usan adecuadamente (algunos análisis sugieren que zoledronato podría lograr mayor reducción de riesgo en ciertos contextos, pero todos son altamente efectivos) (124).
El ibandronato (vía oral mensual o IV trimestral) reduce el riesgo de FV, pero no ha demostrado reducción significativa de fracturas de cadera o no vertebrales, por lo que no se recomienda como primera elección cuando el riesgo de fractura de cadera es alto.
La Tabla 11 muestra una síntesis de los resultados de los ensayos clínicos aleatorizados y controlados, sobre la DMO en CL, CF y BTMs y el porcentaje de reducción de FV, no vertebrales y de cadera. En el caso del risedronato se toman los valores de los dos estudios VERT (Vertebral Efficacy with
Risedronate Therapy, VERT-North America (VERT-NA) y VERT-Multinational (VERT-MN) (11).
Tabla 11. Resumen de los ensayos clínicos aleatorizados y controlados sobre los distintos parámetros estudiados.
|
Droga |
Zoledronato |
Alendronato |
Risedronato |
Ibandronato |
|
DMO CL |
↑ |
↑ |
↑ |
↑ |
|
DMO CF |
↑ |
↑ |
↑ |
↑ |
|
BTMs |
↓ |
↓ |
↓ |
↓ |
|
FV (%) |
77↓ |
47↓ |
41-49↓ |
50↓ |
|
Fractura Femoral (%) |
41↓ |
50↓ |
40↓ |
↔ |
|
Fractura no Vertebral (%) |
25↓ |
48↓ |
39-33↓ |
↔ |
Un reciente metaanálisis que incluyó 69 estudios controlados aleatorizados y más de 80.000 pacientes demostró que los BP reducen de manera significativa las fracturas clínicas en un 21 % vs placebo (OR 0,79; IC 95 % 0,70–0,89) en mujeres posmenopáusicas, lo que se traduce en 14 fracturas menos por cada 1.000 pacientes tratadas (rango 7–21). Este efecto protector es consistente en todas las localizaciones críticas: disminuyen las FV y las fracturas de cadera. Además, mostró que la magnitud del beneficio aumenta con la edad media de la cohorte, desafiando la idea de que los adultos muy mayores obtienen menor efecto terapéutico. En la metarregresión, el impacto preventivo de los BP se mantuvo independiente de los indicadores clásicos de riesgo basal, lo que respalda su uso amplio en poblaciones de alto riesgo. En conjunto, estos hallazgos consolidan a los BP como pilar de primera línea para la reducción efectiva de fracturas, con especial relevancia en los grupos etarios más avanzados (125).
Un análisis de 2023 (network meta-analysis) confirmó que los BP (así como el denosumab) disminuyen la incidencia de FV (clínicas y radiográficas), de cadera y otras fracturas clínicas en mujeres posmenopáusicas con OP (certeza de la evidencia moderada-alta) (126).
Respecto al tiempo necesario para alcanzar el beneficio, se demostró la reducción de fractura no vertebral en ~12 meses y de cadera en ~20 meses. Se necesitarían 9,9 meses (intervalo de confianza del 95 %: 5.04 a 14,72 meses) de tratamiento con BP para prevenir 1 fractura no vertebral por cada 100 mujeres tratadas y 16-24 meses (intervalo de confianza del 95 %: 8.8 a 23.76 meses) de tratamiento para prevenir 1 fractura de cadera por cada 200 mujeres tratadas (127).
En relación a la recomendación de continuar o iniciar el tratamiento para la OP con BP en pacientes de edad avanzada, se observó que el grupo de ≥80 años no solo se beneficia, sino que podría obtener una protección aún mayor contra las fracturas clínicas en comparación con pacientes más jóvenes.
Duración del tratamiento y “vacaciones” del fármaco
Dado que los BP se acumulan en el hueso y continúan brindando efecto antifractura tras suspenderlos, muchas guías sugieren un tratamiento limitado a 3–5 años, seguido de una reevaluación. Los estudios de extensión (FLEX Study y HORIZON Extension Study) indican que después de 5 años de alendronato o 3 años de zoledronato puede considerarse una pausa terapéutica en pacientes de riesgo bajo a moderado, ya que la protección persiste un tiempo (123).
Las guías de Endocrine Society recomiendan reevaluar el riesgo tras 3–5 años: si el riesgo de fractura sigue alto, continuar con la terapia; si es bajo a moderado, indicar un “drug holiday” (suspensión temporal) de hasta ~2–5 años. La evidencia que sustenta las vacaciones proviene de estudios con alendronato/zoledronato, mostrando que la mayoría no pierde protección ósea inmediata al suspender (128).
Secuencia terapéutica y escalonamiento
Pacientes con riesgo muy alto (fractura múltiple, T-score < −3,0 o FRAX® muy elevado) pueden iniciar con anabólicos; tras 12-24 meses se debe pasar a un BP para “sellar” la ganancia ósea.
Tras denosumab, si se suspende, se debe comenzar con BP para evitar el efecto rebote. Duración recomendada: tratar por 3 a 5 años y luego reevaluar. En pacientes de riesgo bajo a moderado, considerar una “vacación” de BP de ~2–3 años. En pacientes de alto riesgo, no suspender y continuar o cambiar a otra terapia para limitar eventos adversos acumulativos (123).
Efectos adversos
Los BP son seguros en general, con efectos adversos comunes leves (p. ej., síntomas gastrointestinales con vía oral). Sin embargo, con uso prolongado (>3–5 años) se han asociado dos eventos raros pero serios: la fractura femoral atípica (FFA) subtrocantérea o diafisaria, y la osteonecrosis de mandíbula (ONM) (123).
Un metaanálisis de 2023 reportó que tratamientos con una duración de ≥36 meses pueden incrementar el riesgo de FFA y ONM, aunque el riesgo absoluto fue bajo (126). La ONM aparece sobre todo en pacientes oncológicos con dosis altas intravenosas; en OP es muy infrecuente.
Estas consideraciones han llevado a pautar las “vacaciones” terapéuticas mencionadas para mitigar riesgos acumulativos.
Los BP presentan un perfil de seguridad favorable. No obstante, se debe tener precaución con el uso prolongado debido al pequeño riesgo de FFA y ONM (123).
El riesgo absoluto de FFA es mínimo frente a las fracturas evitadas por los BP. Se recomienda una duración inicial de 3-5 años (alendronato/risedronato) o 3 años (zoledronato) antes de reevaluar. Una mayor duración en el uso de BP sigue asociada a un riesgo elevado de FFA, un factor de riesgo independiente para estas fracturas.
Suspensión de fármacos antirresortivos: La recomendación principal es suspender el tratamiento antirresortivo inmediatamente después de que se diagnostica una FFA para reducir el riesgo de progresión de una fractura incompleta y disminuir el riesgo de una segunda fractura en la otra pierna (129,130).
Dosis y vías de administración
En cuanto a vías de administración, los BP orales (70 mg alendronato semanal; 35 mg risedronato semanal/150 mg mensual; 150 mg ibandronato mensual) requieren adherencia estricta y ciertas condiciones de toma, mientras que el zoledronato 5 mg intravenosos anual y el ibandronato 3 mg intravenoso trimestral evitan problemas de adherencia y son útiles en pacientes con intolerancia gastrointestinal o mala adherencia. Guías recientes sugieren elegir la formulación según el paciente: por ejemplo, prefiriendo vía oral en pacientes <75 años sin contraindicaciones gastrointestinales, y vía intravenosa en pacientes de mayor edad o con dificultades para cumplir la pauta oral (123,124).
Contraindicaciones y recomendaciones
Su uso está contraindicado en casos de hipersensibilidad al principio activo o a los excipientes; hipocalcemia; anormalidades esofágicas y otros factores que retrasan el vaciamiento esofágico, como las estenosis o la acalasia, y el esófago de Barrett en las formulaciones orales. También en pacientes que presentan imposibilidad de permanecer en posición sentada erguida o en bipedestación durante al menos 30 minutos.
En relación al filtrado glomerular: los siguientes umbrales de la tasa de filtrado glomerular estimado o del clearance de creatinina, por debajo de los cuales su uso está contraindicado o no se recomienda son los siguientes: alendronato y zoledronato: inferior a 35 ml/min; risedronato e ibandronato inferior a 30 ml/min (131).
Recomendaciones
Los BP, por su eficacia, especificidad ósea y escasos efectos colaterales, se han convertido en el tratamiento antirresortivo no hormonal de primera línea para los diferentes tipos de osteoporosis.
La evidencia de estudios clínicos y metaanálisis muestra que los BP reducen significativamente el riesgo de fracturas osteoporóticas.
Seleccionar vía oral (alendronato, risedronato, ibandronato) o infusión intravenosa (zoledronato, ibandronato) según preferencias, adherencia y función renal.
Reevaluar a los 3-5 años (antes si ocurre nueva fractura), continuar o dar “vacaciones terapéuticas” según riesgo residual.
Denosumab
El denosumab es el primer anticuerpo monoclonal totalmente humano. Se une al RANK-L previniendo la unión con RANK, que es un receptor encontrado en la superficie de los osteoclastos y precursores de los osteoclastos. El receptor señuelo natural es la OPG (osteoprotegerina) y tendría una acción OPG símil. Los osteoclastos producen la resorción ósea y los osteoblastos subsecuentemente forman hueso. Inhibiendo la interacción de RANK y RANK-L se inhibe la formación de los osteoclastos, su función y supervivencia, lo cual disminuye la resorción ósea.
Este esquema fisiológico permitió diseñar sustancias que no se fijen a la matriz ósea, sino que actúen directamente sobre las células óseas, Este primer medicamento biológico, no tiene afinidad por el hueso y no se acumula a nivel óseo. El RANK-L es expresado en los linfocitos y su depuración se produce por el sistema reticuloendotelial. Su efecto pareciera ser exclusivo sobre las células óseas. No se elimina por el riñón, por lo que no produce afectación renal ni se requiere ajuste de dosis en los pacientes con insuficiencia renal.
Dosis y vía de administración
La dosis es de 60 mg, aplicados en forma subcutánea en 1 ml, cada 6 meses.
Eficacia
En el estudio FREEDOM (Fracture REduction Evaluation of Denosumab in Osteoporosis every 6 Months) se demostró la eficacia dada por el incremento continuo de la DMO, la disminución de los BTMs y la reducción del riesgo de FV en un 68%, fractura de cadera en un 40% y fracturas no vertebrales en un 20%. El incremento de la DMO es mayoritariamente a expensas del hueso cortical (cadera) y la suspensión lleva al cese de su acción. (132)
Los estudios de 10 años de tratamiento con denosumab, demostraron una persistente protección antifractura y un buen perfil de seguridad. La ganancia continua en la DMO, diferencia al denosumab de los BP, ya que generalmente se observa una meseta en la DMO de cadera, luego de 3- 4 años de tratamiento.
A pesar de la edad de la población estudiada, la tasa de fractura no vertebral a los 4-10 años de tratamiento con denosumab fue menor que la observada, con 3 años de tratamiento.
El cambio de BP a denosumab resulta en una ganancia adicional en la DMO (133,134).
Eventos adversos y contraindicaciones
No produce lesiones en el tracto digestivo. No se ha descrito que produzca fibrilación auricular ni síndrome gripal símil. No se registró la presencia de anticuerpos neutralizantes en los estudios clínicos. No hubo diferencias en las reacciones observadas en la zona de la inyección en comparación con la inyección de placebo. Se le adjudica un muy bajo potencial de interacciones farmacológicas.
Está contraindicado en pacientes con hipocalcemia. En el estudio FREEDOM hubo un disbalance en algunos eventos adversos de baja frecuencia como rash, celulitis o eventos adversos serios relacionados con infección que no parecerían tener una relación causal con el denosumab y que no se observaron en los tratamientos prolongados ni con dosis mayores (135). Al igual que los bisfosfonatos, ha sido asociado con raros casos de FFA y ONM.
Duración de tratamiento
Cuando el tratamiento con denosumab es suspendido la DMO disminuye rápidamente y los BTMs aumentan a valores superiores a los valores basales pre-tratamiento. Se han reportado casos de múltiples FV post suspensión de tratamiento. Las “vacaciones” con denosumab no están recomendadas por este potencial aumento del riesgo de fractura. Si el tratamiento es discontinuado, se debería continuar con otra terapia antirresortiva alternativa como el ácido zoledrónico o el alendronato (136,137).
Recomendación
El denosumab es una potente droga antirresortiva, indicada para el tratamiento de la OP, con estudios clínicos de hasta 10 años de seguimiento, en donde se demostró la seguridad y eficacia en la reducción del riesgo de fractura. La ganancia continua en la DMO, lo diferencia de otras drogas.
La inhibición prolongada de los BMTs hasta 10 años con el tratamiento con denosumab, demostró un perfil beneficio/riesgo favorable cuando se compara las fracturas prevenidas en relación con los eventos adversos esqueléticos (ONM y FFA) observados. Además, la incidencia de eventos adversos, incluyendo infecciones y cáncer permanece baja a lo largo del tiempo de estudio en la población añosa.
Si el tratamiento con denosumab es discontinuado, la transición a otra clase de medicación antiosteoporótica como los BP, puede ayudar a prevenir la pérdida completa de la ganancia densitométrica producida por el denosumab y mantener la eficacia antifractura.
Terapias anabólicas
Las drogas anabólicas u osteoformadoras son agentes terapéuticos que estimulan directamente la formación ósea mediante la activación de la función de los osteoblastos, promoviendo el incremento de la masa ósea, la mejoría de la microarquitectura del tejido óseo y la reducción del riesgo de fracturas. A diferencia de los tratamientos antirresortivos, que disminuyen la resorción ósea, las drogas anabólicas inducen un balance óseo positivo al favorecer la neogénesis ósea (128,137). Representan una categoría esencial en el arsenal terapéutico de la OP severa, especialmente en pacientes con alto y muy alto riesgo de fractura o antecedentes de FX. El abordaje anabólico debería considerarse prioritario en casos de muy alto riesgo de fractura, particularmente en mujeres posmenopáusicas con múltiples fracturas vertebrales o fractura reciente (19,137).
Actualmente, los agentes anabólicos aprobados y disponibles en distintos países incluyen:
- Terapias con PTH o PTHrP:
- Teriparatida (PTH 1–34) (TPTD)
- Abaloparatida (análoga de la PTHrP, no disponible en Argentina)
- Antiesclerostina:
- Romosozumab, anticuerpo monoclonal que inhibe la esclerostina y combina efectos anabólicos y antirresortivos secuenciales (138)
Los efectos de estas drogas no son permanentes, por lo que se recomienda su uso por tiempo limitado (generalmente entre 12 y 24 meses), seguido por la secuencia con un agente antirresortivo para consolidar las ganancias en masa ósea y mantener la reducción del riesgo de fractura (128,137).
El enfoque terapéutico actual enfatiza una estrategia secuencial o combinada, donde el inicio del tratamiento con agentes anabólicos en pacientes seleccionados demuestra una mayor eficacia en la prevención de fracturas clínicas, en comparación con el inicio con antirresortivos. Este concepto ha sido respaldado por múltiples guías, incluyendo, las de la Endocrine Society (128) , ESCEO (European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases) / IOF (International Osteoporosis Foundation) (139) y NOF (National Osteoporosis Foundation, actualmente conocida como Bone Health & Osteoporosis Foundation, BHOF) (140).
Teriparatida (TPTD)
La producción endógena continua de PTH, observada en el hiperparatiroidismo primario o secundario, o su administración exógena, pueden tener consecuencias perjudiciales para el esqueleto, especialmente en el hueso cortical. Sin embargo, la administración intermitente de PTH (p. ej., mediante inyecciones subcutáneas diarias) produce un aumento del número y la actividad de los osteoblastos, lo que conlleva un aumento de la masa ósea y una mejoría de la arquitectura esquelética, tanto en el esqueleto esponjoso como en el cortical (19).
El fragmento N-terminal 1-34 (TPTD) se utiliza para el tratamiento de la OP. Se ha demostrado que el tratamiento con TPDP reduce significativamente el riesgo de FV y no vertebrales. No existe evidencia convincente de que la TPTD reduzca la fractura de cadera, pero esto podría reflejar la ausencia de evidencia. Por lo tanto, la recomendación para su uso en personas de alto riesgo es particularmente firme en pacientes con FV (19).
Indicaciones clínicas
Es un fármaco de primera elección en mujeres con alto riesgo de fracturas osteoporóticas, incluyendo antecedentes de FV clínicas o radiológicas, otras FX asociadas a valores densitométricos dentro del rango de OP o muy baja DMO (T-score < -3) sin antecedentes de fracturas, en particular en pacientes mayores de 65 años (19-141).
También podría indicarse en quienes hayan recibido fármacos antirresortivos con una respuesta subóptima o fracaso a la terapia antirresortiva (por ejemplo, BP), por haber presentado FX o pérdida ósea importante durante el tratamiento. Pacientes con contraindicaciones o intolerancia a antiresortivos. (19-141).
Eficacia
Reduce significativamente el riesgo de FV (65%) y no vertebral (53%) (142). Aumenta la DMO lumbar hasta un 9-13% en 18-24 meses. El mayor efecto se observa en el hueso trabecular (columna y pelvis).
Contraindicaciones
La TPTD está contraindicada en (19-141) embarazo y lactancia; hipersensibilidad al fármaco o excipientes; hipercalcemia preexistente; insuficiencia renal grave o severa; enfermedades óseas metabólicas distintas de la OP primaria o inducida por glucocorticoides (ej. hiperparatiroidismo primario, enfermedad de Paget).
Se excluye su uso en pacientes con antecedentes de radioterapia ósea o tumores óseos malignos primarios o metastásicos y mieloma múltiple.
Otras contraindicaciones incluyen elevaciones inexplicadas de fosfatasa alcalina. En mujeres en edad fértil se deben usar métodos anticonceptivos durante el tratamiento. En pacientes con insuficiencia renal moderada se recomienda precaución.
Dosis y vía de administración
La dosis aprobada es 20 μg diarios, administrados mediante inyección subcutánea (en muslo o abdomen). Se utiliza una jeringa precargada, se instruye a la paciente en la técnica de autoinyección correcta. El tratamiento siempre debe acompañarse de suplementos de calcio y vitamina D (Ej. 1200 mg/día de calcio total más 800–1000 UI/día de vitamina D) en caso de aporte dietético insuficiente.
Duración del tratamiento
La duración recomendada no debe exceder 24 meses. Estudios en ratas mostraron una mayor incidencia de osteosarcoma con la administración a largo plazo de dosis muy altas de TPTD. No se observaron osteosarcomas en monos a altas dosis TPTD, ni en humanos, pero no se debe repetir un segundo ciclo completo en la vida del paciente (128,129,141,143).
Terapia secuencial al suspender
Tras completar los 18 - 24 meses de tratamiento con TPTD, es esencial continuar con una terapia antirresortiva (por ejemplo, BP o denosumab) para consolidar las ganancias de masa ósea alcanzadas de modo que la DMO se mantenga (141,142,143).
Los pacientes que son candidatos a terapia anabólica se tratan con frecuencia previamente con agentes antirresortivos y aquellos con actividad inhibitoria significativa sobre el recambio óseo, atenúan la respuesta a TPTD en DMO.
(143). Debido a estas razones, es preferible administrar TPTD antes que la terapia antirresortiva, aunque a menudo se prescribe después de no lograr una respuesta terapéutica óptima con un agente antirresortivo.
Efectos adversos frecuentes y relevantes
Las reacciones adversas más comunes son náuseas, dolor en extremidades inferiores, cefalea y mareos. Otros eventos frecuentes incluyen fatiga, vértigo y calambres musculares. Se han observado ocasionalmente palpitaciones e hipotensión ortostática transitoria (suele presentarse dentro de las primeras horas tras la inyección y remite espontáneamente). En el sitio de inyección son habituales reacciones locales leves como dolor, eritema, hinchazón o hematoma. Clínicamente es importante saber que la teriparatida produce un aumento temporal del calcio sérico post dosis (máximo a las 4–6 hs, regresando a valores basales a las 16–24 hs). Esta hipercalcemia transitoria se da en un 3-10 %; hipercalciuria/24 hs leve: sin mayor incidencia de litiasis. (141,143).
Abaloparatida
La abaloparatida es un péptido sintético de 34 aminoácidos, análogo de la proteína relacionada con la hormona paratiroidea (PTHrP: ParaThyroid Hormone-related Peptide), caracterizada por ser un activador selectivo del receptor de la hormona paratiroidea. Aprobada para el tratamiento de mujeres posmenopáusicas con OP con alto riesgo de fractura en muchos países, como
- UU., Japón y la Unión Europea. No disponible en Argentina (143).
Indicaciones Clínicas
Pacientes con antecedentes de fractura osteoporótica o múltiples factores de riesgo, o que han fracasado/intolerantes a otras terapias (128).
Se recomienda considerar terapias anabólicas (TPTD o abaloparatida) en pacientes de muy alto riesgo, por ejemplo, con fracturas vertebrales previas repetidas o DMO muy baja. (128).
Eficacia
El estudio pivotal ACTIVE (Abaloparatide Comparator Trial in Vertebral Endpoints) demostró una reducción del 86% en FV y del 43% en fractura no vertebral vs placebo. También se observó mayor ganancia densitométrica que con TPTD en CF y CT (144).
Contraindicaciones
Se debe evitar en pacientes con predisposición al osteosarcoma (enfermedad de Paget, metástasis óseas, radioterapia ósea previa, etc.). Tampoco se recomienda en hipercalcemia o hiperparatiroidismo primario por riesgo de agravar el cuadro. Precaución: no usar acumulativamente más de 2 años y valorar riesgo en insuficiencia renal severa. En mujeres en edad fértil, no está indicado (no hay datos en gestación / lactancia).
Dosis y vía de administración
La dosis recomendada es 80 µg al día por vía subcutánea (autoinyector). Se inyecta diariamente en la zona abdominal. Se aconseja suplementar con calcio y vitamina D si la dieta es insuficiente.
Duración del tratamiento
Los ensayos controlados tienen una duración de 18 meses de tratamiento con abaloparatida. Las guías advierten no exceder los 2 años acumulados en la vida de la paciente. Esto se debe al potencial riesgo de osteosarcoma con el uso prolongado, observado en ratas. En la práctica clínica se suele limitar a 18–24 meses y tras la suspensión se debe continuar con tratamiento antirresortivo.
Efectos adversos frecuentes y clínicamente relevantes
Los más frecuentes (≥2%) son: náuseas, cefalea, mareos, palpitaciones/ taquicardia y fatiga, junto con hipercalciuria (20%) (143). Otros eventos comunes son las reacciones en el sitio de inyección: eritema, edema, dolor leve hasta 10–58%. Aunque poco frecuente, se han asociado a aumentos transitorios de la calcemia (hipercalcemia leve en 3% vs 0,1% con placebo). En general, el perfil de seguridad es comparable al de TPTD, con menor incidencia de hipercalcemia. Sin embargo, en todos los casos se deben monitorear calcemia y síntomas cardiovasculares (mareos, palpitaciones) al iniciar tratamiento y reponer calcio/vitamina D.
Terapia secuencial al suspender
Tras finalizar el ciclo anabólico con abaloparatida, se recomienda iniciar inmediatamente un agente antirresortivo para mantener las ganancias de densidad ósea. Las guías señalan que debe administrarse un BP oral (p. ej. alendronato) o intravenoso (ácido zoledrónico) o bien denosumab. Estudios han demostrado que la secuencia anabólico - bifosfonato conserva o incluso mejora la DMO lograda y estabiliza o reduce el riesgo de nuevas fracturas.
(145). Por lo tanto, se aconseja no dejar “vacío terapéutico”: al concluir los 18–24 meses de abaloparatida, iniciar alendronato (70 mg/semana) o similar, o continuar con denosumab cada 6 meses. Esta estrategia secuencial (anabólico seguido de antirresortivo) maximiza el beneficio a largo plazo en la prevención de fracturas.
Romosozumab
El Romosozumab es un anticuerpo monoclonal humano IgG2 dirigido contra la esclerostina, anticuerpo anti-esclerostina, con un efecto dual en el hueso: anabólico/antirresortivo: estimula intensamente la formación ósea e inhibe simultáneamente la resorción (124).
Indicaciones Clínicas
OP posmenopáusica severa en mujeres con muy alto riesgo de fractura. Se reserva para casos graves como fracturas múltiples o recidivantes, escasa mejoría con otros tratamientos. Se recomienda en OP severa (T-score ≤ –2,5 con fractura previa) o múltiples FV (128).
Otras indicaciones incluyen antecedentes de fracturas osteoporóticas, múltiples factores de riesgo de fractura o fracaso/intolerancia a otras terapias anti osteoporóticas.
Eficacia
En el estudio FRAME (Fracture Study in Postmenopausal Women with Osteoporosis) se observó una reducción del 73% en FV en 12 meses de tratamiento (146) y en el estudio ARCH (Active-Controlled Fracture Study in Postmenopausal Women with Osteoporosis at High Risk of Fracture): romosozumab seguido de alendronato, se observó una reducción del riesgo de FV (48%), no vertebral (19%) y de cadera (38%) en comparación al alendronato sólo (147).
Contraindicaciones
Hipocalcemia no corregida; hipersensibilidad al fármaco. Tiene advertencia de riesgo cardiovascular. Contraindicación absoluta: pacientes con infarto de miocardio o accidente cerebrovascular recientes. Embarazo/lactancia. Precauciones: debe considerarse cuidadosamente en pacientes con varios factores de riesgo cardiovascular (enfermedad vascular establecida, hipertensión no controlada, diabetes, tabaquismo) (128-124).
Se aconseja corregir antes la hipocalcemia administrando suplementos adecuados de calcio y vitamina D.
La insuficiencia renal grave (depuración <30ml/min) aumenta el riesgo de hipocalcemia, por lo que requiere monitorización de calcio sérico.
Dosis y vía de administración
La dosis recomendada es 210 mg una vez al mes, administrada por vía subcutánea en consultorio. Se aplica en dos inyecciones separadas de 105 mg cada una, en abdomen, muslo o brazo.
Duración del tratamiento
La terapia con romosozumab se limita a 12 meses. La eficacia anabólica máxima se alcanza al año, y más allá de ese tiempo el efecto formativo disminuye (128,124). Las guías especifican claramente “un año de tratamiento” para lograr reducción de FV, de cadera y no vertebrales.
Tras 12 meses de uso se debe suspender romosozumab y proseguir con terapia antirresortiva (como denosumab o BP) para mantener las ganancias de DMO.
Efectos adversos frecuentes y clínicamente relevantes
Similar a denosumab, causa transitorio descenso de la calcemia (recomendar suplemento de calcio+vitamina D). En los ensayos pivotales se observó mayor incidencia de eventos isquémicos cardíacos y cerebrales en el grupo de romosozumab vs alendronato (ARCH) (147); no se detectaron estos eventos en el ensayo FRAME (146). Otras posibles complicaciones, más raras: ONM y FFA han sido reportadas esporádicamente. En general, durante la inyección no se observan efectos inmediatos importantes, y el perfil de seguridad es aceptable bajo monitoreo. Los efectos adversos más señalados en las guías son dolor articular, cefalea, nasofaringitis e irritación local.
Hipocalcemia: se observa ocasionalmente (0,4%) y suele ser transitoria.
Terapia secuencial tras la suspensión
Dado que el efecto formativo de romosozumab declina tras un año, las guías recomiendan continuar con un antirresortivo al finalizar el ciclo de 12 meses. (128,143)
Por ejemplo, los estudios clínicos alternan romosozumab con denosumab o bisfosfonatos: en el estudio FRAME todas las pacientes pasaron a denosumab tras 12 meses, manteniendo la protección (146). En el estudio ARCH, las pacientes recibieron alendronato luego de romosozumab, reduciendo significativamente las fracturas a los 24 meses. (147)
En la práctica, tras completar romosozumab se inicia un antirresortivo (como denosumab cada 6 meses o un BP oral/intravenosos para preservar la ganancia de densidad ósea adquirida.
Fracaso terapéutico
La definición de fracaso terapéutico en el tratamiento de la OP es un tema complejo, no existiendo criterios establecidos. Los consensos de expertos aconsejan sobre la conveniencia de asegurar que la adherencia al tratamiento sea correcta, confirmar un aporte adecuado de calcio y vitamina D y excluir causas de OP secundaria. Por lo que respecta a fallo al tratamiento, después de un año de tratamiento con algún fármaco antiosteoporótico, un grupo de expertos internacionales propone los siguientes criterios de valoración de cambio de tratamiento (148):
- Incidencia de dos o más FX durante el
- Incidencia de una FX junto con uno de los siguientes factores: pérdida significativa de DMO (> 5% en columna lumbar o > 4% en fémur proximal); ausencia de cambios significativos en los BMTs (disminución de P1NP o β-CTX-I: < 25% con el tratamiento antirresortivo; o incremento < 25% con el tratamiento osteoformador, a los 6 meses).
- Ausencia de cambios significativos en los BTMs junto con una pérdida significativa de DMO.
Algoritmos de tratamiento
Existen numerosas guías y consensos que abordan el manejo de la OP posmenopáusica (6,18,65,75,91,95,139). En los últimos años las estrategias terapéuticas se han modificado con la incorporación del concepto de riesgo inminente de fractura y la de estratificación de riesgo. La temprana intervención luego de una fractura incidente, con agentes que hayan demostrado el más rápido efecto en la reducción del riesgo de fractura es mandatoria. A continuación, se grafican algunos algoritmos.
Algoritmo para el manejo de pacientes con bajo, alto y muy alto riesgo de fractura (18).
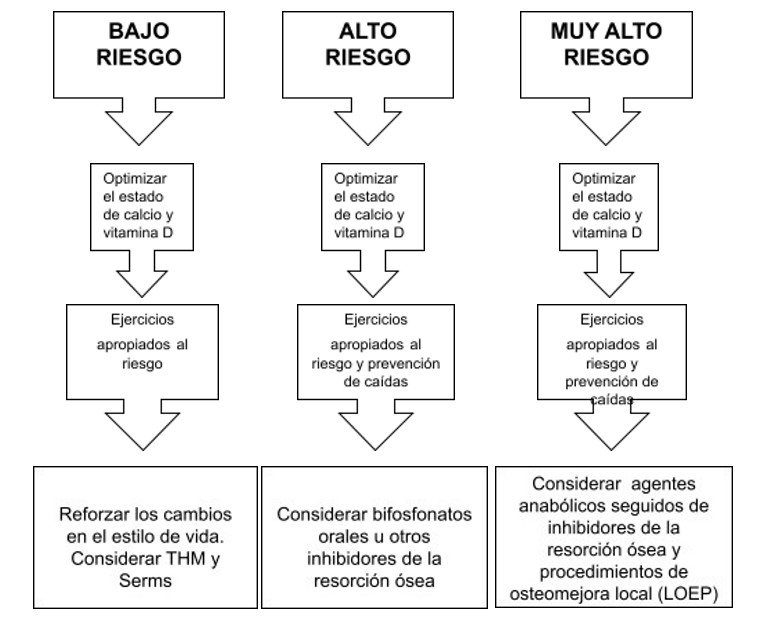
Algoritmo de tratamiento de la osteoporosis posmenopáusica AACE (American Association of Clinical Endocrinology)/ ACE (American College of Endocrinology) 2020 (6)
|
T-score ≤-2.5 CL, CF, CT, historia de FX, o FRAX con alta probabilidad de fractura. (Riesgo a 10 años de fractura osteoporótica mayor ≥ 20% o fractura de cadera ≥ 3%) ↓↓ |
|
Evaluar causas secundarias de OP ↓↓ |
|
Corregir deficiencias de calcio y vitamina D y focalizar causas de OP secundaria ↓↓ |
|
Recomendar terapia farmacológica Educación en estilo de vida, prevención de caídas, y en riesgos y beneficios de la medicación. |
|
Alto riesgo/ Sin fracturas previas * |
|
|
Alendronato, Denosumab, Risedronato, Zoledronato** Terapia alternativa: ibandronato, raloxifeno ↓↓ |
|
|
Reevaluar anualmente la respuesta al tratamiento y el riesgo de fractura
↓↓ ↓↓ |
|
|
Mejoría o estabilidad de la DMO y sin fracturas ↓↓ |
Progresión de la pérdida ósea o fracturas recurrentes ↓↓ |
|
Considerar la suspensión luego de 5 años de tratamiento con BP oral o 3 años de BP intravenosos
↓↓ |
Evaluar la adherencia al tratamiento Reevaluar las causas de OP secundaria y factores que conduzcan a una respuesta subóptima al tratamiento ↓↓ |
|
Reiniciar el tratamiento cuando ocurre una fractura, la DMO disminuye por debajo del MCS, los BTMs aumentan a valores pretratamiento o el paciente reúne los criterios de tratamiento iniciales. |
Rotar a un antirresortivo inyectable si estaba bajo tratamiento oral. Rotar a Abaloparatide, Romosozumab o Teriparatida si estaba en tratamiento con un antirresortivo inyectable o está en muy alto riesgo de fractura. Factores que conducen a una respuesta subóptima. |
*Indicadores de muy alto riesgo de fractura en pacientes con baja DMO incluiría: edad avanzada, fragilidad, glucocorticoides, T-score muy bajo o aumento del riesgo de caídas.
** La medicaciones se enumeran por orden alfabético
|
Muy alto riesgo de fracturas/ fracturas previas* |
|||
|
Abaloparatide, denosumab, romosozumab, teriparatide, zoledronato** Terapia alternativa: alendronate, risedronato ↓↓ |
|||
|
Revaluación anual de la respuesta al tratamiento y el riesgo de fractura ↓↓ ↓↓ ↓↓ ↓↓ |
|||
|
Denosumab
↓↓ |
Romosozumab por 1 año ↓↓ |
Abaloparatide o Teriparatide hasta 2 años ↓↓ |
Zoledronato
↓↓ |
|
Continuar el tratamiento hasta que el paciente no se encuentre en alto riesgo y asegurar la transición con otra droga antirresortiva |
Tratamiento secuencial con droga antirresortiva oral o inyectable |
Tratamiento secuencial con droga antirresortiva oral o inyectable |
Si está estable, continuar la terapia por 6 años.*** Si progresa con pérdida ósea o fractura recurrente considerar rotar a Abaloparatide, Teriparatide o Romosozumab |
*Indicadores de muy alto riesgo de fractura en pacientes con baja DMO incluiría: edad avanzada, fragilidad, glucocorticoides, T-score muy bajo o aumento del riesgo de caídas** La medicaciones se enumeran por orden alfabético*** Considerar unas vacaciones de tratamiento luego de 6 años de zoledronato IV. Durante las vacaciones, una droga anabólico o un antirresortivo débil como el raloxifeno podría ser indicado


Bibliografía
- World Health Organization Scientific Group on Research on the Menopause in the 1990s. Research on the menopause in the 1990s. Geneva: WHO; 1996. p. 24–32. (WHO Technical Report Series; no. 866).
- Bagur A, Oliveri B, Mautalen C, Belotti M, Mastaglia S, Yankelevich D, et Low levels of endogenous estradiol protect bone mineral density in young postmenopausal women. Climacteric. 2004;7(2):181–8.
- Heaney R. Pathogenesis of postmenopausal osteoporosis. In: Favus MJ, Primer on the metabolic bone diseases and disorders of mineral metabolism. 3rd ed. New York: Lippincott-Raven; 1996. p. 249–51.
- Tannenbaum C, Clark J, Schwartzman K, Wallenstein S, Lapinski R, Meier D, et al. Yield of laboratory testing to identify secondary contributors to osteoporosis in otherwise healthy women. J Clin Endocrinol Metab. 2002;87(10):4431–7.
- Moggia M S, Sayegh F, Fiasché R, Macías G, Bettini N, Man Z. Importancia de la evaluación bioquímica mínima del metabolismo fosfocálcico de la paciente con baja masa ósea. 5° Congreso Argentino de Climaterio, AAPEC. Libro de resúmenes, 2002;p. 86.
- Camacho PM, Petak SM, Binkley N, Diab DL, Eldeiry LS, Farooki A, et al. American Association of Clinical Endocrinologists/American College of Endocrinology Clinical Practice Guidelines for the Diagnosis and Treatment of Postmenopausal Osteoporosis—2020 update. Endocr Pract. 2020;26(Suppl 1):1–46.
- Spivacow R, Sánchez A. Epidemiology, costs and burden of osteoporosis in Argentina, 2009. Latin America Regional Audit – IOF; 2012. Disponible en: https://www.osteoporosis.foundation/sites/iofbonehealth/files/2020-06/2012_Latin_Amer pdf
- Claus-Hermberg H, Lozano Bullrich MP, Ilera V, Malter Terrada J, Pozzo Incidencia de fractura de cadera en mujeres afiliadas al plan médico del Hospital Alemán, Buenos Aires. Actual Osteol. 2008;4:57–62.
- Beratarrechea A, Diehl M, Saimovici J, Pace N, Trossero A, Plantalech Mortalidad a largo plazo y factores predictores en pacientes con fractura de cadera. Actual Osteol. 2011;7:9–18.
- Wittich A, Bagur A, Mautalen C, Oliveri B, Somoza J, et Epidemiology of hip fracture in Tucumán, Argentina. Osteoporos Int. 2010;21(11):1803–7.
- Schurman L, Bagur A, Claus-Hermberg H, Messina O, Negri A, Sánchez A,González C, Diehl M, Rey P, Gamba J, Chiarpenello J, Moggia MS, Mastaglia Guías 2012 para el diagnóstico, la prevención y el tratamiento de la osteoporosis.Medicina (B Aires) 73: 55-74, 2013
- Garabano G, Cubecino A, Simesen de Bielke H, Robador N, Olivetto JM, Sierto M, Gamarra D. Epidemiology of hip fractures in Argentina. Rev Asoc Argent Ortop 2020;85(4):437–446. https://doi.org/10.15417/issn.1852-7434.2020.85.4.1113
- Clark P, Cons-Molina F, Delezé M, Ragi S, Haddock L, Pérez CM, et The prevalence of vertebral deformity in Latin-American countries: the Latin-American Vertebral Osteoporosis Study (LAVOS). Osteoporos Int. 2009;20(2):275–82.
- NIH Consensus Development Panel. Osteoporosis Prevention, Diagnosis and JAMA. 2001, 285 (6): 785-795
- Painter SE, Kleerekoper M, Camacho PM. Secondary osteoporosis: a review of the recent evidence. Endocr Pract. 2006; 12:436–445.
- Emkey GR, Epstein S. Secondary osteoporosis: Pathophysiology & diagnosis. Best Practice & Research Clinical Endocrinology & Metabolism 28 (2014) 911-935.
- Hofbauer LC, Hamann C, Ebeling PR.. Approach to the patient with secondary osteoporosis. European Journal of Endocrinology 2010 ;162: 1009–1020
- Kanis JA, Harvey NC, Johansson H, Odén A, McCloskey EV. Algorithm for the management of patients at low, high and very high risk of osteoporotic fractures. Osteoporos Int. 2020;31(1):1–12.
- Kanis JA, Cooper C, Rizzoli R, Reginster JY. European guidance for the diagnosis and management of osteoporosis in postmenopausal women. Osteoporos Int. 2019;30(1):3–44.
- Gregson CL, Armstrong DJ, Bowden J, Cooper C, Edwards J, Gittoes N, et al. UK clinical guideline for the prevention and treatment of osteoporosis. Arch Osteoporos. 2022;17:58. doi:10.1007/s11657-022-01061-5.
- Shoback D, Rosen CJ, Black DM, Cheung AM, Murad MH, Eastell Pharmacological management of osteoporosis in postmenopausal women: an Endocrine Society guideline update. J Clin Endocrinol Metab. 2020;105(3):587–94. doi:10.1210/clinem/dgaa048.
- Blake GM, Fogelman I. Technical principles of dual energy X ray Semin Nucl Med. 1997;27(3):210–228.
- Ross PD, Davis JW, Epstein RS, Wasnich Body size accounts for most differences in bone density between Asian and Caucasian women. The EPIC (Early Postmenopausal Interventional Cohort) Study Group. Calcif Tissue Int. 1996;59(5):339–343.
- Kanis JA, Melton LJ 3rd, Christiansen C, Johnston CC, Khaltaev N. The diagnosis of osteoporosis. J Bone Miner Res. 1994;9:1137–1141.
- Hoiberg MP, Rubin KH, Hermann AP, Brixen K, Abrahamsen B. Diagnostic devices for osteoporosis in the general population: A systematic review. 2016;92:58–69.
- Krueger D, Tanner SB, Szalat A, Malabanan A, Prout T, Lau A, Rosen HN, Shuhart DXA reporting updates: 2023 official positions of the International Society for Clinical Densitometry. J Clin Densitom. 2024;27(1):101437. doi:10.1016/j.jocd.2023.101437.
- Kanis JA, Borgstrom F, De Laet C, Johansson H, Johnell O, Jonsson B, Oden A, Zethraeus N, Pfleger B, Khaltaev N. Assessment of fracture risk. Osteoporos Int. 2005;16:581–589.
- Marques A, Ferreira RJ, Santos E, Loza E, Carmona L, da Silva JA. The accuracy of osteoporotic fracture risk prediction tools: a systematic review and meta-analysis. Ann Rheum Dis. 2015;74:1958–1967.
- Kanis JA, Hans D, Cooper C, Oden A, Papapoulos SE, Poiana C, Rizzoli R, Wahl DA, McCloskey EV; Task Force of the FRAX Initiative. Interpretation and use of FRAX in clinical practice. Osteoporos Int. 2011;22:2395–2411.
- Shuhart C. Shepherd J, Sim Yeap S y cols Executive Summary of the 2019 ISCD Position Development Conference on Monitoring Treatment, DXA Cross-calibration and Least Significant Change, Spinal Cord Injury, Peri-prosthetic and Orthopedic Bone Health, Transgender Medicine, and Pediatric.J Clin Densitom . 2019;22(4):453-471
- Genant HK, Wu CY, van Kuijk C, Nevitt MC. Vertebral fracture assessment using a semiquantitative technique. J Bone Miner Res 1993;8(9):1137–1148.
- Guclielmi G, Muscarella S., Bazzocchi A. Integrated imaging approach to osteoporosis: State of the art review and update.Radioggraphics 2011; 31: 1343-1364
- Panchagnula, R., & Amarnath, S. S. (2023). Osteoporosis: Investigations and monitoring. Indian Journal of Orthopaedics, 57(Suppl 1), 70–81. https://doi.org/10.1007/s43465-023-01019-w
- Laborde M, Schonfeld M, Lapides L, Suárez M, Lemma A, Rossi P, Aurea J, Assano M, Aparicio M, García L, Salerni H. Importancia del diagnóstico diferencial en RAEM 2001; 38(supl).
- Brunetti, A., Cellini, M., Vitale, V., Gentile, L. M. S., Birtolo, M. , Vescini, F., Lania, A. G., & Mazziotti, G. (2025). A practical use of bone turnover markers in management of patients with skeletal fragility. Endocrine. Advance online publication. https://doi.org/10.1007/s12020-025-04275-y
- Day, A. L., Morgan, S. L., & Saag, K. G. (2018). Hypophosphatemia in the setting of metabolic bone disease: Case reports and diagnostic Therapeutic Advances in Musculoskeletal Disease, 10(7), 151–156. https://doi.org/10.1177/1759720X18772345
- Kidney Disease: Improving Global Outcomes (KDIGO) CKD-MBD Update Work (2017). KDIGO 2017 clinical practice guideline update for the diagnosis, evaluation, prevention, and treatment of chronic kidney disease–mineral and bone disorder (CKD-MBD). Kidney International Supplements, 7(1), 1–59. https://doi.org/10.1016/j.kisu.2017.04.001
- Altınsoy, K. E., & Unat, B. (2024). The role of bone turnover markers in diagnosis, monitoring, and pathological fractures of osteoporosis. Ulusal Travma ve Acil Cerrahi Dergisi, 30(5), 323–327. https://doi.org/10.14744/tjtes.2024.48409
- Bilezikian, J. P., Khan, A. A., Silverberg, S. J., Fuleihan, G. E., Marcocci, C., Minisola, S., Perrier, N., Sitges-Serra, A., Thakker, R. V., Guyatt, G., Mannstadt, M., Potts, J. , Clarke, B. L., Brandi, M. L., & International Workshop on Primary Hyperparathyroidism. (2022). Evaluation and management of primary hyperparathyroidism: Summary statement and guidelines from the Fifth International Workshop. Journal of Bone and Mineral Research, 37(11), 2293– 2314. https://doi.org/10.1002/jbmr.4677
- Giustina, A., Bilezikian, J. P., Adler, R. A., Banfi, G., Bikle, D. D., Binkley, N. C., Bollerslev, J., Bouillon, R., Brandi, M. L., Casanueva, F. F., di Filippo, L., Donini, M., Ebeling, P. R., Fuleihan, G. E., Fassio, A., et al. (2024). Consensus statement on vitamin D status assessment and supplementation: Whys, whens, and hows. Endocrine Reviews, 45(5), 625–654. https://doi.org/10.1210/endrev/bnae009
- Bhattoa, H. P., Vasikaran, S., Trifonidi, , Kapoula, G., Lombardi, G., Jørgensen, N. R., Pikner, R., Miura, M., Chapurlat, R., Hiligsmann, M., Haarhaus, M., Evenepoel, P., Jørgensen, H. S., Herrmann, M., Kaufman, J. M., et al. (2025). Update on the role of bone turnover markers in the diagnosis and management of osteoporosis: A consensus paper from ESCEO, IOF and IFCC. Osteoporosis International, 36(4), 579–608. https://doi.org/10.1007/s00198-025-07422-3
- Russo CR. The effects of exercise on bone: basic concepts and implications for the prevention of fractures. Clin Cases Miner Bone Metab. 2009;6(3):223–228.
- Beaudart C, Alcazar J, Aprahamian I, Batsis JA, Yamada Y, Prado CM, et al. Health outcomes of sarcopenia: a consensus report by the outcome working group of the Global Leadership Initiative in Sarcopenia (GLIS). Aging Clin Exp Res. 2025;37:100.
- Beaudart C, Dawson A, Shaw SC, Harvey NC, Kanis JA, Binkley N, et Nutrition and physical activity in the prevention and treatment of sarcopenia: systematic review. Osteoporos Int. 2017;28:1817–1833.
- National Institute of Arthritis and Musculoskeletal and Skin Diseases (NIAMS). Exercise for your bone health [Internet]. Bethesda (MD): NIH; 2023 May [citado el 3 ago 2025]. Disponible en: https://www.niams.nih.gov/
- World Health Organization (WHO). Step safely: strategies for preventing and managing falls across the life-course. Geneva: World Health Organization; Licence: CC BY-NC-SA 3.0 IGO.
- Cruz-Jentoft AJ, Bahat G, Bauer J, Boirie Y, Bruyère O, Cederholm T, et Sarcopenia: revised European consensus on definition and diagnosis. Age Ageing. 2019;48(1):16–31.
- Mastaglia S. Osteosarcopenia: un factor de riesgo para fracturas osteoporóticas. Acta Bioquím Clín Latinoam. 2016;50(3):357–365.
- Dent E, Morley JE, Cruz-Jentoft AJ, Arai H, Kritchevsky SB, Guralnik J, et al. International clinical practice guidelines for sarcopenia (ICFSR): screening, diagnosis and management. J Nutr Health Aging. 2018;22(10):1148–1161.
- Zanker J, Sim M, Anderson K, Balogun S, Brennan-Olsen SL, Dent E, et Consensus guidelines for sarcopenia prevention, diagnosis and management in Australia and New Zealand. J Cachexia Sarcopenia Muscle. 2023;14:142–156.
- Kirk B, Zanker J, Duque G. Osteosarcopenia: epidemiology, diagnosis, and treatment—facts and numbers. J Cachexia Sarcopenia Muscle. 2020;11:609–618.
- Beck Exercise prescription for osteoporosis: back to basics. Exerc Sport Sci Rev. 2022;50(2):57–64.
- Beck B, Daly R, Lord S, Watson S, Weeks B, Chen W, et al. CISE prescription to support the management of osteoporosis: for physiotherapists and exercise physiologists. Sydney: Healthy Bones Australia; 2024.
- Min SK, Oh T, Kim SH, Cho J, Chung HY, Park DH, et Position statement: exercise guidelines to increase peak bone mass in adolescents. J Bone Metab. 2019;26(4):225–239.
- Mastaglia S, Mautalen Sarcopenia: enfoque clínico. Actual Osteol. 2014;10(2):136–151.
- Ladang A, Beaudart C, Reginster JY, AlDaghri N, Bruyère O, Burlet N, et al. Biochemical markers of musculoskeletal health and aging to be assessed in clinical trials of drugs aiming at the treatment of sarcopenia: consensus paper from an expert group meeting organized by the European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases (ESCEO) and the Centre Académique de Recherche et d'Expérimentation en Santé (CARES SPRL), under the auspices of the World Health Organization Collaborating Center for the Epidemiology of Musculoskeletal Conditions and Aging. Calcif Tissue Int. 2023 Feb;112(2):197–217.
- Habboub B, Speer R, Gosch M, Singler K. The diagnosis and treatment of sarcopenia and sarcopenic obesity. Dtsch Arztebl Int. 2025;122:121–126.
- Lim WS, Cheong CY, Lim JP, Tan MMY, Chia JQ, Malik NA, et al. Singapore clinical practice guidelines for sarcopenia: screening, diagnosis, management and J Frailty Aging. 2022;11(4):348–369.
- Rizzoli R, Stevenson JC, Bauer JM, van Loon LJ, Walrand S, Kanis JA, et The role of dietary protein and vitamin D in maintaining musculoskeletal health in postmenopausal women: a consensus statement from the European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO). Maturitas. 2014;79:122–132.
- Brooke-Wavell K, Skelton DA, Barker KL, Clark EM, De Biase S, Arnold S, et Strong, steady and straight: UK consensus statement on physical activity and exercise for osteoporosis. Br J Sports Med. 2022;0:1–10.
- Giangregorio LM, Papaioannou A, MacIntyre NJ, Ashe MC, Heinonen A, Shipp K, et Too fit to fracture: exercise recommendations for individuals with osteoporosis or osteoporotic vertebral fracture. Osteoporos Int. 2014 Mar;25(3):821–835.
- Tiedemann A, Sturnieks DL, Burton E, Thomf JM, Lord SR, Scott S, et Exercise and Sports Science Australia updated position statement on exercise for preventing falls in older people living in the community. J Sci Med Sport. 2025;28:87–94.
- International Osteoporosis Foundation. Exercise for bone health and osteoporosis. Disponible en: https://www.osteoporosis.foundation
- S. Department of Health and Human Services. Physical activity guidelines for Americans. 2nd ed. Washington, DC: U.S. Department of Health and Human Services; 2018.
- LeBoff MS, Greenspan SL, Insogna KL, Lewiecki EM, Saag KG, Singer AJ, et al. Consensus statement: the clinician’s guide to prevention and treatment of Osteoporos Int. 2022;33:2049–2102.
- Kohrt WM, Bloomfield SA, Little KD, Nelson ME, Yingling Physical activity and bone health: position stand. J Am Coll Sports Med. 2004; (edición entre 1985-1996).
- Campbell AJ, Robertson MC; Falls Prevention Research Group. Otago Exercise Programme to prevent falls in older adults. Dunedin, New Zealand: Otago Medical School, University of Otago; 2007.
- Bischoff-Ferrari HA. Three steps to unbreakable bones: vitamin D, calcium and Nyon (Switzerland): International Osteoporosis Foundation (IOF); 2011 [citado el 3 ago 2025]. Disponible en: https://www.osteoporosis.foundation/educational-hub/topic/nutrition-and-lifestyle
- Méndez ERO, Wyatt. Contenido y absorción del calcio proveniente de la dieta del noroeste de México: una retrospectiva bibliográfica. Arch Latinoam Nutr. 2000;50(4):[páginas no especificadas].
- Shkembi B, Huppertz T. Absorción de calcio de los alimentos: efectos de la matriz alimentaria. 2022 Jan 1;14(1):180. doi:10.3390/nu14010180.
- Botella Martínez S, Zugasti Murillo A. Recomendaciones nutricionales para personas con osteoporosis. Madrid: Sociedad Española de Endocrinología y Nutrición (SEEN); 2021 [citado el 3 ago 2025]. Disponible en: http://www.seen.es
- Bolland MJ, Avenell A, Baron JA, Grey A, MacLennan GS, Gamble GD, et Efecto de los suplementos de calcio en el riesgo de infarto de miocardio y eventos cardiovasculares: metaanálisis. BMJ. 2010;341:c3691.
- Sosa Henríquez M, Murias Henríquez C. Influence of calcium and cholecalciferol in the treatment of osteoporosis. Med Clin (Barc) Pract. 2024;7:100411.
- Ross AC, Manson JE, Abrams SA, Aloia JF, Brannon PM, Clinton SK, et al. The 2011 report on dietary reference intakes for calcium and vitamin D from the Institute of Medicine: what clinicians need to know. J Clin Endocrinol Metab. 2011;96(1):53–58.
- North American Menopause Society. Management of osteoporosis in postmenopausal women: 2021 position statement of The North American Menopause Society. 2021;28(9):973–997.
- Compston, , Cooper, A., Cooper, C., Francis, R., Kanis, J. A., Marsh, D., McCloskey, V., Reid, D. M., Selby, P., & Wilkins, M. (2009). Guidelines for the diagnosis and management of osteoporosis in postmenopausal women and men from the age of 50 years in the UK. Maturitas, 62(2), 105–108. https://doi.org/10.1016/j.maturitas.2008.11.022
- Hilger J, Friedel A, Herr R, Rausch T, Roos F, Wahl DA, Pierroz DD, Weber P, Hoffmann A systematic review of vitamin D status in populations worldwide. Br J Nutr. 2014 Jan 14;111(1):23-45.
- Gómez O, Campusano C, de la Peña Rodríguez MP, Cerdas S, Reza‑Albarrán A, Mendoza B, Páez Talero A, Rueda Plata P. Clinical Practice Guidelines of the Latin American Federation of Endocrinology for the use of vitamin D in the maintenance of bone health: recommendations for the Latin American context. Arch Osteoporos. 2024;19:46.
- Demay MB, Pittas AG, Bikle DD, Diab DL, Kiely ME, Lazaretti-Castro M, et al. Clinical practice guideline: Vitamin D for the prevention of disease: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2024;00:1–41.
- Torres-Naranjo JF, López Cervantes RE, Medina Chávez JH, Vázquez Alanís A, Gutierrez-Hermosillo H, Avila Armengol HE, et al. Joint position on vitamin D prescription in the adult Mexican population by AMMOM, AMEC, AMG, CMIM, CMO, CMR, CONAMEGER, FEMECOG, and FEMECOT. Arch Osteoporos. 2025;20:78.
- Sánchez A, Oliveri B, Mansur JL, Fradinger E. Guía de la Federación Argentina de Sociedades de Endocrinología sobre diagnóstico, prevención y tratamiento de la hipovitaminosis D. Actual Osteol. 2015;11(2):151–71.
- Ma ML, Ma ZJ, He YL, Sun H, Yang B, Ruan BJ, et al. Efficacy of vitamin K in the prevention and treatment of postmenopausal osteoporosis: a systematic review and meta-analysis of randomized controlled trials. Front Public Health. 2022;10:979649. doi:10.3389/fpubh.2022.979649.
- Skalny AV, Grabeklis AR, Aaseth J, Rink L, Nikonorov AA, Notova SV, et Vitamins in bone health and osteoporosis. Int J Mol Med. 2024;53:9. doi:10.3892/ijmm.2023.5333.
- Díaz Curiel M. Vitamina D: consideraciones fisiológicas y recomendaciones. Rev Osteoporos Metab Miner. 2015;7(1):3–8. doi:10.4321/S1889-836X2015000100008.
- Rani J, Swati S, Meeta M, Singh SH, Tanvir T, Madan Postmenopausal osteoporosis: menopause hormone therapy and selective estrogen receptor modulators. Indian J Orthop. 2023;57:105–114.
- Na Z, Wei W, Xu Y, Li D, Yin B, Gu W. Role of menopausal hormone therapy in the prevention of postmenopausal osteoporosis. Open Life Sci. 2023;18:20220759.
- The Writing Group for the PEPI Trial. Effects of hormone therapy on bone mineral density: results from the postmenopausal estrogen/progestin interventions (PEPI) trial. 1996;276:1389–1396.
- Marcus R, Holloway L, Wells B, Greendale G, James MK, Wasilauskas C, et al. The relationship of biochemical markers of bone turnover to bone density changes in postmenopausal women: results from the Postmenopausal Estrogen/Progestin Interventions (PEPI) trial. J Bone Miner Res. 1999;14:1583–95.
- Rossouw JE, Anderson GL, Prentice RL, LaCroix AZ, Kooperberg C, Stefanick ML, et al. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results from the Women’s Health Initiative randomized controlled trial. 2002;288(3):321–33.
- Cauley JA, Robbins J, Chen Z, Cummings SR, Jackson RD, LaCroix AZ, et al. Effects of estrogen plus progestin on risk of fracture and bone mineral density: the Women’s Health Initiative randomized trial. 2003;290(24):1729–38.
- The 2022 Hormone Therapy Position Statement of The North American Menopause Society Advisory Panel. The 2022 hormone therapy position statement of The North American Menopause Society. 2022;29(7):767–94.
- Lindsay R, Gallagher JC, Kleerekoper M, Pickar Effect of lower doses of conjugated equine estrogens with and without medroxyprogesterone acetate on bone in early postmenopausal women. JAMA. 2002;287(20):2668–76.
- Goldštajn MŠ, Mikuš M, Ferrari FA, Bosco M, Uccella S, Noventa M, et al. Effects of transdermal versus oral hormone replacement therapy in postmenopause: a systematic review. Arch Gynecol Obstet. 2023;307(6):1727–45.
- Lambrinoudaki I, Armeni E, Goulis D, Bretz S, Ceausu I, Durmusoglu F, et al. Menopause, wellbeing and health: A care pathway from the European Menopause and Andropause Society. Maturitas. 2022;163:1–14
- Baber RJ, Panay N, Fenton A, IMS Writing Group. 2016 IMS Recommendations on women’s midlife health and menopause hormone therapy. Climacteric. 2016;19(2):109–50.
- National Collaborating Centre for Women’s and Children's Health (UK). Menopause: Full Guideline. London: National Institute for Health and Care Excellence (UK); 2015.
- Eastell R, Rosen CJ, Black DM, Cheung AM, Murad MH, Shoback Pharmacological Management of Osteoporosis in Postmenopausal Women: An Endocrine Society* Clinical Practice Guideline. J Clin Endocrinol Metab. 2019;104(5):1595–622.
- Davis SR, Taylor S, Hemachandra C, Magraith K, Ebeling PR, Jane F, et al. The 2023 Practitioner’s Toolkit for Managing Menopause. Climacteric. 2023;26(6):517–36.
- Siris ES, Brenneman SK, Miller PD, Barrett-Connor E, Chen YT, Sherwood LM, et al. Predictive value of low BMD for 1-year fracture outcomes is similar for postmenopausal women ages 50-64 and 65 and older: results from the National Osteoporosis Risk Assessment (NORA). J Bone Miner Res. 2004;19(8):1215–20.
- Siris ES, Simon JA, Barton IP, McClung MR, Grauer A. Effects of risedronate on fracture risk in postmenopausal women with osteopenia. Osteoporos Int. 2008;19(5):681–6.
- Lorentzon M, Johansson H, Harvey NC, Liu E, Vandenput L, Crandall CJ, et al. Menopausal hormone therapy reduces the risk of fracture regardless of falls risk or baseline FRAX probability—results from the Women’s Health Initiative hormone therapy trials. Osteoporos Int. 2022;33(11):2297–305.
- Bagger YZ, Tankó LB, Alexandersen P, Hansen HB, Møllgaard A, Ravn P, et Two to three years of hormone replacement treatment in healthy women have long-term preventive effects on bone mass and osteoporotic fractures: the PERF study. Bone. 2004;34(5):728–35.
- Cummings SR, Ettinger B, Delmas PD, Kenemans P, Stathopoulos V, Verweij P, et The effects of tibolone in older postmenopausal women. N Engl J Med. 2008;359(7):697–708.
- Barrionuevo P, Kapoor E, Asi N, Alahdab F, Mohammed K, Benkhadra K, et al. Efficacy of pharmacological therapies for the prevention of fractures in postmenopausal women: A network meta-analysis. J Clin Endocrinol Metab. 2019;104: 1623–1630.
- Ettinger B, Black DM, Mitlak BH, Knickerbocker RK, Nickelsen T, Genant HK, et al. Reduction of vertebral fracture risk in postmenopausal women with osteoporosis treated with raloxifene: results from a 3-year randomized clinical trial. Multiple Outcomes of Raloxifene Evaluation (MORE) Investigators. JAMA. 1999;282(7):637–645.
- Cauley JA, Norton L, Lippman ME, et al. Continued breast cancer risk reduction in postmenopausal women treated with raloxifene: 4-year results from the MORE trial. Multiple Outcomes of Raloxifene Evaluation. Breast Cancer Res Treat. 2001;65(2):125–134.
- Martino S, Cauley JA, Barrett-Connor E, et al. CORE Investigators. Continuing outcomes relevant to Evista: breast cancer incidence in postmenopausal osteoporotic women in a randomized trial of raloxifene. J Natl Cancer Inst. 2004;96(23):1751–1761.
- Vogel VG, Costantino JP, Wickerham DL, et al. National Surgical Adjuvant Breast and Bowel Project (NSABP). Effects of tamoxifen raloxifene on the risk of developing invasive breast cancer and other disease outcomes: the NSABP Study of Tamoxifen and Raloxifene (STAR) P-2 trial. JAMA. 2006;295(23):2727–2741.
- Barrett-Connor E, Mosca L, Collins P, et Raloxifene Use for The Heart (RUTH) Trial Investigators. Effects of raloxifene on cardiovascular events and breast cancer in postmenopausal women. N Engl J Med. 2006;355(2):125–137.
- Delmas PD, Ensrud KE, Adachi JD, Harper KD, Sarkar S, Gennari C, et al. Efficacy of raloxifene on vertebral fracture risk reduction in postmenopausal women with osteoporosis: four-year results from a randomized clinical J Clin Endocrinol Metab. 2002;87:3609–3617.
- Silverman SL, Chines AA, Kendler DL, Kung AWC, Teglbjærg CS, Felsenberg D, et Sustained efficacy and safety of bazedoxifene in preventing fractures in postmenopausal women with osteoporosis: results of a 5-year, randomized, placebo-controlled study. Osteoporos Int. 2012;23:351–363.
- Palacios S, Silverman SL, de Villiers TJ, Levine AB, Goemaere S, Brown JP, et A 7-year randomized, placebo-controlled trial assessing the long-term efficacy and safety of bazedoxifene in postmenopausal women with osteoporosis: effects on bone density and fracture. Menopause. 2015;22:806–813.
- Kanis JA, Johansson H, Oden A, McCloskey EV. Bazedoxifene reduces vertebral and clinical fractures in postmenopausal women at high risk assessed with FRAX. 2009;44:1049–1054.
- McClung MR. New management options for osteoporosis with emphasis on Climacteric. 2015;18 Suppl 2:56–61.
- Grey A, Reid IR. Differences between the bisphosphonates for the prevention of osteoporosis. Ther Clin Risk Manag. 2006;2(1):77–86.
- Russell RG, Watts NB, Ebetino FH, Rogers MJ. Mechanisms of action of bisphosphonates: similarities and differences and their potential influence on clinical efficacy. Osteoporos Int. 2008;19:733-759.
- Watts NB, Diab DL. Long-term use of bisphosphonates in osteoporosis. J Clin Endocrinol Metab. 2010;95(4):1555-1565.
- Qaseem A, Hicks LA, Etxeandia-Ikobaltzeta I, Shamliyan TA, Cooney TG; Clinical Guidelines Committee of the American College of Physicians; Chou R, Kansagara D, Motu'apuaka M, Lazur B, Fu R, Grusing S, Ahmed A. Screening for Osteoporosis in Men: A Systematic Review and Meta-analysis. Ann Intern Med. 2019 May 7;170(9):617-627.
- Gregson UK clinical guideline for the prevention and treatment of osteoporosis. Arch Osteoporos. 2022 Sep 13;17(1):120.
- Compston J, Cooper A, Cooper C, Gittoes N, Gregson C, Harvey N, Hope S, Kanis JA, McCloskey EV, Poole KES, Reid DM, Selby P, Thompson F, Thurston A, Vine N; National Osteoporosis Guideline Group (NOGG). UK clinical guideline for the prevention and treatment of osteoporosis. Osteoporos Int. 2017 Aug;28(8):2239-44.
- Ansari G, Nandagudi A, Pattapola S. AB1012 Management of breast cancer treatment induced bone loss—re-audit. Ann Rheum Dis. 2022;81(Suppl 1):1629-1630.
- Wells GA, Hsieh SC, Peterson J, Zheng C, Kelly SE, Shea B, Tugwell P. Alendronate for the primary and secondary prevention of osteoporotic fractures in postmenopausal women. Cochrane Database Syst Rev. 2025 Jan 27;1(1):CD001155.
- Hayes KN, Winter EM, Cadarette SM, Burden AM. Duration of Bisphosphonate Drug Holidays in Osteoporosis Patients: A Narrative Review of the Evidence and Considerations for Decision-Making. J Clin Med. 2021 May 18;10(10):2184.3
- Riancho JA, Peris P, González-Macías J, Pérez-Castrillón JL; SEIOMM Osteoporosis Guidelines Writing Group. Executive summary clinical practice guideline of postmenopausal, glucocorticoid-induced and male osteoporosis (2022 update). Spanish Society for Bone and Mineral Metabolism Investigation (SEIOMM). Rev Clin Esp (Barc). 2022 Aug-Sep;222(7):432-439.
- Händel MN, Cardoso I, von Bülow C, Rohde JF, Ussing A, Nielsen SM, Vestergaard Fracture risk reduction and safety by osteoporosis treatment compared with placebo or active comparator in postmenopausal women: systematic review, network meta-analysis, and meta-regression analysis of randomised clinical trials. BMJ. 2023.
- Ayers C, Kansagara D, Lazur B, Fu R, Kwon A, Harrod Effectiveness and Safety of Treatments to Prevent Fractures in People With Low Bone Mass or Primary Osteoporosis: A Living Systematic Review and Network Meta-analysis for the American College of Physicians. Ann Intern Med. 2023 Feb;176(2):182-195.
- DiGiorgio WJ, Gitting J, Lee SJ. Time to Benefit of Bisphosphonate Therapy for the Prevention of Fractures Among Postmenopausal Women With Osteoporosis: A Meta-analysis of Randomized Clinical Trials. JAMA Netw Open. 2021 Nov 1;4(11):e2133990.
- Eastell R, Rosen CJ, Black DM, Cheung AM, Murad MH, Shoback D, et al. Pharmacological Management of Osteoporosis in Postmenopausal Women: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2019;104(5):1595-1622.
- van de Laarschot DM, McKenna MJ, Abrahamsen B, et Medical Management of Patients After Atypical Femur Fractures: A Systematic Review and Recommendations From the European Calcified Tissue Society. J Clin Endocrinol Metab. 2020;105(5):1682–1699.
- Ruggiero SL. American Association of Oral and Maxillofacial Surgeons' Position Paper on Medication-Related Osteonecrosis of the Jaws—2022 Update. J Oral Maxillofac Surg. 2022.
- Dell RM, Adams AL, Greene DF, et al. Atypical Femur Fractures: Review of Epidemiology, Relationship to Bisphosphonates, Prevention, and Clinical Endocr Rev. 2019;40(2):333-353.
- Black DM, Reid IR, Boonen S, Bucci-Rechtweg C, Cauley JA, Cosman F, et The effect of 3 versus 6 years of zoledronic acid treatment of osteoporosis: a randomized extension to the HORIZON-Pivotal Fracture Trial (PFT). J Bone Miner Res. 2012;27(2):243–254.
- Bone HG, Wagman RB, Brandi ML, Miller PD, Papapoulos S, Saag KG, et al. 10 years of denosumab treatment in postmenopausal women with osteoporosis: results from the phase 3 randomised FREEDOM trial and open-label extension. Lancet Diabetes Endocrinol. 2017;5(7):513–523.
- Miller PD, Pannacciulli N, Brown JP, Czerwinski E, Nedergaard BS, Bolognese MA, et al. Denosumab or zoledronic acid in postmenopausal women with osteoporosis previously treated with oral bisphosphonates. J Clin Endocrinol Metab. 2016;101(8):3163–3170.
- Watts NB, Roux C, Modlin JF, Brown JP, Daniels A, Jackson RD, et Infections in postmenopausal women with osteoporosis treated with denosumab or placebo: coincidence or causal association? Osteoporos Int. 2012;23(1):327–337.
- Kendler D, Cosman F, Stad RK, Ferrari S. Denosumab in the treatment of osteoporosis: 10 years later: a narrative review. Adv Ther. 2022;39(1):58–74.
- Compston JE, McClung MR, Leslie WD. Lancet. 2019 Jan 26;393(10169):364–376. doi:10.1016/S0140-6736(18)32112-3. PMID: 30696576.
- Langdahl B, et Romosozumab: treatment of osteoporosis by blocking sclerostin. Calcif Tissue Int. 2020;106(1):1–17.
- Kanis JA, Cooper C, Rizzoli R, Reginster JY; Scientific Advisory Board of the European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO) and the Committees of Scientific Advisors and National Societies of the International Osteoporosis Foundation (IOF). Algorithm for the management of osteoporosis in postmenopausal women: 2021 update. Osteoporos Int. 2021;32(3):549–565.
- National Osteoporosis Foundation. Clinician’s guide to prevention and treatment of osteoporosis. Washington (DC): National Osteoporosis Foundation; 2022.
- Schurman L, Galich AM, Messina O, et al. Guías argentinas para el diagnóstico, prevención y tratamiento de la osteoporosis. Actual Osteol. 2017;13(2):136-56. Disponible en: http://www.osteologia.org.ar
- Neer RM, Arnaud CD, Zanchetta JR, et al. Effect of parathyroid hormone (1-34) on fractures and bone mineral density in postmenopausal women with osteoporosis. N Engl J Med. 2001 May 10;344(19):1434-41.
- Rubin MR, Cosman F, Lindsay R, Bilezikian JP. The anabolic effects of parathyroid hormone. Osteoporos Int. 2002;13(4):267-77. doi: 10.1007/s001980200026.
- Miller PD, Hattersley G, Riis BJ, Williams GC, Lau E, Russo LA, et al. Effect of abaloparatide vs placebo on new vertebral fractures in postmenopausal women with osteoporosis: a randomized clinical trial. JAMA. 2016 Aug 16;316(7):722–33. doi:10.1001/jama.2016.11136.
- Cosman F, de Beur SJ, LeBoff MS, Lewiecki EM, Tanner B, Randall S, et al. Clinician’s guide to prevention and treatment of osteoporosis. Osteoporos Int. 2014 Oct;25(10):2359–81.
- McClung MR, Grauer A, Boonen S, Bolognese MA, Brown JP, Diez-Perez A, et al. Romosozumab in postmenopausal women with low bone mineral J Bone Miner Res. 2014 Mar;29(3):717–25.
- Saag KG, Petersen J, Brandi ML, Karaplis AC, Lorentzon M, Thomas T, et al. Romosozumab or alendronate for fracture prevention in women with osteoporosis. N Engl J Med. 2017 Oct 12;377(15):1417–27.
- Diez-Perez A, Adachi JD, Agnusdei D, Bilezikian JP, Compston JE, Cummings SR, et al. Treatment failure in osteoporosis. Osteoporos Int. 2012 Dec;23(12):2769–74.
c