Adrenarca: un enigmático proceso madurativo prepuberal.
Adrenarche: an enigmatic prepubertal maturation process.
Autores:
Dr. Pablo Ariel Sayago I; Dra. Andrea Carolina Tutasi II; Dra. Daniela Lucía Alonso III
RESUMEN
La adrenarca se define como el aumento en la producción de dehidroepiandrosterona (DHEA) y sulfato de dehidroepiandrosterona (DHEA-S) que ocurre entre los 6-8 años, asociado a la emergencia morfológica y funcional de la zona reticular de la corteza suprarrenal.
La suprarrenal fetal produce grandes cantidades de DHEA Y DHEA-S, precursores de estrógenos en la placenta.
Aún no se conocen los factores desencadenantes de la adrenarca. El sello fenotípico lo constituye el vello axilar y púbico. Existen también efectos neurobiológicos.
La adrenocorticotrofina (ACTH) es un mediador primario aceptado de adrenarca. Se ha sugerido que el sistema Hormona de Crecimiento- Factor de Crecimiento similar a insulina (GH-IGF) es una importante señal reguladora.
El antecedente de restricción del crecimiento intrauterino (RCIU) se relaciona con hiperinsulinemia, adrenarca exagerada, pubarca precoz, pubertad adelantada, dislipidemia e hiperandorgenismo ovárico.
La adrenarca forma parte de un proceso madurativo gradual, cuyos marcadores androgénicos requieren aún mayor investigación.
Palabras clave: DHEA, DHEA-S, zona reticular, 17-20 liasa, pubarca.
SUMMARY
The adrenarche is defined as the increase in the production of dehydroepiandrosterone (DHEA) and dehydroepiandrosterone sulfate (DHEA-S) that happens between eyes of 6-8 years old, associated with the morphological and functional emergence of the reticular zone of the adrenal cortex.
The fetal adrenal gland produces a large amount of DHEA and DHEAS, the precursors for placental estrogen production.
The adrenarche triggers are not yet known. The phenotypic hallmark is the axillary and pubic hair. There are also neurobiological effects.
Adrenocorticotropin (ACTH) is a primary mediator of adrenarche. The Growth Hormone-Insulin like Growth Factor (GH-IGF) system has been suggested to be an important regulatory signal.
A history of intrauterine growth restriction (IUGR) is associated with hyperinsulinemia, premature adrenarche, precocious pubarche, early puberty, dyslipidemia, and ovarian hyperandrogenism.
Adrenarchal maturation is a gradual process, for the androgenic markers further investigation is required.
Key words: DHEA, DHEA-S, reticular zone, 17-20 lyase, pubarche.
1.- Introducción.
En 1947, Fuller Albright introdujo el término “adrenarca” para describir el inicio de la secreción de dehidroepiandrosterona (DHEA) y de sulfato de dehidroepiandrosterona (DHEA-S) desde la zona reticular de la glándula suprarrenal durante la infancia, la que fuera documentada por primera vez en 1943, por Talbot como un aumento en la orina de los 17 cetosteroides. (1)
La adrenarca representa un proceso biológico reciente en el desarrollo evolutivo, solo observado en humanos y algunos primates superiores. Ocurre antes y en forma independiente de la activación del eje gonadal y en consecuencia de la adquisición de la capacidad de reproducción, hecho que caracteriza a la pubertad.
Si bien las señales que lo impulsan y su significado funcional continúan siendo desconocidos y poco entendidos, hay un claro papel permisivo de adrenocorticotrofina (ACTH) y una potencial modulación, entre otros, del Factor de Crecimiento Similar a Insulina I (IGF I). (2)(3)
Sus anormalidades, ya sea en el tiempo de aparición como en su intensidad han sido relacionadas con diferentes alteraciones metabólicas. La restricción de crecimiento intrauterino (RCIU) suele asociarse a un riesgo aumentado de adrenarca prematura, pubertad temprana, poliquistosis ovárica, resistencia a la insulina y transtornos en la fertilidad. (4)(5)
Asimismo existe un creciente número de estudios que muestran un patrón emergente por el cual el momento de la adrenarca se asocia con riesgo de problemas de salud mental, por lo que ésta representaría un período eventualmente sensible en el desarrollo neurobiológico.(6)
Partiendo de estos conceptos, nos proponemos efectuar una revisión, centrándonos fundamentalmente en la fisiología de la adrenarca.
2.- Objetivos:
- Reseñar el desarrollo embriológico de la glándula suprarrenal.
- Describir la fisiología del eje hipotálamo-hipófiso-adrenal en el feto y de la unidad feto-materno-placentaria respecto de las hormonas esteroideas.
- Definir adrenarca y reconocer los cambios morfológicos, bioquímicos, endocrinológicos y físicos que involucra.
- Exponer la regulación de la síntesis de esteroides suprarrenales.
- Mencionar las alteraciones de la adrenarca y relacionarlas con eventos pre y posnatales vinculados a diferentes situaciones metabólicas.
3.-Desarrollo embriológico de las glándulas suprarrenales.
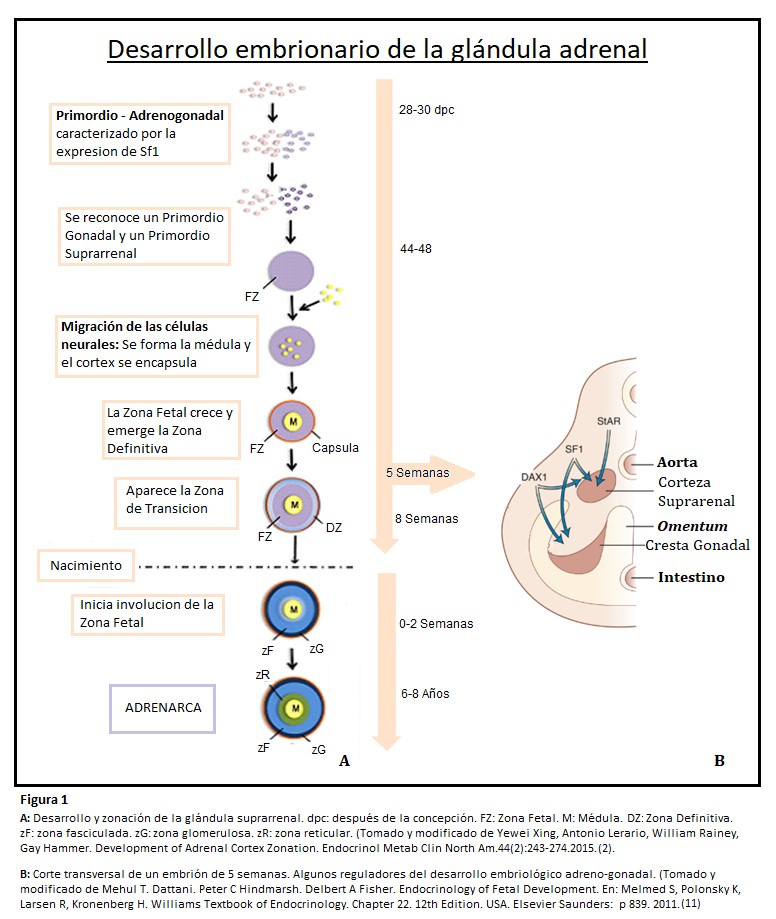
Las glándulas suprarrenales se desarrollan de dos tejidos embriológicos separados: la corteza proviene del mesodermo intermedio, mientras que la médula se diferencia a partir de células de la cresta neural. (2)(7) La aparición de la glándula en forma de primordio adrenogonadal bilateral se produce a los 28-30 días después de la concepción, cada primordio adrenogonadal contiene una población mixta de células progenitoras gonadales adrenocorticales y somáticas. Un subconjunto de estas células formarán el primordio gonadal, mientras que otras formarán el primordio suprarrenal, estableciéndose finalmente ventrolateral a la aorta dorsal.
Existe entonces un linaje celular común, que también dará origen a las células secretoras de esteroides en las gónadas. (4)(7)(8)
Aproximadamente 48 días después de la concepción, células de la cresta neural migran hacia la suprarrenal embrionaria persistiendo como islas discretas hasta el nacimiento, finalmente se unen y se diferencian en células cromafines productoras de catecolaminas. Recién a los 12-18 meses de vida posnatal la médula adquiere una apariencia similar a la adulta. (7)
Mientras tanto, la glándula suprarrenal comienza a separarse del mesénquima subyacente y se encapsula con la formación de una capa fibrosa que recubre las células corticales en desarrollo, un proceso que se completa 52 dias después de la concepción.
Las células adrenocorticales esteroidogénicas y cromafines productoras de catecolaminas tienen aquí una íntima relación. Se necesitan estudios sobre los mecanismos moleculares que participan en la interacción entre dichas células. (2)
Después de la encapsulación, se esboza a lo largo de la sexta semana, la corteza fetal, la cual se expande rápidamente en especial durante las últimas seis semanas de gestación, denominándose Zona Fetal. De hecho, la suprarrenal fetal humana es uno de los órganos más grandes al término, con casi el tamaño del riñón y el 80% de la glándula compuesta por células de la Zona Fetal. Asimismo, son entre 10 y 20 veces mayores que las suprarrenales adultas. Las células de la Zona Fetal expresan definidamente el citocromo P450 α, CYP17, una enzima bifuncional con actividades de 17 α hidroxilasa y 17,20 liasa que convierten la pregnenolona en DHEA. Debido a la alta actividad de CYP17 la corteza suprarrenal humana produce grandes cantidades de DHEA Y DHEA-S, precursores de estrógenos en la placenta y asimismo expresa CYP11A, una enzima de escisión de cadena de colesterol (pero no 3B-hidroxiesteroide deshidrogenasa. (7)
Hacia la octava semana de gestación aparece la Zona Definitiva o “adulta”, entre la cápsula y la Zona Fetal, esta porción dará origen durante el tercer trimestre a la zona glomerulosa que expresa la CYP11B2 productora de mineralocorticoides, responsable de la producción de aldosterona, mas tardíamente aparece la Zona de Transición (región interna de la Zona Definitiva) entre la Zona Fetal y la Definitiva, que expresará enzimas requeridas para la síntesis de cortisol. Al momento del nacimiento se encontrarán presentes la zona fasciculada y la glomerulosa que han madurado por el estímulo trófico de la angiotensina II y ACTH. (2)(7)
Después del nacimiento ocurre una fuerte remodelación, durante el primer año de vida las glándulas disminuyen rápidamente de tamaño, pierden alrededor de la tercera parte de su peso a lo largo de las primeras dos o tres semanas y lo recuperarán a finales del segundo año, tiene lugar también la involución de la Zona Fetal, por apoptosis, que se completa alrededor del tercer mes. (2)(7)(8)(9)10)
Estos cambios morfológicos están acompañados de una caída en la producción de DHEA y DHEA-S. La Zona Fetal (que homologa la futura zona reticular) estará representada por islas focales de células, insuficientes para influir en los niveles séricos de DHEA y DHEA-S. (7)
La zona reticular no puede reconocerse hasta finales del tercer año de vida postnatal. Ésta se forma entre la fasciculada y la médula. (7)(8)
El origen, proliferación y regulación de las zonas adrenocorticales no se entiende de manera completa. En la actualidad la teoría de la proliferación/migración de células progenitoras es la más aceptada: la misma propone que todas las células de la corteza suprarrenal podrían tener un origen común que se vuelve funcionalmente diferenciado (zonificación histológica) con el apropiado entorno de la zona. La célula progenitora prolifera en las capas periféricas subcapsulares de la glándula y posteriormente migra, efectuando una repoblación celular centrípeta. (2)(7)
Mencionaremos algunos reguladores participantes de la cascada de eventos que intervienen en el desarrollo suprarrenal fetal:
- Factor Esteroidogénico 1 (SF1): la aparición del primordio adrenogonadal y su adecuada diferenciación está marcada por la expresión de este factor transcripcional y su receptor nuclear NR5A1. En su ausencia, no se forma la glándula suprarrenal: aplasia suprarrenal. Controla la expresión de genes que codifican enzimas involucradas en la esteroidogénesis principalmente el citocromo P450.
- Dax1: es un receptor “nuclear huérfano”, gen diana SF1, juega un papel esencial en el mantenimiento de la pluripotencia de células madre/progenitoras y su expansión, su presencia reprime diferenciación. La regulación de la expresión de Dax1, se prevé que sea un proceso dinámico que equilibre la renovación de progenitores y la diferenciación/ esteroidogénesis. En ausencia de Dax1 las células se diferencian prematuramente en células esteroidogénicas.
- ACTH: Si bién el crecimiento y la diferenciación adrenocortical son independientes de la ACTH (un péptido de 39 aminoácidos secretado por la hipófisis anterior bajo control del Factor Liberador de Adrenocorticotrofina-CRH, otro péptido de 41 aminoácidos producido en el núcleo paraventricular del hipotálamo), comienza a desempeñar un papel esencial en el desarrollo morfológico y funcional después de las quince semanas de gestación. Los efectos promotores del crecimiento de ACTH están mediados en parte por la estimulación de factores de crecimiento producidos localmente como el Factor de Crecimiento Similar a la Insulina II (IGF II) y Factor de Crecimiento de Fibroblastos (FGF). Actúa sobre la Zona Definitiva regulando la esteroidogénesis, la diferenciación celular y el crecimiento. Aumenta los receptores de LDL-colesterol y la expresión de su propio receptor.
- CRH: éste, sus péptidos homólogos (urocortin 1-3, UCN1-3) y sus receptores (CRF1 y CRF2) se encuentran distribuidos en las suprarrenales con diferentes patrones de distribución, lo que sugiere que podrían tener acción local y directa.
Otra fuente de CRH es la placenta cuya producción aumenta notablemente al final de la gestación conduciendo a mayores producciones de cortisol, DHEA y DHEA-S cumpliendo un papel en el determinismo del parto. Eleva los niveles de ARNm de la proteína de la regulación aguda de la esteroidogénesis: proteína StAR y otras enzimas, incluyendo la 3B hidroxiesteroide deshidrogenasa tipo 2 (3BHSD2), CYP21 y CYP11B1. El CRH mejora la respuesta suprarrenal a ACTH. El efecto estimulante podría requerir la presencia de células cromafines de acuerdo con la potencial relación paracrina entre corteza y médula.
- IGF II: éste se expresa más altamente que el IGF I durante el desarrollo suprarrenal fetal mientras que en el adulto predomina el IGF I. Son mitógenos y cumplen un papel potencial en las células madre/progenitoras de las suprarrenales. Su acción es esencial en el desarrollo adrenogonadal y la determinación primaria del sexo.
- Matriz extracelular: la matriz extracelular está compuesta de glicoproteínas y receptores de integrina asociados. Estudios de cultivos celulares han encontrado que el colágeno tipo IV está presente uniformemente por toda la suprarrenal fetal, otras glicoproteínas como lamininas y fibronectinas muestran patrones de expresión más restringidos. La laminina se expresa en la Zona Definitiva y la fibronectina en la Zona Fetal. El colágeno tipo IV mejora la secreción de DHEA, DHEA-S y cortisol estimulada por ACTH. La fibronectina aumenta la expresión del gen P450C17. La matriz extracelular entonces contribuye a proporcionar un microambiente extracelular muy importante para el mantenimiento de la morfología y el comportamiento celular funcional. (2)(9)
4.- Algunos aspectos de la fisiología suprarrenal del feto y de la unidad feto-materno-placentaria integrada: el comienzo de un dinámico proceso.
En líneas generales, el sistema endocrino es uno de los primeros sistemas homeostáticos que se desarrolla durante la vida fetal. El primordio hipofisario aparece hacia las cuatro semanas.
Estudios inmunocitoquímicos han demostrado positividad de CRH entre las semanas decimosexta y decimonovena.
El CRH es un potente secretagogo de ACTH y B endorfina en la hipófisis fetal humana. Además, la arginina- vasopresina también puede liberar ACTH desde la hipófisis fetal. La placenta produce también grandes cantidades de CRH en particular hacia el final del embarazo, queda por aclarar si la CRH placentaria cumple un papel en la regulación de la liberación de ACTH fetal.
Se ha demostrado la existencia de ACTH en la hipófisis fetal humana hacia la semana diez de gestación.
No hay pasaje de ACTH materna a través de la placenta. Esta hormona aumenta en el feto durante el primer y el segundo estadio del trabajo de parto. La hipoxia y la acidosis fetal son estímulos para la liberación de B endorfinas. El sufrimiento intraparto, vinculado con la hipoxia fetal, también se asoció con el aumento de la concentración de B endorfina en sangre de cordón. Se ha hallado aumento de la inmunoactividad de B endorfina en líquido amniótico en embarazos con restricción de crecimiento intrauterino (RCIU) y de partos prematuros. El nivel de ACTH en el feto humano en término es 4 a 5 veces mayor que en los adultos normales.
La ACTH responde a la exposición de CRH desde la decimocuarta de gestación.
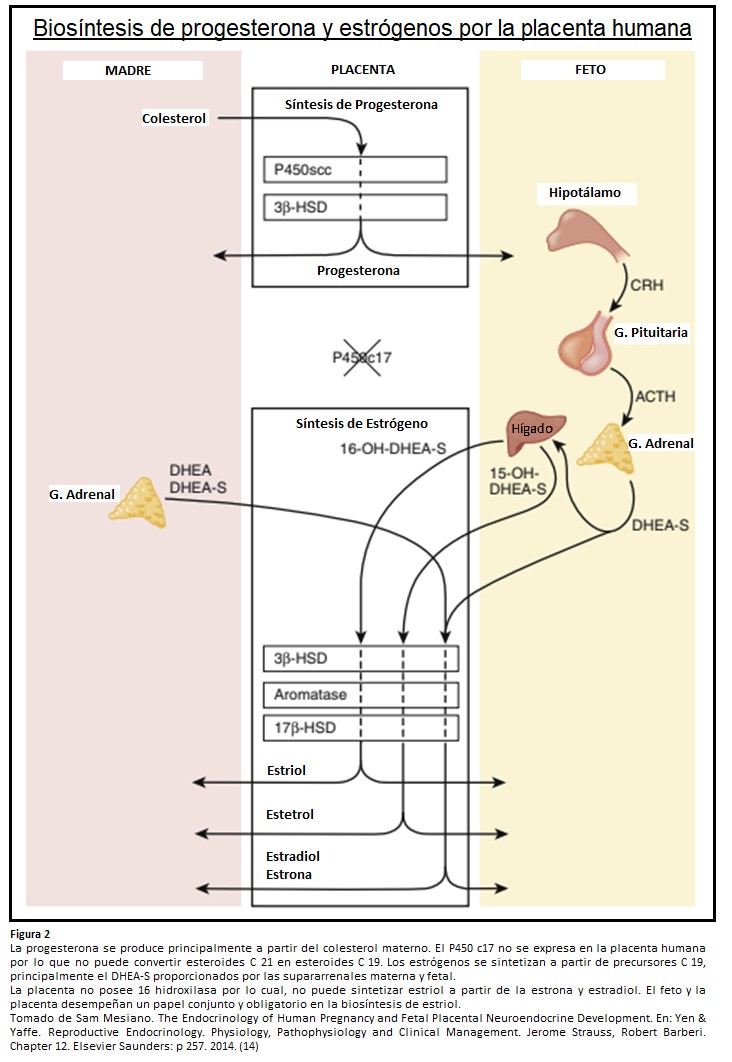
Para formar estrógenos, la placenta, que posee una capacidad de aromatización activa, utiliza andrógenos circulantes, en gran parte del feto, pero también de la madre. El principal precursor androgénico en la formación placentaria de estrógenos es el DHEA-S, este compuesto proviene sobre todo de las suprarrenales fetales. Dado que la placenta tiene abundancia de la enzima sulfatasa (que cliva el sulfato), el DHEA-S es convertido en DHEA libre (forma no conjugada) y luego en androstenediona y en testosterona que son rápidamente aromatizadas para formar estrona y estradiol, que son liberados hacia la circulación materna.
La conversión de esteroides androstenediona y testosterona en estrona y estradiol por parte de la placenta proporciona una barrera esencial contra la acción androgénica que de otro modo podría causar virilización de fetos femeninos. Debido a la falta de 16 hidroxilasa, la placenta no puede formar estriol a partir de estrona o estradiol.
Sin embargo, durante el embarazo humano el principal estrógeno formado no es ni estrona ni estradiol sino estriol. El estriol se forma por un proceso de biosíntesis única durante el embarazo, lo cual demuestra la interdependencia del feto, la placenta y la madre. Parte del DHEA-S es 16 α-hidroxilado en el hígado fetal (y en menor cantidad en las propias suprarrenales) cuando éste llega a la placenta, la sulfatasa placentaria actúa junto con aromatasas para formar estriol. Luego es secretado hacia la circulación materna. El feto y la placenta desempeñan un papel conjunto y obligatorio en la biosíntesis de estriol, 90% del estriol proviene del DHEA-S fetal. El estriol es un estrógeno débil, con aproximadamente 0,01 vez la potencia del estradiol y 0,1 vez la potencia de la estrona. Los estrógenos placentarios aumentan el volumen sanguíneo y el flujo sanguíneo uteroplacentario, preparan la mama para la lactancia, regulan de manera positiva los receptores para LDL (ya que la placenta no puede sintetizar colesterol y toma este recurso de las LDL maternas) y las enzimas esteroideogénicas para la producción de progesterona. (12)
Los dos esteroides principales identificados producidos por las glándulas suprarrenales fetales son el DHEA-S y el cortisol. La ACTH estimula la producción de ambos esteroides. Durante la primera mitad del embarazo la Gonadotrofina Coriónica Humana (HCG) que es producida en mayor cantidad durante la primera mitad del embarazo, también puede estimular la producción de DHEA-S. En los pulmones, los glucocorticoides inducen la citodiferenciación de las células alveolares de tipo II y estimulan la síntesis de sustancias tensioactivas y su liberación hacia los alvéolos. La ausencia de esta sustancia puede llevar a dificultad respiratoria, la causa primaria de muerte en prematuros. Las suprarrenales fetales podrían desempeñar un papel en la iniciación del trabajo de parto ya que un incremento de cortisol fetal precede al trabajo de parto.(10)(13)
La placenta carece de actividad de 17 hidroxilasa y 17,20 liasa P450c17 y por ende no puede convertir esteroides de C21 (carbono 21) en C19 (carbono 19).
De gran interés es el reciente descubrimiento del sistema de señalización kisspeptina en las suprarrenales fetales, cuya expresión lleva a una mayor producción de DHEA-S. Asimismo parecería ser un regulador de la unidad feto-placentaria durante el embarazo. No se ha establecido, si este sistema desempeña algún papel durante la adrenarca. (3)
La función principal de la corteza suprarrenal es sintetizar de novo una variedad de hormonas esteroideas para su liberación inmediata. En el adulto, la glándula se compone de dos partes, la médula y la corteza, ésta última consta de tres compartimentos con distintas características morfológicas y funcionales: la zona glomerulosa, la zona fasciculada y zona reticularis. Aunque cada zona utiliza colesterol como molécula precursora, la expresión diferencial de enzimas produce esteroides distintos. Como es de suponer, las glándulas suprarrenales tienen uno de los mayores suministros de sangre por gramo de tejido y asimismo están ricamente inervadas. La aldosterona es el mineralocorticoide primario producido por las células de la zona glomerular bajo control de la Angiotensina II, potasio y en menor medida ACTH. La secreción de aldosterona se limita a células de la zona glomerular debido a la presencia específica de la enzima aldosterona sintetasa CYP11B2. La aldosterona aumenta la reabsorción de sodio y excreción de potasio e hidrógeno en los túbulos renales. Otros tejidos blanco son el colon y glándulas salivales. El cortisol es el principal glucocorticoide producido por la zona fasciculada bajo control de ACTH, aumenta en la sangre la concentración de glucosa. Inhibe la absorción de glucosa en músculos, causando resistencia a la insulina en el tejido muscular y lipólisis en el tejido adiposo, lo que resulta en la liberación de ácidos grasos en la circulación.
La médula, a la manera de un gran ganglio simpático, es fuente de adrenalina y noradrenalina. (9)(15)
5.- Adrenarca.
La glándula suprarrenal humana experimenta, una reestructuración significativa durante el período neonatal y volverá a hacerlo en el período prepuberal. No se ha podido asignar un rol específico a las mínimas concentraciones de andrógenos en el período comprendido entre el nacimiento y la adrenarca. (16)
Ésta se define como el aumento de la producción de DHEA y DHEA-S que ocurre entre los 6 y 8 años, en ambos sexos, asociado a la emergencia morfológica y funcional de la zona reticular de la corteza suprarrenal; no acompañado por un aumento en la secreción de cortisol. La zona reticular es la más interna de la corteza, bordea la médula y está compuesta por cuerdas de células dispersas en diferentes direcciones dando el aspecto de un retículo o red. (7)(17)
La adrenarca representa una respuesta al aumento de la secreción de esteroides C19 por la zona reticular, años antes del aumento prepuberal de la secreción de esteroides gonadales. Se vincula a la aparición de vello axilar y púbico, olor sudoral, aumento de la grasitud en la piel, acné leve y está acompañada de una aceleración transitoria de crecimiento lineal y de la maduración ósea. (2)(18)(19) Podría tener un significado evolutivo especifico asociado a patrones de desarrollo neuronal particulares del ser humano y primates superiores. (6) Al respecto, existe debate acerca de si la adrenarca es un evento generalizado que ocurre en todos los primates. En 2012 Hornsby presenta su reseña con la visión clásica de que, más allá de los humanos, solo un limitado número de primates también presentan adrenarca. Por el contrario, Conley y col presentaron la evidencia emergente que la adrenarca está mucho más extendida entre primates no humanos, argumentan que la variable no es si ocurre, sino cuándo ocurre y la razón por la que a menudo se ha pasado por alto es que el período de “quiescencia” entre la regresión de la Zona Fetal y la aparición de la zona reticular podría estar tan cerca que puede superponerse y la DHEA circulante no desaparecer. Esto tendría una importancia directa para la progresión de las investigaciones. (20)
Este proceso es independiente de la activación del Factor Liberador de Gonadotrofinas (GnRH), las gonadotrofinas hipofisarias y la función ovárica (gonadarca) no siendo un requisito previo para que ésta tenga lugar. (17)(21)
El tejido suprarrenal representa un sistema de renovación celular en el que la remodelación estructural adaptativa se logra mediante un equilibrio entre la proliferación celular y la apoptosis. Sin embargo, la dinámica celular, es decir la citogénesis subyacente, al desarrollo posnatal de la zona reticular durante la adrenarca ha permanecido desconocido. (21)(22)
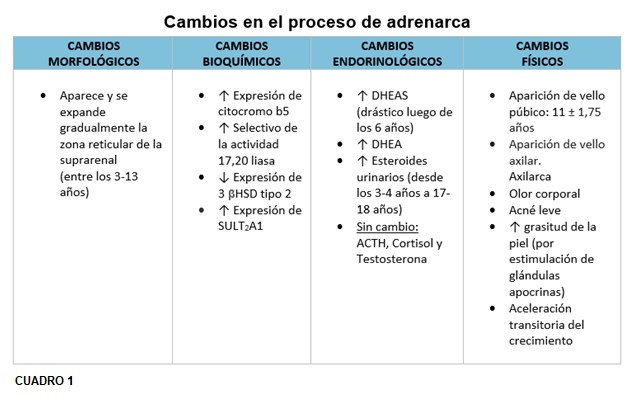
Si bien aún no se conocen los factores desencadenantes, nuestra comprensión de la adrenarca debe descansar sobre el conocimiento de los cambios morfológicos, bioquímicos, endocrinológicos y físicos que tienen lugar. Seguidamente nos referiremos a cada uno de ellos:
5.1 Cambios morfológicos.
La Zona Fetal desaparece en el transcurso del primer año de vida; la zona reticular se hace reconocible por primera vez hacia finales de los tres años de edad y alcanzará una mayor capacidad funcional para la secreción de andrógenos con la expresión de enzimas requeridas y especialmente del citocromo b5, un regulador bien conocido de la síntesis de andrógenos, este hecho que define a una zona reticular madura, ocurrirá paulatinamente. (19)La zona reticular es en teoría el equivalente morfológico y funcional de la Zona Fetal de la corteza suprarrenal.(7)
En el adulto las células reticulares son esencialmente similares en su patrón enzimático a las adrenocorticales del feto y en el alto nivel resultante de DHEA y DHEA-S. (5)
Hui y cols demostraron en su trabajo del estudio morfométrico e inmunohistoquímico que el grosor en el grupo de edad 13-20 años fue significativamente mayor que en el grupo de 4-12 años. Los autores describen que la expansión de la zona reticular comienza alrededor de los 4 años y es dependiente de la edad, pero que esto no resulta en un incremento significativo del grosor total de la corteza suprarrenal lo que sugiere que las primeras etapas de la adrenarca se relacionan con remodelación suprarrenal. (4)
Antes del inicio del desarrollo de la zona reticular, la corteza suprarrenal total es mas gruesa en el sexo femenino que en el masculino. Después del inicio de la pubertad, tanto el espesor total como el de la zona reticular tienden a exhibir un desarrollo mas rápido en el sexo femenino. Debido a que no encuentran diferencias significativas en los sexos en el grupo de 13-20 años, en el cual la zona reticular supera el 50% del grosor total, se sugiere una activa remodelación. (18)
Estudios inmunohistoquímicos sobre el desarrollo de las glándulas suprarrenales humanas, son consistentes con la teoría clásica de la zonificación impulsada por la migración celular, como comentamos antes, en este modelo cada zona deriva de un conjunto común de células progenitoras ubicadas por debajo de la corteza, que luego migra hacia adentro (migración centrípeta) y se diferencia para poblar las zonas corticales internas. Esta corriente centrípeta a lo largo del desarrollo puede contribuir al desarrollo de la zona reticular, zona que se considera de senescencia celular. Este proceso estaría, al menos en parte, bajo control hormonal. (18)(19) Dhom caracterizó los cambios morfológicos que ocurrieron en la suprarrenal prepuberal y puberal, según este estudio, la corteza suprarrenal del recién nacido muestra zonas glomerulosa y fasciculada. Alrededor de los tres años aparecen islas focales de zona reticular, que se expanden durante los 4-5 años. Una capa continua de zona reticular funcional se ve por primera vez a los 6 años y continúa expandiéndose hasta los 12-13 años. El grosor de la zona reticular es directamente proporcional a la producción de DHEA.(5)(4)(23)(24)
5.2.- Cambios bioquímicos.
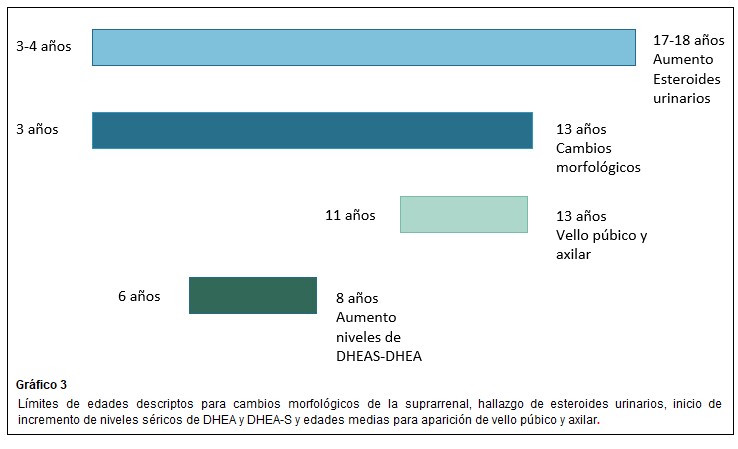
En la adrenarca se suceden cambios en el patrón de expresión de enzimas y cofactores que facilitan la producción de esteroides C19. La síntesis de DHEA y DHEA-S resulta directamente de la actividad 17,20 liasa, de la enzima 17 α hidroxilasa/17,20 liasa citocromo P450 en la zona reticular. El gen CYP17 que codifica para esta enzima microsómica es responsable de la mayor producción esteroidea C19 durante la adrenarca. Se cree que ésta es el resultado de un aumento selectivo en la actividad de 17,20 liasa. El citocromo b5, cuya expresión se incrementa durante la adrenarca, aumenta selectivamente la 17,20 liasa (esta favorece la vía Δ 5) sobre sobre la actividad de 17 α hidroxilasa. El citocromo b5 es un factor clave en el aumento de la secreción de andrógenos suprarrenales durante la adrenarca. Se sintetiza débilmente en todas las zonas suprarrenales de niños preadreanarcales y aumenta notablemente en la zona reticular después de los 5 años, estabilizándose a los 13 años.
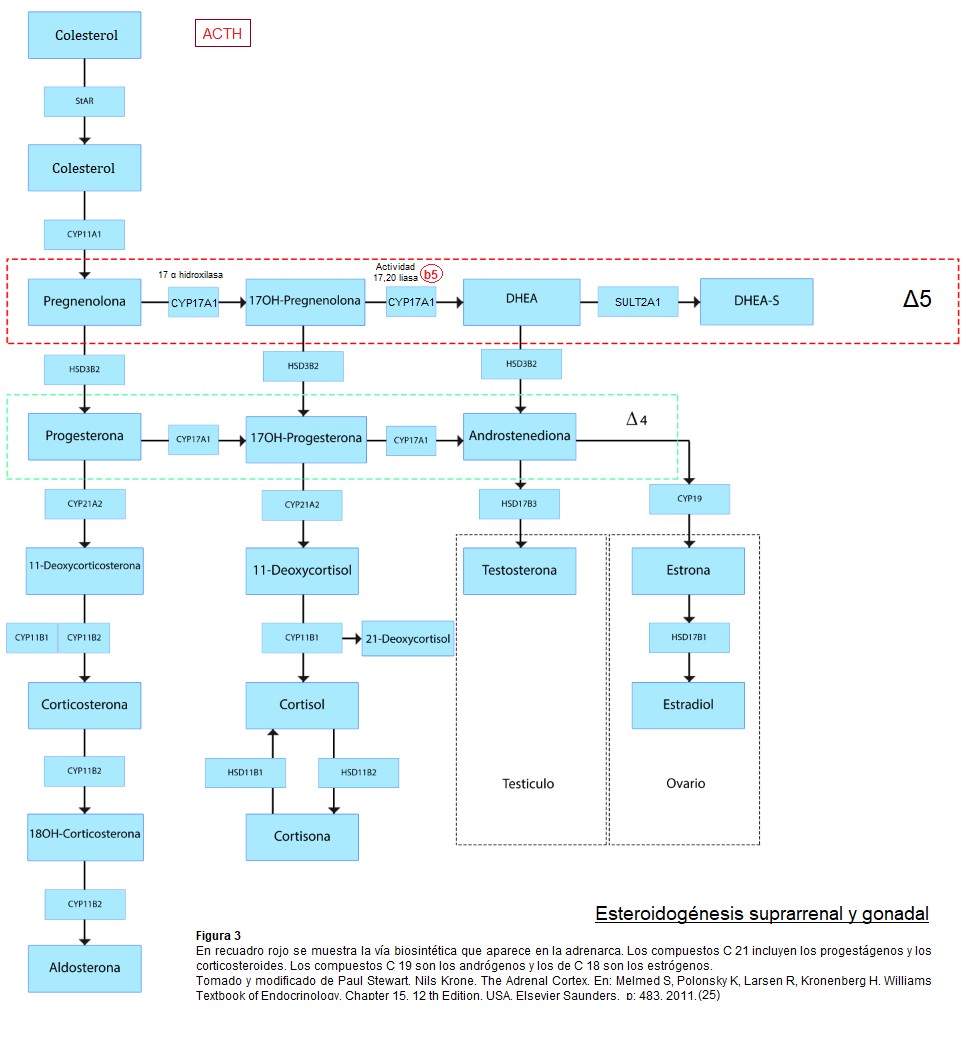
Las enzimas y proteínas cofactores son comunes a todas las zonas de la corteza, las clases específicas de esteroides producidos a partir de un precursor común, el colesterol, están regidos por la expresión de enzimas esteroidogénicas características de cada zona. La expresión de P450c17 en la zona reticular junto con niveles bajos de expresión de 3B HSD2 Δ 5/ Δ 4 isomerasa, sumado a un aumento en la expresión de la sulfotransferasa (SULT2A1) maximizan la producción de DHEA y DHEA-S. (7)(19)(5)
La SULT2A1 es muy perceptible en la zona reticular en las edades de 5-13 años y alcanzó una meseta a partir de entonces, confirmándose como un marcador de desarrollo de zona reticular. La enzima impide la transformación del débil andrógeno DHEA en andrógenos mas potentes. Tiene una amplia especificidad de sustrato, que incluye DHEA, pregnenolona y 17 OHPregnenolona. La sulfoconjugación de pregnenolona y 17OHpregnenolona impide el metabolismo por 3B HSD2 y CYP17 y por lo tanto su utilización como precursores de las vías biosintéticas de mineralocorticoides, glucocorticoides y andrógenos. (5)
Las células de la teca ovárica también expresan 3B HSD2, CYP17, citocromo b5. La SULT2A1 cataliza el paso final en la biosíntesis de DHEA-S y esta enzima se expresa a niveles altos en la glándula suprarrenal humana pero no en las gónadas. Este restringido patrón contrasta con todas las otras enzimas involucradas en la síntesis de DHEA, que se expresan tanto en la suprarrenal como en las gónadas. (4)(5)
Un proceso regulador clave en la biosíntesis de DHEA es el flujo de esteroides en la ruta Δ 5 en lugar de entrar a la ruta Δ 4. ( 5) Enzimas como 3B HSD2 y 21 hidroxilasa, también denominada P450c21, CYP21, normalmente actúa para disminuir la producción de DHEA a través de la competencia con P450c17 en el caso de 3B HSD2 y mediante la extracción de precursores esteroideos en el caso de P450c21.
La 3B HSD tipo 1 se expresa en hígado, piel, placenta y otros tejidos periféricos. La tipo 2 se expresa en suprarrenales y gónadas, es esencial para la producción de aldosterona y cortisol por la glomerulosa y fasciculada respectivamente. (7) Mutaciones de esta enzima causan una forma poco frecuente de hiperplasia suprarrenal congénita.(6)
La inmunoreatividad para 17B hidroxiesteroide deshidrogenasa tipo 5 (HSD17B5), una enzima importante en la conversión de esteroides sexuales, se hace discernible alrededor de los 9 años, con niveles más altos en la zona reticular que en la fasciculada de suprarrenales humanas en desarrollo. Esta enzima en tejidos diana puede convertir androstenediona en testosterona. (18)(5)
5.3.- Cambios endocrinológicos.
Como el aumento de los andrógenos suprarrenales sucede alrededor de dos años antes de la pubertad, la adrenarca ha sido sugerida como participante en la inducción puberal sin embargo se produce incluso en niños con disgenesia gonadal. (17)(21)(27)
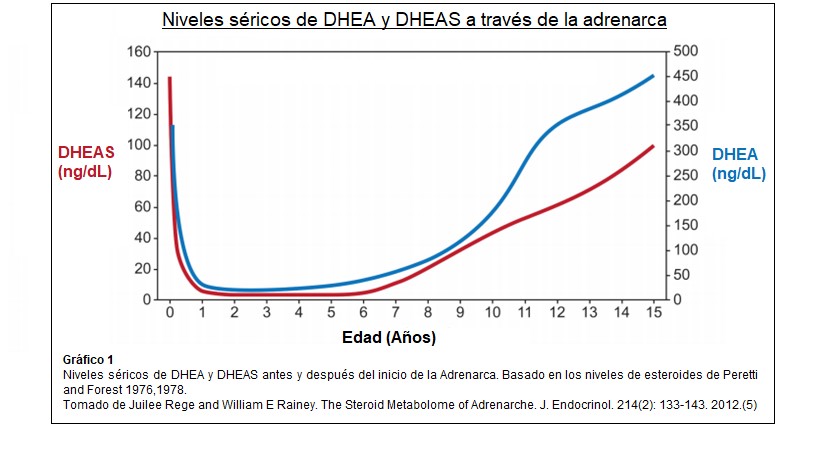
El aumento posnatal prepuberal de DHEA y DHEA-S circulante, comienza en la infancia (adrenarca bioquímica) y con un ascenso constante alcanzan su punto máximo entre la segunda y tercera década de la vida. Los niveles de DHEA aumentan de 5 a 10 veces. Disminuyen luego lenta y progresivamente a partir de entonces. (1)(19) Estudios recientes en mujeres han identificado un tercer pico transitorio de DHEA-S que coincide con la transición menopáusica. La disminución de los andrógenos con el envejecimiento se denomina adrenopausia, parece haber una reducción en el ancho de la zona reticular con “aging”, sin cambios generales en el ancho de la corteza suprarrenal. La adrenarca, marcaría entonces el inicio de un proceso que será luego reversible. (7)(28)
Como se mencionó antes, se desconocen los fenómenos fisiológicos que desencadenan la aparición de la adrenarca, sin embargo, las vías bioquímicas que conducen a este evento se han aclarado en detalle.
DHEA y DHEA-S son los marcadores característicos de la adrenarca, sus niveles plasmáticos disminuyen en los primeros años de vida y luego aumentan drásticamente después de los 6 años. Los altos niveles neonatales de DHEA y DHEA-S se relacionan con la Zona Fetal residual que retrocede durante el primer año y su aumento correlaciona con la expansión de la reticular. Los patrones de secreción de otros esteroides C19 también se han investigado pero con resultados variables como por ejemplo androstenediona, 11B Hidroxiandrostenediona y 3- α,17B diol glucurónido ( adiol G) por lo que la producción de andrógenos necesita más estudios y análisis.(5) El papel exacto de la secreción suprarrenal directa de testosterona sigue sin estar claro, no se modifica su nivel en la adrenarca, asimismo las concentraciones de cortisol y ACTH no cambian significativamente lo que indica que la adrenarca no es simplemente una activación global del eje hipófiso-adrenal.(4)
Se ha hallado una fuerte correlación positiva entre las concentraciones séricas de DHEA-S a la edad de un año y seis años. La concentración de DHEA-S a los seis años se correlacionó positivamente con la concentración de IGF I al año. (23)
Esteroides urinarios: DHEA y sus metabolitos 16 α-hidroxi DHEA, 3 β,16 α androstenediol y androstenediol muestran un incremento continuo desde 3-4 años a 17-18 años, observaciones que sugieren que la adrenarca es un proceso gradual que inicia a una edad temprana. Shi y col en 2009 confirmaron el uso de esteroides C19 como marcadores urinarios de adrenarca.(5)
La ACTH estimula la zona reticular pero sus productos no proporcionan una retroalimentación, como el cortisol. Aparentemente la ACTH jugaría un rol primariamente permisivo y obligado en la fisiología de los andrógenos adrenales.Parecería un sistema mal diseñado, a primeras vistas. Se ha propuesto la acción de un factor estimulante de andrógenos adrenales aún no identificado. (19)(26)
Hay evidencias de que la Hormona Luteinizante (LH) y la HCG podrían regular la síntesis de andrógenos independientemente de ACTH. Sin embargo, la regulación de la síntesis de andrógenos suprarrenales no se ha caracterizado completamente.
DHEA y DHEA-S son débiles andrógenos y sirven como proandrógenos es decir, como sustrato para la síntesis de andrógenos más potentes como la testosterona; y también de estrógenos, lo cual dependerá del nivel de expresión de diferentes enzimas y del metabolismo que exista en los tejidos blanco. (19)(16)
DHEA-S es el andrógeno mas importante secretado por la zona reticular de la adrenal, el grupo sulfato adicionado por la sulfoquinasa, exclusiva de esta zona suprarrenal, dá una molécula altamente soluble en agua. Es muy abundante y polar con una potencia androgénica del 5% respecto de la testosterona, hay además una limitada sulfatación extraadrenal. Su concentración plasmática correlaciona con 17 cetosteroides urinarios. Tiene una vida media de 9-11 hs y constituye el mejor indicador de adrenarca; niveles de este metabolito superiores a 40-50 ug/dl se consideran indicadores de su inicio. (24)(6)(29)
Es importante remarcar que solo DHEA puede ser sustrato para la conversión al resto de los esteroides, DHEA-S debe liberarse de su grupo sulfato ya sea en circulación o en el tejido efector por acción de la esteroide sulfatasa. DHEA tiene una vida media de 25 minutos. La GLAE o SHBG ( Sex Hormone Binding Globulin) y la albúmina se unen débilmente. Las concentraciones de DHEA siguen un patrón circadiano similar al del cortisol, su variación diurna constituye una preocupación metodológica a tener en cuenta para las investigaciones que abordan la relación entre esta hormona y la salud mental.
Los andrógenos suprarrenales reducen los niveles de SHBG. (24)(29)
Aún no existen valores de referencia para DHEA y DHEA-S que coincidan con las manifestaciones físicas lo cual se torna esencial para el desarrollo de algunas investigaciones. (30)(6)
DHEA (al igual que la A4 androstenediona secretada por la zona fasciculada) se comportará como proandrógeno en los siguientes tejidos: piel, músculo, tejido adiposo, hígado y cerebro.
En la unidad pilosebácea, DHEA se transforma en testosterona y ésta por acción de la 5 α reductasa en dihidrotestosterona (DHT) . La DHT se puede metabolizar en el hígado o piel a 3 α androstenediol, que será eliminado por el riñon como glucuronidato 3 α diol G. (29)
Como vemos, DHEA actúa en una variedad de tipos de células y receptores haciendo que sea difícil caracterizar un solo modo de acción. Recientemente, se han demostrado mecanismos no genómicos de acción y se han caracterizado algunos receptores ( entre ellos, el sigma1, el TrKa y el GCPR).
Tiene una amplia heterogeneidad de efectos fisiológicos; en la función inmune, endotelial, en la sexualidad, en el estado de ánimo y cognición, en el desarrollo cortical y conectividad cortical-limbica y en la toma de perspectiva antes del inicio de la maduración reproductiva, un rasgo útil para una especie con vinculación de pareja.(28) Agregaremos aquí, que los cambios hormonales y neurobiológicos durante la pubertad hacen de este período de la vida un período sensible en términos de riesgo de problemas de salud mental. Hay una cantidad limitada de literatura que examina la asociación entre el desarrollo adrenal y la estructura o función cerebral, sin embargo, se ha propuesto que la adrenarca cumple un propósito evolutivo para que los humanos extiendan el desarrollo del cerebro y promuevan la sinaptogénesis para el aprendizaje social que es necesario a partir de esta edad. De hecho, hay evidencia que sugiere que las hormonas adrenales pueden ser factores claves en el desarrollo del cerebro durante la transición a la edad adulta temprana. Por ejemplo, la investigación en animales ha demostrado que DHEA y DHEA-S estimulan el crecimiento de neuronas y la neurogénesis. Existe también producción de DHEA y S-DHEA en el cerebro (“neuroesteroides”).(6)(28). El porcentaje de grasa corporal correlaciona positivamente con las concentraciones séricas de DHEA-S.(31). Campbell postula que una mayor ingesta de proteínas animales conduce a un aumento de IGF I por el hígado, éste aumentaría la producción de energía mitocondrial dentro de neuronas y de la zona reticular y con ello una mayor producción de DHEA y DHEA-S. (28)(31)
5.4.- Cambios físicos.
El sello fenotípico de la adrenarca es el vello axilar y púbico (adrenarca clínica). Los andrógenos bioactivos convertidos periféricamente también estimulan el desarrollo de las glándulas apocrinas en la piel para producir un olor corporal característico de tipo adulto y pueden actuar sobre las glándulas sebáceas, lo que lleva a iniciar signos de acné. (5) En las niñas prepúberes son las suprarrenales, las fuentes de andrógenos antes de la gonadarca (posteriormente se agregaría el ovario). Alrededor de los 8 años, hay suficiente conversión periférica de andrógenos suprarrenales en testosterona y DHT para estimular el crecimiento del vello axilar y púbico. Entre los 6 y 7 años puede ocurrir también una aceleración transitoria del crecimiento aproximadamente 1,5 cm/año en ambos sexos, se explicaría en parte, por la regulación genética del crecimiento. (16)
La edad promedio de la telarca (aparición del botón mamario) en nuestro país es de 10.8 años +-1,27 (+-D.S.) mientras que la edad de comienzo de desarrollo de vello pubiano ( pubarca- Estadío II de Marshall y Tanner para desarrollo de vello pubiano)) es de 11 +-1,75 (+-D.S.). El desarrollo de vello axilar (axilarca) es un fenómeno tardío en la serie de hechos puberales, haciendo su aparición dos años luego de la pubarca y frecuentemente en la posmenarca (edad de la menarca 12,53 años +- 1,22 (+-D.S.) completándose bastante tiempo después de ella. La duración promedio de desarrollo de vello pubiano es entre 2.7-3.6 años. (30)
El vello pubiano casi siempre aparece en forma coincidente con la telarca ó un poco después, cualquiera de los dos puede ser el primer signo clínico de comienzo puberal. (27).
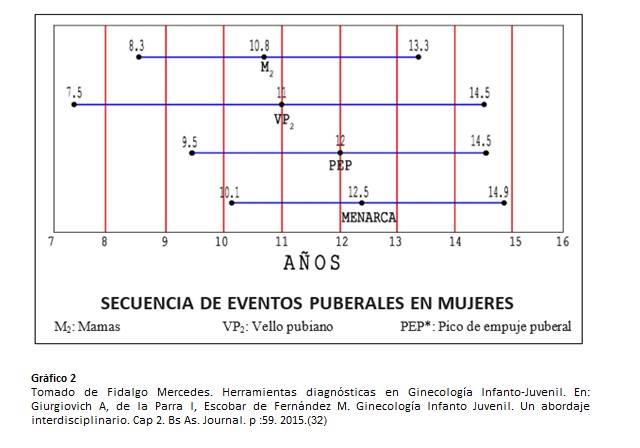
La aparición de los caracteres sexuales secundarios: telarca, pubarca, axilarca, el aumento en la velocidad de crecimiento y los cambios en la distribución de la grasa corporal caracterizan los cambios físicos de la pubertad. (27)
Las regiones dependientes de andrógenos varían en su sensibilidad a los mismos, siendo la regiones de vello axilar y púbico las más sensibles. (4)
Es importante destacar que los cambios físicos externos asociados con la adrenarca pueden no ser objetivados hasta mucho tiempo después que haya comenzado el aumento de las hormonas adrenales, inclusive hasta la gonadarca. (6) En la mujer la acción sinérgica de andrógenos suprarrenales y ováricos es responsable del desarrollo de caracteres sexuales. (29)
6. Regulación de la síntesis de andrógenos suprarrenales
La glándula adrenal será la mayor fuente de andrógenos en la mujer. El precursor común para la síntesis de esteroides es el colesterol, cerca del 80% proviene de la circulación captado como lipoproteínas transportadoras de colesterol de baja densidad (LDL); se puede generar por síntesis de novo a partir de acetil-CoA y también el colesterol HDL puede ser utilizado a través del receptor de barrido clase B tipo 1 ó en gotas citoplasmáticas en forma de ésteres de colesterol que actúan a modo de reservorio intracelular
En la biosíntesis de esteroides la regulación se produce en el primer paso: la conversión de colesterol en pregnenolona por CYP11A citocromo P450, enzima de escisión de cadena lateral de colesterol, que realiza este primer paso común a todas las células que sintetizan hormonas esteroideas: regulación cuantitativa crónica.(33) Este complejo enzimático se encuentra en la membrana interna de la mitocondria y su actividad podría estar implicada en la génesis de la adrenarca prematura o exagerada.(4)
En la regulación aguda, el paso limitante está mediado por la proteína StAR que facilita la rápida afluencia de colesterol en la mitocondria, donde reside la P450scc. La deficiencia de esta proteína causa una rara forma de hiperplasia suprarrenal congénita. (26)
La regulación cualitativa, que determina el tipo de esteroide producido en una célula, tiene lugar principalmente en el P450c17- CYP17. En ausencia de P450c17 en la zona glomerulosa, se producen esteroides desoxi-C21, lo que lleva a la via mineralocorticoidea, con síntesis de aldosterona. En presencia de la 17- α hidroxilasa, pero no de 17,20 liasa en la zona fasciculada, se producen esteroides C21, lo que lleva a la vía glucocorticoide, con síntesis de cortisol.
Cuando tanto la 17 α hidroxilasa como la 17,20 liasa están presente en la zona reticular, se produce el precursor de andrógenos DHEA y también A4 androstenediona. En la adrenarca se activa esta vía.
No está definido un mecanismo de feedback negativo que regule la homeostasis de andrógenos en la mujer. (32)
7.- Control de la adrenarca.
La determinación del factor de control de la adrenarca todavía necesita mas investigación. La ACTH se ha considerado como un mediador primario aceptado de adrenarca durante las últimas décadas. Claramente, la supresión con dexametasona de andrógenos suprarrenales sugiere un papel regulador para ACTH. Los niños con defectos del receptor de ACTH no experimentan adrenarca, apoyando así el postulado de que la ACTH juega un papel esencial en este fenómeno, asimismo aquellos pacientes con deficiencia de ACTH tienen niveles no detectables de DHEA-S. Sin embargo, varios estudios han demostrado que los niveles de ACTH y cortisol permanecen constantes con el aumento de andrógenos, durante la adrenarca. Esto, se debe en parte al estricto sistema de retroalimentación reguladora entre ACTH y cortisol, que mantiene sus niveles dentro del rango fisiológico durante toda la vida en comparación con la DHEA y otros esteroides C19 que no tienen un sistema claro.
Niveles plasmáticos de péptidos relacionados con propiomelanocortina (POMC) como B lipotropina y B endorfina se correlacionaron con niveles crecientes de S-DHEA durante la adrenarca. En 1980, Anderson postuló que se desencadena a través de un mecanismo que involucra el aumento de los niveles intradrenales de cortisol asociados con el crecimiento de la glándula. Majzoub y Topor proponen que el aumento en la secreción de DHEA es causado por el aumento en la producción de cortisol que ocurre durante el crecimiento de la infancia y la adolescencia El inicio del crecimiento infantil conduce a una ligera caída en la concentración de cortisol en suero debido a la dilución inducida por el crecimiento, en respuesta la ACTH aumenta y estimula el aumento de la concentración intradrenal de cortisol el cual inhibe competitivamente la conversión mediada por 3 BHSD2 de 17- αOH-pregnenolona a cortisol, caída subsecuente de cortisol sérico con aumento adicional de ACTH. También se reduce la actividad enzimática en la conversión de DHEA a androstenediona, provocando un aumento de DHEA suprarrenal y DHEA-S en relación con androstenediona. La obesidad infantil puede acelerar este proceso al causar un aumento patológico en el tamaño corporal que desencadena estos mismos procesos a una edad mas temprana, lo que resulta en la aparición prematura de adrenarca.
Estos autores, encuentran, sobre cultivos de células suprarrenales humanas que el cortisol estimula la secreción de DHEA de una manera dependiente de la dosis a concentraciones mayores o iguales a 50Um y una disminución en la secreción de androstenediona. La secreción de DHEA se produjo 30 minutos posteriores a la adición de cortisol lo que sugiere que este efecto no estaría mediado por un mecanismo transcripcional y por lo tanto es no dependiente del receptor de glucocorticoides, sino por una interacción directa con la enzima en la vía biosintética de andrógenos suprarrenales. La adrenarca es concebida entonces como un estado de deficiencia leve y fisiológica de 3B HSD 2, con activación secundaria del eje pituitario-suprarrenal: el aumento de ACTH podría ser responsable del crecimiento del tamaño de la zona reticular durante la adrenarca. (5)(1)(23)
Dickerman y col, Byrne y col confirmaron que hubo aumentos dependientes de la edad en las concentraciones intraadrenales de varios esteroides C19 y C21 y podrían inhibir la 3B HSD2 y promover el metabolismo de 17 OH pregnenolona a DHEA en la adrenarca. No obstante, los niveles de DHEA-S, son altos durante la adrenarca de niños con hiperplasia suprarrenal congénita no tratada, donde los niveles de cortisol intraadrenal deberían ser bajos. El IGF I al igual que la insulina cumple un papel en la regulación de la glucosa, promueve la capacidad oxidativa y está asociado con el metabolismo de las proteínas, proliferación y diferenciación celular. El IGF I y II pueden actuar por estimulación autocrina, paracrina o endocrina. Se cree que en la suprarrenal mejoran la supervivencia de las células migratorias. Niveles más altos de IGF I durante el período formativo de la glándula suprarrenal, antes de los 6 años en que se establece la zona reticular puede conducir a un aumento del número de células progenitoras que alcanzan la zona reticular.
Mientras que el IGF I es mediador de muchas de las acciones somatotróficas de la Hormona de Crecimiento (GH), el IGF II participa de la regulación del desarrollo fetal. Ambos estimulan la actividad esteroidogénica de P450c17 y de la 3B HSD por lo que podrían estimular los mecanismos posnatales de proliferación y migración de células progenitoras suprarrenales. (5)(28)
Hay algunas evidencias de que el sistema GH-IGF y la insulina serían reguladores de la producción de andrógenos post-adrenarca. Sin embargo, hay pocos estudios in vivo sobre las implicancias de la insulinoresistencia y el sistema GH-IGF en la regulación de la secreción de andrógenos durante la adrenarca. Bloch y col encontraron que hay mayor resistencia a la insulina y que había correlación inversa entre la sensibilidad a la insulina y los niveles de DHEA-S, Caprio y col no encontraron relación entre los niveles de DHEA-S y la sensibilidad a la insulina en sujetos prepuberales y adolescentes de ambos sexos. En niñas, Guercio y col hallaron una correlación negativa significativa entre la DHEA-S y la sensibilidad a la insulina durante la prepubertad y pubertad y una positiva entre DHEA-S e IGF-I en período prepuberal, sugiriendo que el eje GH-IGF es una señal importante que regula los cambios madurativos de la adrenal durante la adrenarca.(7)
Concentraciones altas de estradiol son capaces de estimular la producción de DHEA y DHEA-S en cultivos de células de suprarrenal fetal humana.El mecanismo de acción parece una inhibición directa de la actividad enzimática de 3B HDS2 por los altos niveles de estrógenos. Sin embargo, los niños con disgenesia gonadal tienen un aumento normal de DHEA-S con la edad cronológica. Mas aún, no hay diferencias sexuales significativas en la edad de la adrenarca, sugiriendo que los estrógenos no serían un factor mayor. Es interesante que se describió la presencia de expresión de aromatasa en glándulas suprarrenales humanas prepuberales y puberales.
In vitro, la leptina aumenta la actividad de 17,20 liasa de la enzima P450. Recordemos aquí que esta hormona, secretada por el tejido adiposo aumenta paulatinamente con el peso corporal a partir de los 5-6 años.
El control integrado de la función adrenocortical incluye interacciones corticomedulares, el aporte vascular de la glándula, el estímulo neural, el sistema inmune, factores de crecimiento entre los que se destacan el Factor de Crecimiento Fibroblástico Básico (FGF), el Factor de Crecimiento Transformante (TGF), la interluekina 6 (IL-6), el Factor de Necrosis Tumoral (TNF), así como señales provistas por el microambiente extracelular. A pesar de décadas de investigación, el desencadenante de la adrenarca sigue siendo desconocido y muy probablemente sea el resultado de varios factores. (7)(27)
8.- Alteraciones de la adrenarca. Relación con eventos pre y posnatales
No se produce adrenarca en la deficiencia familiar de glucocorticoides debido a defectos en el receptor de ACTH (el receptor de melanocortina tipo 2 media los efectos de la ACTH en la zona reticular) y en niños con hipopituitarismo. (33)
Se define adrenarca prematura a la elevación de andrógenos suprarrenales por encima de valores prepuberales bajos normales, que responde a una maduración temprana de la corteza suprarrenal y se acompaña de signos androgénicos antes de los 8 años en las niñas y 9 en los niños. Esta elevación no debe corresponder a condiciones tales como pubertad precoz, tumores virilizantes ováricos o suprarrenales, defectos congénitos enzimáticos de la esteroidogénesis ó fuente exógena de andrógenos, por lo que es un diagnóstico por exclusión, y no vá acompañada de una clara aceleración del crecimiento. El término adrenarca “exagerada” generalmente se refiere a adrenarca prematura con niveles de andrógenos mas altos de lo esperado para la etapa Tanner de vello púbico, pero algunos autores lo han utilizado como sinónimo de adrenarca prematura. Las concentraciones circulantes de DHEA-S que exceden los valores de referencia de pubertad tardía (222 ug/dl) indicarían adrenarca “exagerada”. (30)(34)
Cuando los caracteres sexuales aparecen de forma precoz, pero aislada, se hace referencia a formas de pubertad precoz incompletas. Estos cambios pueden permanecer estables e, incluso retroceder para presentar una pubertad verdadera en forma y tiempo normales o, por el contrario, progresar hacia algunas de las formas de pubertad precoz verdadera. Estas variantes incluyen: telarca precoz aislada, menarca precoz aislada y a la pubarca precoz aislada. Pubarca precoz aislada es un término clínico usado para describir la aparición de vello pubiano antes de los 8 años en las niñas/9 en los niños, en ausencia de otros signos clínicos de pubertad, puede ir acompañada de axilarca, acné leve y olor corporal apocrino. Se clasifica según su etiología/evolución natural en: adrenarca prematura o exagerada, pubarca precoz idiopática, formas no clásicas de hiperplasia suprarrenal congénita, enfermedades virilizantes, iatrogenia por tratamientos médicos, pubertad precoz verdadera. (30)(34)(35)(36)
En 1989, David Barker relacionó el bajo peso al nacer con mayor riesgo de muerte por enfermedad cardiovascular en la sexta década de la vida. Posteriormente, el mismo grupo de investigadores propuso el término fenotipo ahorrador para referirse a los mecanismos de adaptación que pone en marcha el feto para sobrevivir en condiciones adversas y que determinan que gran cantidad de órganos y sistemas corporales se conviertan en resistentes a la acción de la insulina. Una vez que se encuentran fuera del ambiente materno, si las condiciones adversas desaparecen, los portadores de este fenotipo ahorrativo, independiemente de la causa que determinó el RCIU, tendrían mayor riesgo de desarrollar el síndrome metabólico. Estas observaciones sugieren que los patrones de secreción y sensibilidad hormonales establecidos en la vida intrauterina determinan algunos transtornos endocrinológicos en la vida posnatal y que el crecimiento compensador rápido y exagerado favorece su manifestación e intensidad. (4)(33)(37)
Efectivamente, evidencias crecientes de estudios epidemiológicos indican que eventos que tienen lugar en épocas tempranas del desarrollo humano, tales como el bajo peso al nacer podrían influenciar el desarrollo de varias alteraciones del adulto, tales como la distribución central de la masa grasa, resistencia a la insulina, síndrome metabólico, diabetes tipo II, hipertensión arterial enfermedad vascular isquémica e hiperandrogenismo ovárico.
La obesidad es más frecuente en niñas con pubarca precoz y la correlación entre los niveles de DHEA-S y los índices de adiposidad sugiere que el sobrepeso podría influenciar el momento de la aparición de la adrenarca. Se encontró en niños normales que hay un mayor nivel de DHEA-S urinario durante el período de mayor incremento de índice de masa corporal. Estos efectos pueden ser debidos a un aumento de insulina y leptina. (7)(33)
Además existen estudios que muestran que, a menor edad de adrenarca, mayor riesgo de problemas de salud mental en la vida adulta. (6)
Dentro de las consecuencias del RCIU se pueden presentar complicaciones en el crecimiento longitudinal, el desarrollo cognitivo y el ritmo puberal. Los pequeños para la edad gestacional (PEG) presentan con mayor frecuencia adrenarca exagerada. Las niñas PEG que realizan un crecimiento compensador posnatal rápido y exagerado (“catch up”), sobre todo de peso, presentan con mayor frecuencia pubarca precoz, pubertad adelantada rápidamente evolutiva y menarca adelantada en 8-10 meses, lo cual puede reducir la talla final. Estas pacientes presentan ya en edad prepuberal resistencia a la insulina, dislipidemia y exceso de grasa de predominio central y visceral, incluso sin obesidad, que está acompañada por alteraciones en los niveles de proteínas producidas por el tejido adiposo y por marcadores de inflamación (disminución de adiponectina total, aumento de leptina y proteina C reactiva ultrasensible, el activador del plasminógeno-1 y TNF α, entre otros). Al parecer estas alteraciones están determinadas por la resistencia a la insulina que, a su vez, parece que desempeña un papel importante en el desencadenamiento tanto de la pubarca precoz como de la pubertad adelantada y, posteriormente en la adolescencia, de hiperandrogenismo ovárico y reducción de la frecuencia ovulatoria. La adrenarca prematura y el síndrome de ovarios poliquísticos, podrían ser la expresión de un mismo transtorno subyacente. Estudios prospectivos y longitudinales demuestran que la resistencia a la insulina en el niño PEG puede estar presente de forma precoz, incluso al año de vida. Tanto la insulina como el IGF I estimulan la producción de andrógenos por las células teca intersticiales e incrementan la esteroidogénesis y la respuesta de ACTH en células de la corteza adrenal, por estímulo de la 17,20 liasa. (3)(7)(24)(33)(37)(38)

9.- Discusión.
Durante la vida intrauterina, las suprarrenales fetales aportan, entre otros precursores, al DHEA-S prioritariamente, que será destinado a la formación de estrógenos cuya función será producir un aumento del flujo sanguíneo utero-placentario.(10)(13) En cambio durante la adrenarca, los precursores estarán destinados sobre todo a la conversión de andrógenos más potentes, considerándose la aparición de vello pubiano como el sello fenotípico de la adrenarca. Estas observaciones nos permiten observar inicialmente una función relacionada a la nutrición y mantenimiento del embarazo, de hecho son los primeros productos de la suprarrenal fetal y más tarde, el proceso adrenarcal contribuirá a la adquisición de los caracteres sexuales secundarios.(5)(16)
La adrenarca ocurre en promedio dos años antes de la activación del eje gonadal, considerándose ambos procesos independientes (17). Pero antes del inicio de la pubertad, el eje se activa temporalmente en otros dos períodos de la vida: en el feto, hacia la mitad de la gestación y en el recién nacido: la llamada “minipubertad”, con altos niveles de gonadotrofinas y esteroides sexuales principalmente durante los primeros 3 a 6 meses de vida debido a la progresiva disminución de la retroalimentación negativa ofrecida por los estrógenos placentarios. (40). ¿Qué sucede mientras tanto con la producción de andrógenos adrenales? Se sucede una caida progresiva en la producción de DHEA y DHEA-S por apoptosis de la Zona Fetal que se completa alrededor del tercer mes de vida posnatal. (7)
Los estrógenos placentarios que mantienen el eje hipotálamo-hipófiso-gonadal (HHG) fetal inhibido, proceden como se describió anteriormente de precursores androgénicos suprarrenales principalmente de origen fetal. De esta forma podríamos inferir una función indirecta de “freno” del eje HHG durante la vida fetal por los productos de secreción de la Zona Fetal.
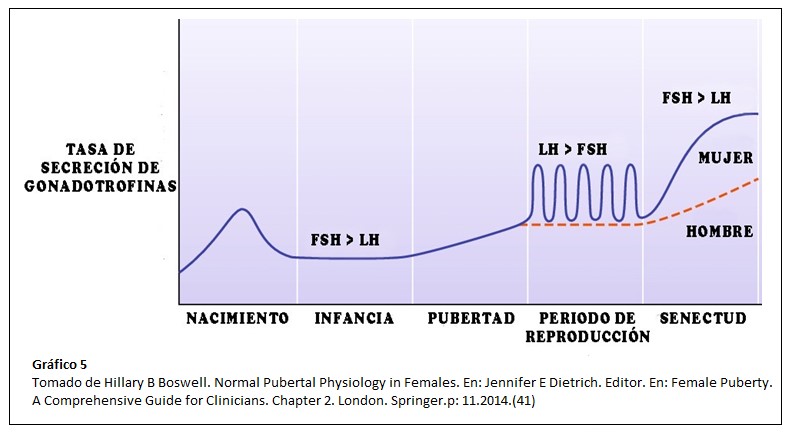

La adrenarca tanto como la pubertad no deben considerarse como nuevos procesos orgánicos, sino más bién como el despertar de sistemas ya desarrollados durante la vida fetal. (3)Es posible que las condiciones metabólicas y reservas energéticas jueguen un rol clave en el inicio y regulación de ambos procesos.
Se necesitan más investigaciones longitudinales desde los cinco años hasta la gonadarca para determinar la edad promedio, el rango y las diferencias individuales asociadas con el inicio de adrenarca. Actualmente no hay consenso sobre “un punto final” de la adrenarca, el aumento gradual de las hormonas adrenales termina en la edad adulta temprana, pero es posible que el período sensible de desarrollo neurobiológico culmine mucho antes. (6)
Llegados a este punto, nos surgen los siguientes interrogantes: ¿podría interpretarse la adrenarca como un estado hiperandrogénico fisiológico y transitorio cuyo propósito no se encuentra íntegramente develado?
¿Representa en realidad una fase temprana del desarrollo puberal, ya que algunas de sus manifestaciones clínicas aparecen durante aquel?
¿Un mayor conocimiento del metabolismo esteroideo de la suprarrenal nos aportaría una mayor comprensión de este proceso?
10.- Comentarios finales. -
Resulta interesante que las glándulas suprarrenales comparten en su origen, un linaje celular común con células secretoras de esteroides en las gónadas y de hecho utilizan las mismas enzimas en los pasos iniciales de la esteroideogénesis.
Si bien la adrenarca es entendida como el inicio del aumento en la producción de DHEA y DHEA-S que ocurre entre los 6-8 años, éste se halla asociado a cambios morfológicos de la zona reticular que se inician alrededor de los 4 años, mientras que el sello fenotípico de la adrenarca, el vello pubiano, aparece mucho más tarde, a una edad promedio de 11 +-1,75 años. De manera que consideramos que la adrenarca, definida como un evento endocrinológico puntual, forma parte en realidad, de un proceso maduracional más extenso en el tiempo, que opera lenta, gradualmente y que involucra un cambio funcional-bioquímico, a fin de maximizar la producción de los mencionados marcadores androgénicos cuyos efectos aún requieren mayor investigación, así como el metabolismo en los tejidos diana.
Si bién muchas “piezas” permanecen esquivas, en este “rompecabezas” de factores iniciadores y reguladores, la disregulación de la adrenarca conlleva un potencial riesgo de impacto en la función gonadal y es posible que, como sostiene Conley y col, futuras evidencias nos lleven a preguntarnos si nuestra definición y comprensión actual de este proceso permanecen óptimas.
REFERENCIAS
- Joseph A. Majzoub; Lisa Swart Topor. A New Model for Adrenarche: Inhibition of 3BHSD2 by Intraadrenal Cortisol. Horm Res Paediatric.2018; 89(5):311-319.
- Yewei Xing, Antonio Lerario,William Rainey,Gary Hammer. Development of Adrenal Cortex Zonation. Endocrinol Metab Clin North Am.2015; 44(2):243-274.
- Sarantis Livadas and George P. Chrousos. Molecular and Environmental Mechanisms Regulating Puberty Initiation: An Integrated Approach. Frontiers in Endocrinology. 2019.10:828.
- Richard Auchus y William E Rainey. Adrenarche-phisiology, biochemistry and human disease. Clinical Endocrinology.2004.60:288-296.
- Juilee Rege and William E. Rainey. The Steroid Metabolome of Adrenarche. Endocrinol.2012; 214(2):133-143.
- Michelle L Byrne, Sarah Whittle, Nandila Vijayakumar, Meg Dennison, Julian G. Simmons, Nicholas B. Allen. A systematic review of adrenarche as a sensitive period in neurobiological development and mental health. Dev Cogn Neurosci.2017.25:12-18.
- Alicia Belgorosky, María Sonia Baquedano, Gabriela Guercio, Marco A. Rivarola. Adrenarche: Postnatal Adrenal Zonation and Hormonal and Metabolic Regulation. Hormone Research.2008; 70: 257-267.
- Moore K, Persaud T. El aparato genitourinario-Desarrollo de las glándulas suprarrenales. En: Moore K, Persaud T. Embriología Clínica. El desarrollo del ser humano; capítulo 13, 7 edición: 304-306.
- Claudimara Ferini Pacicco Lotfi, Jean Lucas Kremer, Barbara Dos Santos Passaia, Isadora Pontes Cavalcante. The human adrenal cortex: growth control and disorders. Clinics.2018;73(suppl 1):e473s.
- Jaffe Robert B. Fisiología endocrina del feto y de la unidad fetoplacentaria. En: Yen/Jaffe. Endocrinología de la reproducción. Fisiología, fisiopatología y manejo clínico. Cap 25. 3 edición. Buenos Aires. Editorial Médica Panamericana.1993:916-946.
- Mehul Dattani, Peter Hindmarsh, Delber Fisher. Endocrinology of Fetal Development. En: Williams Textbook of Endocrinology. Cap 22.12th Edition. Elsevier Saunders. USA. 2011.
- M.Rodriguez Cortés, H. Mendieta-Zeron. La placenta como órgano endocrino compartido y su acción en el embarazo normoevolutivo. Revista de Medicina e Investigación.2014. Volumen 2. N 1 pag 28-34.
- S.C. Yen. Evaluaciones endocrinas y otras del medio ambiente fetal. Endocrinología del embarazo. En: Creasy-Resnik. Medicina Materno Fetal. Principios y Práctica. Capitulo 9. Bs. As. Editorial Médica Panamericana.1987:346-375.
- Sam Mesiano. The Endocrinology of Human Pregnancy and Fetal Placental Neiroendocrine Development. En: Yen & Yaffe Reproductive Endocrinology. Physiology, Pathophysiology and Clinical Management. Chapter 12. Seventh Edition. 2014: 243-271.
- Adina F. Turcu and Richard J. Auchus. Adrenal Steroidogénesis and Congenital Adrenal Hyperplasia. Endocrinol. Clin North Am. 2015;44(2):275-296.
- Martínez María Inés. Fisiología de los andrógenos en la niña y durante la pubertad. Revista SAEGRE. Volumen XVII .N 2. 2010:42-48.
- Dora Daldevich. Alejandra Julia Giurgiovich. Fisioneuroendocrinología de la pubertad. En: Avances en Endocrinología Ginecológica y Reproductiva.SAEGRE. Capítulo 1. Bs As. Editorial Ascune.2012:130-133-
- Xiao-Gang Hui, Jun Ichi Akahira, Takashi Suzuki, Masaki Nio, Yasuhiro Nakamura, Hiroyoshi Suzuki, William E Rainey and Hironobu Sasano. Development of the human adrenal zona reticularis: morphometric and inmunohistochemical studies from birth to adolescence. Endocrinol 2009 203(2):241-252
- J. Conley, B.C. Moeller, A.D Nguyen, S.D. Stanley, T.M Plant and D.H. Abbot. Defining Adrenarche in the Rhesus Macaque (Macaca Mulata), Non-human Primate Models for Adrenal Androgen Secretion. Mol Cell Endocrinol.2011;336(1-2):110-116.
- Ian Bird M. In the zone: understanding zona reticularis function and its transformation by adrenarche. Endocrinol 2012.214(2):109-11.
- Helmut G. Dörr, Theresa Penger, Michaela Marx, Manfred Rauh, Patricia G. Oppelt and Thomas K.M. Völkl. Adrenarche and Pubarche in girls with Turner síndrome during growth-promoting therap y whith human growth hormone. BMC Endocrine disorders. 2019 19:9.
- Peter Hornsby. Adrenarche: a cell biological perspective. Thematic Review. Journal of Endocrinology. Society for Endocrinology .2012. 214:113-119.
- Jani Liimata, Jarmo Jääskeläinen, Anne M. Karvonen, Sami Remes, Raimo Voutilainen and Juha Pekkanen. Tracking of serum DHEAS concentrations from age 1 to 6 years. A Prospective Cohort Study. Vol, 4 ISS2. 1-11.
- Lourdes Ibañez, Joan Dimartino Nardi, Neus Potau and Paul Saenger. Premature Adrenarche-Normal Variant or Forerunner of Adult Disease. Endocrine Reviews. 21(6):671-696
- Paul Stewart. Nils P. Krone. The adrenal cortex. En: Williams Textbook of Endocrinology. Chapter 15. 12 th Edition.2011.p 483
- I. Labarta Aizpún y A. de Arriba Muñoz. Hiperplasia Suprarrenal Congénita. En: Endocrinología Pediátrica. Manual Práctico. Capítulo 16. Madrid. Editorial Médica Panamericana.2013:183-194.
- Lucía Katabian. Características del crecimiento y desarrollo puberal: Perfil hormonal en infancia y adolescencia. En: Ginecología Infanto-Juvenil.Un abordaje interdisciplinario. Sociedad Argentina de Ginecología Infanto-Juvenil.2. 2. Buenos Aires. Ediciones Journal.2015: 30-37
- Benjamín Capmbell. DHEAS and Human Dvelopment: An Evolutionary Perspective. Frontiers in Endocrinology. Hypothesis and Theory.2020.11:101.
- Marta Cortelezzi. Andrógenos adrenales y ováricos. Síntesis, acción, biodisponibilidad y metabolismo. En: Avances en Endocrinología Ginecologica y Reproductiva. SAEGRE. Capítulo 5. Buenos Aires. Editorial Ascune.2012:71-78.
- María Eugenia Escobar. Horacio Domené. Fisiología Puberal. En: Ginecología Infanto-Juvenil. Zeiguer. Capítulo 21. Buenos Aires. Editorial Médica Panamericana.1987:252-265.
- Aino Mäntyselka, Jarmo Jääskeläinen, Aino-Maija Eloranta, Juuso Väistö, Raimo Voutilainen, Ken Ong, Soren Brage, Timo A. Lakka, Virpi Lindi. Associatios of lifestyle factors wtih serum dehidroepiandrosterone sulfate and insulin like growth factor 1 concentration in prepubertal children. Clin Endocrinol (Oxf).2018;88(2):234-242.
- Mercedes Fidalgo. Herramientas diagnósticas en Ginecología Infanto-Juvenil. En: Ginecología Infanto Juvenil.Un abordaje interdisciplinario. Sociedad Argentina de Ginecología Infanto Juvenil.2.5. Buenos Aires. Ediciones Journal.2015:49-62.
- Fenili Cecilia. Aspectos bioquímicos de los andrógenos en la adolescencia: madurez sexual. En: Ginecología Infanto Juvenil. Un abordaje interdisciplinario. Sociedad Argentina de Ginecología Infanto Juvenil. 5.4. Buenos Aires. Ediciones Journal. 2015: 288-299.
- Pauliina Utriainen, Saila Lookso, Jani Liimata, Jarmo Jääskeläinen, Raimo Voutilainen. Premature Adrenarche –A Coomon Condition with Variable Presentation. Horm Res Pediatr. 2015;83:221-231.
- Manouk Bakes, Nitash Zwaveling-Soonawala en Gerdine A. Kamp. Premature Pubarche is niet altijd onschuldig. Ned Tijdschr Geneeskol.2012;156: AS147.
- A.Fuentes Castelló y F. Vargas Torcal. Pubertad Precoz y Pubertad Adelantada. En: Endocrinología Pediátrica. Manual Práctico. Capítulo 5. Sociedad Española de Endocrinología Pediátrica. Madrid. Editorial Médica Panamericana. 2013:59-68.
- Ibañez Toda y M.V. Marcos Salas. El niño pequeño para su edad gestacional. En: Endocrinología Pediátrica. Manual Práctico. Capítulo 2. Sociedad Española de Endocrinología Pediátrica. Madrid. Editorial Médica Panamericana. 2013:21-30.
- Alicia Martinez, Titania Pasqualini, Viviana Bengolea, Miriam Azaretzky, Florencia Kuspiel, Elisa Vaiani, Susana Campeni, Viviana Pipman y Martha Suárez. Función gonadal en niños y adolescentes nacidos con restricción del crecimiento intrauterino. Revista Argentina de Endocrinología y Metabolismo.2017;54(4):196-203.
- Dennis M. Styne. Melvin M Grumbach. Puberty: Ontogeny, neuroendocrinology, physiology and disorders. En: Williams Textbook of Endocrinology. Chapter 25.12th Edition.Elsevier Saunders.USA.2011:1054-1201.
- Tanja Kuiri-Hänninen, Ulla Sankilampi, Leo Dunkel. Activation of the Hypothalamic Pituitary Gonadal Axis in Infancy: minipuberty. Horm Res Paediatric 2014;82:73-80
- Hillary B. Boswell. Normal Pubertal Physiology in Females. En: Female Puberty-A Comprehensive Guide for Clinicians. Chapter 2. Jennifer E. Dietrich Editor. Springer.2014:7-30.
I Médico especialista en Ginecología y Obstetricia. Certificado en Ginecologia Infanto-Juvenil (SAGIJ). Profesor Universitario. Médico de Planta, a cargo del Consultorio de Ginecología Infanto-Juvenil del Servicio de Tocoginecología del Hospital Zonal General de Agudos Narciso López. Lanús. Pcia de Buenos Aires. Jefe de Trabajos Prácticos, Dpto de Tocoginecología de la Facultad de Medicina de la Universidad de Buenos Aires. Argentina. Miembro de CD de la Sociedad de Ginecología y Obstetricia de la Prov. de Buenos Aires- SOGBA - Mail: Esta dirección de correo electrónico está protegida contra spambots. Usted necesita tener Javascript activado para poder verla.
II Médica Residente de 3er Año de Tocoginecolgía del Hospital Zonal General de Agudos Narciso López. Lanús. Pcia de Buenos Aires - Mail: Esta dirección de correo electrónico está protegida contra spambots. Usted necesita tener Javascript activado para poder verla.
III Médica Residente de 2do Año de Tocoginecolgía del Hospital Zonal General de Agudos Narciso López. Lanús. Pcia de Buenos Aires - Mail: Esta dirección de correo electrónico está protegida contra spambots. Usted necesita tener Javascript activado para poder verla.
