Descifrando la Mineralización Ósea y sus Dilemas: Factores Cardiovasculares, Metabólicos, Herramienta FRAX, Modelo FRIDEX y DMO.
Descifring Bone Mineralization and its Dilemas: Cardiovascular Factors, Metabolics, FRAX Tool, FRIDEX and DMO Model
Autores
Nelly Esther Capua1, Adriana Elías2, Olga Graiff3
RESUMEN
Introducción: La Osteoporosis es un proceso multifactorial que impacta en la carga de las fracturas sobre la sociedad. Por lo tanto la desmineralización ósea debe ser una de las prioridades en materia de salud para generar conciencia respecto a su riesgo de fractura.
Objetivo General: Definir perfil lipídico, óseo y mineralización en mujeres ≥ 40 asistidas en Unidad de Climaterio, Instituto de Maternidad y Ginecología “Ntra. Sra. de las Mercedes”, Tucumán.
Específicos: Riesgo de fractura a 10 años (RF10a) FRAX y Modelo Fridex; Comparar Frax - Fridex sin y con densitometría ósea (DMO); concordancia T-score - densidad mineral ósea (dMO) L1-L4 y cuello femoral (CF); asociación factores de riesgo cardiovascular (FRCV), T-Score y dMO.
Estudio: Exploratorio descriptivo, corte transversal.
Población: 77 mujeres ≥40 años (2018 - 2019)
Criterios de inclusión: Postmenopáusica (PM), voluntarias y consentimiento.
Material y Métodos: Análisis factores de riesgo, cardiovascular, óseo, Herramienta FRAX, Fridex, DMO.
Resultados: 25(OH) Vit D: insuficiente (50%), suficiente (25%), deficiente (15%) óptimo (5%); L1-L4: dMO ≤0.98/cm2 (57%); Osteoporosis L1-L4 y dMO ≤0.83 g/cm2 (74%) y > 10 aPM: +2,2 veces; CF <10 aPM ≤0.98/cm2 (84 %); FRAX con DMO: Riesgo de fractura principal ≤ 6,4% (90%); >11% (5%). Cadera>3%(5%); FRAX sin DMO: RFP >10% y >3% cadera (5%); Modelo Fridex: Concordancia (79,2%); Concordancia T-score L1-L4 y CF (39%), Discordancia (61%); Concordancia dMO L1-L4 y CF (50,6%), Discordancia (49,4%); FRAX (sin y con DMO): Relación lineal positiva (84%); Asociación TG ≥150 mgr/dl y dMO CF (p=0,016). Se observó asociación significativa entre valor de TG encontrado y mineralización de cuello femoral (p=0,016); Colesterol ≥200 mg/dl y dMO <0,98 - 0,83 gr/cm2 (79%); Sin Asociación FRCV y T-Score. Conclusión: Modelo Fridex: desciende límite de riesgo Frax de 20% para fractura principal e inicio de tratamiento. Efectuar DMO al inicio de menopausia, con valores TG≥150 mg/dl y screening 25(OH) Vit D.
Palabra clave: Mineralización ósea, Frax, Fridex, DMO, Factores Cardiovasculares
SUMMARY
Introduction: Osteoporosis is a multifactorial process that impacts the burden of fractures on society. Therefore, bone demineralization should be one of the health priorities to raise awareness about your risk of fracture.
General Objective: Define lipid profile, bone and mineralization in women ≥ 40 assisted in Climaterial Unit, Institute of Maternity and Gynecology “Ntra. Mrs. de las Mercedes”, Tucumán.
Specific Objetive: Fracture risk at 10 years (RF10a) FRAX and Fridex Model; Compare Frax - Fridex without and with bone densitometry (BMD); T-score concordance - bone mineral density (BMD) L1-L4 and femoral neck (CF); association of cardiovascular risk factors (CVRF), T-Score and BMD.
Study: Descriptive exploratory, cross section. Population: 77 women ≥40 years (2018 - 2019)
Inclusion criteria: Postmenopausal, (PM) voluntary and consent.
Material and Methods: Analysis of risk factors, cardiovascular, bone, FRAX Tool, Fridex, BMD.
Results: 25 (OH) Vit D: insufficient (50%), sufficient (25%), poor (15%) optimal (5%); L1-L4: dMO ≤0.98 / cm2 (57%); Osteoporosis L1-L4 and BMD ≤0.83 g / cm2 (74%) and> 10 aPM: +2.2 times; CF <10 aPM ≤0.98 / cm2 (84%); FRAX with BMD: Main fracture risk ≤ 6.4% (90%); > 11% (5%). Hip> 3% (5%); FRAX without BMD: RFP> 10% and> 3% hip (5%); Fridex Model: Concordance (79.2%); Concordance T-score L1-L4 and CF (39%), Discordance (61%); Concordance dMO L1-L4 and CF (50.6%), Discordance (49.4%); FRAX (without and with BMD): Positive linear relationship (84%); Association TG ≥150 mgr / dl and dMO CF (p = 0.016). Significant association was observed between TG value found and femoral neck mineralization (p = 0.016); Cholesterol ≥200 mg / dl and BMD <0.98 - 0.83 gr / cm2 (79%); Without Association FRCV and T-Score. Conclusion: Fridex Model: Frax risk limit drops by 20% for main fracture and start of treatment. Perform BMD at the onset of menopause, with TG values ≥150 mg / dl and screening 25 (OH) Vit D.
Keyword: Bone mineralization, Frax, Fridex, BMD, Cardiovascular Factors
INTRODUCCIÓN
Debido al impacto de la carga de las fracturas sobre la sociedad la desmineralización ósea debe ser una de las prioridades en materia de salud para generar conciencia entre los pacientes respecto a su riesgo de fractura. La población crecerá 13% para 2050 y alcanzará 53 millones, pero la población añosa será de 19,5 millones.1 Por otra parte, las tasas de fertilidad están cayendo: mientras que el número promedio de hijos por cada mujer es 2,3, caerá a 2,0 dentro de 20 años, y a 1,8 dentro de 50 años. Esto implica que para 2050 el número de personas económicamente activas no alcanzará a subsidiar los sistemas de salud y de retiro. En consecuencia es razonable asumir que la osteoporosis tendrá un impacto económico significativo para la Argentina en los años venideros.1 En Argentina, se producen aproximadamente 34.000 fracturas de cadera por año entre personas mayores de 50 años, con un promedio de 90 fracturas por día. Las proyecciones demuestran que el número de fracturas de cadera por año en esta población casi se triplicará en 2050.Los estudios de densidad mineral ósea revelan que, en Argentina, dos de cada cuatro mujeres mayores de 50 años sufren de osteopenia, una sufre osteoporosis y una 4 posee una densidad ósea normal2 En el primer estudio epidemiológico sobre fracturas en el norte de nuestro país (UBA, año 2012) se observó que las tasas de incidencia que registraba la provincia de Tucumán eran similares a algunas zonas de Estados Unidos y Europa3 La investigación se realizó en poblaciones (mujeres y hombres) mayores de 50 años y se analizaron casos estudiados en centros médicos de la ciudad de San Miguel de Tucumán y otras localidades situadas en áreas urbanas y rurales. Otro estudio analizado reveló que en Argentina, la mortalidad de pacientes hospitalizados fue del 10%, mientras que un 33% de pacientes con fracturas fallecieron un año después de haber sufrido la fractura4
PATOLOGÍA DE LA MINERALIZACIÓN ÓSEA
La disminución de la densidad mineral ósea (DMO) se correlaciona con el riesgo de sufrir fracturas, pero no es el único factor. Además de la densidad del hueso, influye también su composición y su estructura, lo que ha llevado a introducir en la terminología de la clínica el ambiguo concepto de “calidad ósea”. Sus principales componentes son dos: los aspectos referentes a la estructura del hueso (macroarquitectura -tamaño, momento de inercia, pandeo- y microarquitectura - conexión trabecular, concentradores de tensión-) y la calidad del tejido óseo per se (mineralización, microdaños, colágeno, viabilidad de los osteocitos, cristalinidad)5
Concretamente definimos a la osteoporosis cuando la densidad de la masa ósea de un individuo está 2,5 desviaciones estándar por debajo de la media de la población adulta joven que le sirve de referencia.6 La osteoporosis es una entidad multifactorial, que parte como muchos otros procesos de una predisposición individual sobre la que actúan factores externos que modulan la expresión del genoma y condicionan el “pico de masa ósea” en la edad adulta. El máximo de DMO alcanzada constituye el punto de partida desde el que se iniciará el declive a lo largo de los siguientes años; por tanto, cuanto mayor sea, menores son las posibilidades de desarrollar la enfermedad osteoporótica.6 Se conoce que las osteopenias son alteraciones antropométricas de la cantidad de hueso (tejido) dentro del hueso (órgano) conservando la calidad del material remanente (calidad del tejido), cuyo diagnóstico debe hacerse determinando densitométricamente la llamada ‘masa ósea’ en la forma mejor estandarizada disponible (de momento, los T-scores de DMO establecidos, estandarizados y difundidos por la OMS), y evaluando el resultado sin tener en cuenta ningún límite inferior para establecer ningún diagnóstico de osteoporosis.7 Las osteoporosis (fragilidades osteopénicas, según el NIH) son alteraciones biomecánicas de la resistencia a la fractura (calidad ósea) derivadas de osteopenias suficientemente intensas como para deteriorar la eficiencia arquitectónica del diseño cortical o trabecular (calidad del diseño), sin afectar la ‘calidad del tejido’, cuyo diagnóstico requiere el de ‘fragilidad ósea’, y por tanto es imposible de efectuar densitométricamente.7
La osteoporosis es una enfermedad del diseño óseo con calidad tisular normal, independiente de la intensidad de la osteopenia (es decir, es una ‘enfermedad de la direccionalidad’ de la estructura ósea osteopénica. La direccionalidad es una orientación local de la modelación ósea en una determinada dirección (‘drift modelatorio’), que adapta el diseño óseo cortical o trabecular a las correspondientes necesidades arquitectónicas, tendiendo a rigidizar las regiones óseas demasiado flexibles, y a flexibilizar las demasiado rígida La osteopenia es independiente de la direccionalidad (y de la resistencia mecánica) 7 La osteoporosis idiopática en las mujeres premenopáusica es poco frecuente. En este caso el diagnostico no se realiza por el T score sino por el Z score. La densidad mineral baja en la mujer premenopáusica eta asociada con defectos en la micro arquitectura ósea, sin embargo no ha datos de estudios que permitan usar la densidad mineral ósea como predictor de fractura de riesgo.8
La presencia de baja densidad mineral ósea en mujeres pre menopáusicas lleva la pronta evaluación de causas secundarias que provocan pérdida de masa ósea. Si la causa secundaria se diagnostica la resolución de la misma mejora la osteoporosis. En los pocos casos que no se diagnostica la causa, el uso de terapia farmacológica activa en hueso, debería ser considerada. La intervención farmacológica debe ser considerad en casos de mujeres con baja masa ósea y fracturas y con perdida continua de densidad mineral sea como en la osteoporosis glucocorticoide o enfermedades reumáticas8
DEFICIENCIA DE VITAMINA D Y BAJA INGESTA DE CALCIO
Varios estudios detectaron una ingesta insuficiente de calcio (promedio de 500 mg diarios) en la población adulta de Argentina.9 A pesar de la heliofanía en la mayoría de las zonas del país, la prevalencia de niveles insuficientes de 25(OH)D (<20 ng/ml) en personas de edad avanzadas relativamente alta, no solo en el sur (87% de la población) sino también en las regiones del centro (64%) y el norte (52%)8 La población de la Patagonia –la región más austral del país– tiene mayor riesgo de padecer hipovitaminosis D9.En Chile, la deficiencia de vitamina D es un problema entre las poblaciones pediátrica y adulta. Un estudio descubrió que el 47,5% de los sujetos (entre 55 y 84 años) sufría hipovitaminosis D en base a un nivel límite de 17 ng/ml15.10 En 2009, un estudio realizado en Brasil reveló que el 60% de los adolescentes saludables estudiados tenían deficiencia de vitamina D según lo definen las concentraciones de 25(OH) D sérica >25 ng/ml.10
VÍNCULOS PATOGÉNICOS E INTERACCIONES FISIOPATOLÓGICAS
1. ENTRE EL METABOLISMO ÓSEO Y LOS FACTORES DE RIESGO DE LA ECV
Al igual que la arteriosclerosis, la osteoporosis presenta una alta prevalencia en la población y una importante morbimortalidad asociada. Es por ello de gran interés estudiar las posibles asociaciones entre ambas, con la finalidad de promover las actividades de prevención primaria con mayor potencial y priorizar las intervenciones sobre los factores de riesgo de ambas entidades.11 La relación entre la arteriosclerosis y la osteoporosis parece ir más allá de una mera coincidencia de factores de riesgo comunes. Es más, en los últimos años, se ha planteado la posible existencia de vínculos patogénicos e interacciones fisiopatológicas entre el metabolismo óseo y los factores de riesgo de la ECV. Este hecho ha quedado refrendado por el descubrimiento de alguno de los mecanismos moleculares de acción de las estatinas y los bisfosfonatos12 a los que se atribuyen efectos antiaterógenos mediante la reducción de la acumulación de lípidos y de la fibrosis en la placa de ateroma, al igual que la inhibición de la calcificación extraósea.13 Por otra parte, las estatinas inhiben el paso limitante de la ruta biosintética del colesterol: la conversión de 3-hidroxi-3-metilglutarilcoenzima A en mevalonato, disminuyendo la síntesis de éste y de isoprenoides, lo cual afecta también a la función osteoclástica, lo que representa un efecto común con los aminobisfosfonatos
Recientemente se ha propuesto que la dislipemia podría ser un factor de riesgo común para la ECV y la osteoporosis. Estudios in vitro han demostrado que los productos de oxidación lipídica en el espacio subendotelial de las arterias del hueso inhiben la diferenciación osteoblástica entidades11, y que la hiperlipemia potencia la actividad de los osteoclastos. También cabe destacar la presencia de productos de oxidación de las lipoproteínas de baja densidad (LDL-C) en las placas ateroscleróticas. Se ha hablado de una similitud entre el proceso de mineralización ósea y la calcificación vascular, y los factores que pueden influir en el desarrollo de ambas, como por ejemplo la presencia de LDL oxidadas, con su elevado potencial aterógeno entidades11
Aunque el mecanismo intrínseco preciso de dicho nexo aún no se conoce, recientemente se ha comprobado que las lipoproteínas de alta densidad (HDL-C) tienen un efecto regulador de la diferenciación osteoblástica y de la calcificación vascular. Las estatinas podrían ser un fármaco útil en el tratamiento de la osteoporosis, ya que no sólo comparten con los bisfosfonatos propiedades antiinflamatorias, sino que también poseen características moduladoras sobre la formación y la resorción ósea14 Sin embargo, los estudios realizados con la finalidad de establecer un claro nexo patogénico entre la alteración de los parámetros del metabolismo lipídico, la densidad mineral ósea (DMO) y/o las fracturas osteoporóticas, no han sido concluyentes. La principal cuestión probablemente sea si existe o no una relación directa entre la densidad mineral ósea y los lípidos séricos o si esa hipotética asociación es debida a factores de confusión (principalmente el estado estrogénico en el caso de las mujeres) Poli et al.15 en un estudio que incluyó a 1.303 mujeres postmenopáusicas observaron que aquéllas con niveles plasmáticos de LDL-C ≥ 160 mg/dl tenían más del doble de probabilidad de presentar osteopenia lumbar que las mujeres con niveles de LDL-C más bajos. Yamaguchi et al. Entidades11 hallaron una asociación inversa entre los niveles de LDL-C y la DMO a nivel del antebrazo y de columna lumbar, y directa entre el HDL-C y la DMO en las áreas mencionadas en 214 mujeres japonesas postmenopáusicas. Observaron también que las mujeres con fracturas vertebrales prevalentes tenían niveles más bajos de triglicéridos que las mujeres no fracturadas. Makovey et al. Entidades11 en un estudio longitudinal, llevado a cabo con 497 mujeres gemelas con edades comprendidas entre los 20 y 81 años (224 en etapa pre menopáusica, y 273 en la postmenopáusica; 156 en tratamiento con terapia hormonal sustitutiva (THS), y 117 sin ella). Examinaron la influencia de la edad, el estatus menopáusico y la THS sobre el colesterol sérico y la DMO (medida en columna lumbar, cadera total, cuello femoral y corporal total, mediante absorciómetro radiológico dual –DXA-). Observaron una relación inversa entre los niveles de colesterol total y de LDL-C con la DMO a nivel de columna lumbar y en la medición corporal total, en las mujeres postmenopáusicas, además de una relación negativa entre HDL-C y DMO en cadera, que parecía modificarse con la THS. Nuzzo et al.16 investigaron la calidad ósea en 256 mujeres postmenopáusicas estratificadas según la ausencia (colesterol total < 200 mg/dl; n= 180) o presencia (colesterol total ≥ 200 mg/dl; n= 76) de hipercolesterolemia (a su vez, divididas en subgrupos en función de si recibían tratamiento dietético o estatinas). Concluyendo que la hipercolesterolemia per se podría ser un factor de riesgo para el deterioro óseo y que las estatinas podrían ejercer un efecto protector sobre el hueso independiente de la ingesta de calcio. En un estudio de 52 mujeres postmenopáusicas con sobrepeso, Orozco et al.17 observaron que las pacientes con un perfil lipídico aterogénico (colesterol total ≥ 240 mg/dl o LDL-C >160 mg/dl) presentaron una DMO más baja en la columna lumbar y en el cuello femoral, así como un mayor riesgo de osteopenia, en comparación con las pacientes con un perfil lipídico normal, sugiriendo una posible asociación de la hiperlipidemia con la osteoporosis. Adami et al.18 estudiaron esta relación en dos cohortes de sujetos: una cohorte clínica que incluyó 236 mujeres pre y postmenopáusicas de entre 35 y 82 años, que habían sido atendidos en una consulta especializada de osteoporosis, y una cohorte poblacional (265 varones y 481 mujeres de entre 68 y 75 años). En la cohorte clínica se evidenció una relación negativa entre la DMO lumbar y de cadera y los niveles de HDL-C, y positiva con los niveles de triglicéridos séricos. En la cohorte comunitaria se encontraron las mismas correlaciones entre dichos lípidos y la DMO en cadera y en medición corporal total. En ambas, la relación entre el perfil lipídico y la masa ósea permaneció significativa tras ajustar por el índice de masa corporal y el peso. En la cohorte de Hertforside19 en Gran Bretaña, que incluyó a 465 mujeres y 48 varones, se observó una asociación directa entre la DMO lumbar y de cadera total y los niveles de triglicéridos en ambos sexos, así como una relación inversa entre el HDL-C y la DMO lumbar en varones y la DMO de cadera total en ambos sexos. Sin embargo estas asociaciones se neutralizaban al ajustar por el porcentaje de grasa corporal. No se observó ninguna asociación entre la DMO y el colesterol total o el LDL-C.
2. ENTRE EL METABOLISMO ÓSEO Y DIABETES
Además de las conocidas complicaciones de la diabetes, como retinopatía, nefropatía, neuropatía y arteriosclerosis, la osteoporosis y el incremento del riesgo de fracturas también son complicaciones de la enfermedad.20 La patogenia de la osteoporosis y las fracturas en pacientes con diabetes es compleja. Los factores que pueden contribuir a las caídas y fracturas en pacientes diabéticos comprenden la alteración de la visión por retinopatía, la alteración del equilibrio postural por neuropatía y aterosclerosis, así como los episodios de hipoglucemia. La reducción de la densidad mineral ósea se relaciona con varios factores. Uno de ellos es el aumento de la excreción de calcio por orina relacionado con la excreción forzada de calcio debido a la hiperglucemia y glucosuria. El metabolismo de la vitamina D y de la parathormona puede estar alterado por hipoparatiroidismo funcional y disminución del nivel de 24,25-dihidroxi-vit.D.21
La alteración del metabolismo de la vitamina D y de la parathormona es particularmente prominente en pacientes con función renal reducida. La macroangiopatía con aterosclerosis puede conducir a reducción del aporte sanguíneo a los huesos. En pacientes con neuropatía, la carga alterada para los huesos también puede contribuir a la pérdida ósea. La glucación también puede estar implicada, con deterioro del entrecruzamiento del colágeno y reducción de la función de los osteoblastos debido a formación de productos finales de glucación avanzada relacionados con la edad junto con alteraciones de los niveles de insulina y de factor de crecimiento símil insulina tipo 1 (IGF-1). El incremento del peso corporal observado en muchos pacientes con diabetes tipo 2 puede aumentar la densidad mineral ósea y prevenir las fracturas. El tratamiento con insulina y con hipoglucemiantes orales puede reducir el riesgo de fractura debido a la normalización de los niveles de glucemia.20
Un meta-análisis de 21 estudios prospectivos demostró una asociación inversa entre la diabetes tipo 2 y los niveles de 25OHD.22, 23 Otros estudios hallaron una relación inversa entre 25OHD, HbA1c y glucemia en ayunas.10 Varios estudios poblacionales apoyan la hipótesis de que los bajos niveles de 25OHD se asociarían a un deterioro de la función de las células β, a resistencia insulínica, intolerancia a la glucosa y riesgo incrementado de diabetes tipo 2. 22 En el estudio NHANES, la deficiencia de vitamina D fue vinculada a un mayor riesgo de complicaciones microvasculares y macrovasculares en pacientes con diabetes tipo 1 y tipo 2.24 En el estudio Women’s Health Initiative (WHI) y en el análisis secundario del estudio RECORD no se observó efecto en la incidencia de diabetes con suplementos de vitamina D.25,26 Por lo tanto, se necesitan más estudios para determinar una relación entre ambas entidades y evaluar la suplementación de vitamina D sobre la incidencia de diabetes mellitus.
En pacientes diabéticos tipo 1(DMT1) se encuentran disminuida la Densidad Mineral Ósea (DMO), en diabéticos tipo 2(DMT2) se encuentra normal o aumentada y en ambos tipos de diabetes se verificó aumento de la incidencia de fracturas. Hay aumento de la porosidad cortical, disminución del área cortical, alteración de la matriz ósea y depósito de AGES. El turnover óseo esta disminuido y en algunos casos se ha encontrado disminución de los niveles de Osteocalcina (OC) y de Beta Crosslaps (CTX).27 Las drogas antidiabéticas tienen distintos efectos sobre el metabolismo mineral. Las Tiazoledindionas (TZ) a través del factor de transcripción nuclear PPAR promueven la diferenciación de células del linaje mesenquimático a adipocitos, alterando la función osteoblástica y frenando la osteoblastogénesis. Las TZ disminuyen la formación ósea, promueven la apoptosis de osteoblastos y osteocitos y en estudios clínicos se verificó disminución de los niveles de Osteocalcina y de PINP (pro péptido N-terminal del colágeno tipo I) como asimismo disminución de la DMO en fémur total y columna lumbar. En estudios epidemiológicos y en distintos protocolos de investigación (ADOPT y BARI) se encontraron aumento significativo de la incidencia de fracturas. 27 La metformina en cultivos de dos tipos de células osteoblástica (células UMR 106 y MC3T3E1) estimula la proliferación, diferenciación y mineralización de osteoblastos en cultivo. Induce la activación y redistribución de P-ERK en forma transitoria y aumenta la expresión de e NOS (óxido nítrico sintetasa endotelial) e i NOS (óxido nítrico sintetasa inducible) en forma dependiente de la dosis. La metformina induce efectos osteogénicos a través de la vía de P-ERK (Anticuerpo E-4 monoclonal Ig G) y NOS bloqueando los efectos deletéreos de los AGES (advanced glycation end products: espectro de compuestos heterogéneos que derivan de proteínas, lípidos y ácidos nucleicos que son glicados y oxidados en forma no enzimática en un proceso llamado reacción de Maillard). El tratamiento in vivo con metformina no modifica la capacidad adipogénica ex vivo, ni altera los niveles de expresión de PPAR Y hay pocos estudios clínicos con metformina y los que se efectuaron mostraron disminución de la incidencia de fracturas. 27
El incremento en la adiposidad ha sido consistentemente asociado con niveles plasmáticos disminuidos de 25OHD y resultados cardiometabólicos adversos, aunque los mecanismos subyacentes de la relación con 25OHD son inciertos. Se ha postulado que los individuos con sobrepeso presentan menores niveles de 25OHD debido a su alta solubilidad en lípidos y al consiguiente secuestro en el tejido adiposo dando lugar a una disminución de su biodisponibilidad.28, 23 Una explicación alternativa es que la adiposidad sería un factor de confusión, dado que los pacientes con sobrepeso u obesidad realizarían menores niveles de actividad física con la con siguiente menor exposición solar y síntesis de vitamina D. Por otra parte, algunos datos experimentales han sugerido que la deficiencia de vitamina D podría favorecer la mayor adiposidad mediante el incremento de los niveles de PTH y mayor flujo de calcio hacia el interior de los adipocitos, incrementando la adipogénesis. Además, la depleción de vitamina D podría desencadenar una excesiva diferenciación de pre-adipocitos hacia adipocitos.29, 23 La asociación entre los niveles de 25OHD y SM ha sido previamente estudiada en diferentes poblaciones y se confirmó una relación inversa. Además, la hipovitaminosis D y la elevación de PTH pueden intervenir en la etiología de SM, ya que los niveles de 25OHD han sido relacionados inversamente con la glucemia en ayunas, la adiposidad y la regulación de la presión arterial. 30-33
IDENTIFICANDO PERSONAS CON MAYOR RIESGO DE FRACTURAS
El test online para la Evaluación de Riesgo de Fractura de la OMS, conocida como FRAX® es una herramienta de la Organización Mundial de la Salud tiene una especial utilidad en aquellas regiones donde las pruebas de densidad ósea son escasas o no están disponibles. La International Osteoporosis Foundation (IOF) apoya su uso masivo y mayor desarrollo, dado que es un paso importante para que la prevención de las fracturas sea prioritaria en todo el mundo34. Es conocido que la DMO es un fuerte predictor de riesgo de fractura, sin embargo, la mayoría de las fracturas se producen en mujeres con DMO por encima del umbral de osteoporosis, generalmente, en el rango de la .osteopenia.35 Si bien es una técnica probada, existen varios problemas con el uso exclusivo de las pruebas de DMO en la evaluación del riesgo de fractura. La principal dificultad reside en que la DMO por sí sola posee baja sensibilidad, de manera tal que la mayoría de las fracturas por osteoporosis se producirán en individuos que presentan valores de DMO por encima del umbral de osteoporosis, generalmente, en el rango de osteopenia (T-score inferior a -1 y mayor a -2,5 DE) la consideración de factores de riesgo bien validados, con o sin DMO, mejore la predicción de fractura y la selección de los individuos más apropiados para recibir tratamiento.34Mediante el trabajo conjunto de numerosos investigadores líderes de todo el mundo, el Centro Colaborador de la OMS cotejó información sobre los factores de riesgo de fractura de 12 cohortes (grupos) de base poblacional estudiadas prospectivamente en diferentes territorios geográficos, utilizando datos individuales primarios. Los cohortes incluyeron centros en Europa (estudios multicéntricos EVOS y EPIDOS, y estudios de centro único en Rótterdam, Kuopio, Lyon, Gothenburg y Sheffield), América del Norte (el estudio, EE. UU.), CaMos y Rochester Australia (el estudio DOES) y Japón (Hiroshima).35 Los participantes del cohorte tuvieron una evaluación de base, en la que se documentaron los factores de riesgo clínicos de fractura y, en el 75% de los casos, aproximadamente, también se midió la DMO de la cadera. El seguimiento comprendió alrededor de 250.000 pacientes por año en 60.000 hombres y mujeres, durante el cual se registraron más de 5.000 fracturas. Este exclusivo compendio de datos permitió examinar varios factores de riesgo de fractura individuales y sus interrelaciones con otras variables de riesgo, principalmente, edad y DMO35 En el modelo final de FRAX®, el riesgo de fractura de hombres y mujeres se calcula a partir de la edad, el índice de masa corporal (IMC) computado según altura y peso, y las variables de riesgo independientes, tales como fractura previa por fragilidad, antecedentes de fractura de cadera en los progenitores, tabaquismo actual, uso prolongado de glucocorticoides orales en alguna oportunidad, artritis reumatoide, otras causas de osteoporosis secundaria y consumo diario de alcohol equivalente a 3 ó más unidades por día. También se puede ingresar la DMO del cuello del fémur (cadera), preferentemente como un T-score. FRAX® ofrece un cálculo inmediato de la probabilidad, a 10 años, de fractura severa (columna, muñeca, húmero proximal y cadera) o fractura de cadera sola, con o sin el agregado de la medición de la DMO del cuello del fémur.34 El rendimiento de FRAX® ha sido evaluado en once cohortes independientes en Europa, América del Norte, Australia y Japón que no participaron en la elaboración del modelo, lo cual demuestra que FRAX® es una herramienta de amplio alcance. Existen otras validaciones en marcha en otros estudios de hombres y en grupos étnicos no cubiertos hasta la fecha.34 En la actualidad, existen modelos FRAX® para los países enunciados (izquierda), según las categorías de riesgo (probabilidad de fractura de cadera a 10 años en mujeres de 65 años, sin factores de riesgo clínicos). Riesgo muy elevado Austria, Bélgica, Suecia, Suiza Riesgo elevado Argentina, China (Hong Kong), Finlandia, Alemania, Italia, China (Taiwán), Reino Unido, Estados Unidos (caucásicos) Riesgo moderado Francia, Japón, España, Nueva Zelanda, Estados Unidos (hispanos), Estados Unidos (asiáticos) Riesgo bajo China, Líbano, Turquía, Estados Unidos (negros)34 En la actualidad, la herramienta FRAX® limita la DMO a aquella que se mide en el cuello del fémur, ya que hay gran cantidad de información disponible sobre este sitio del esqueleto. Cuenta con la ventaja de que para cualquier edad y DMO, el riesgo de fractura es aproximadamente el mismo en hombres y mujeres. Por tal motivo, el T-score surge de un estándar de referencia único (la base de datos NHANES III para mujeres caucásicas entre 20 y 29 años), tal como se ha recomendado ampliamente
FRAX EN LA PRÁCTICA CLÍNICA.
El médico puede usar el riesgo de fractura establecido por FRAX® a la hora de decidir los próximos pasos a seguir. Por ejemplo, sobre la base de los lineamientos del NOGG en el Reino Unido: si el riesgo de fractura es bajo, se asesora sobre el estilo de vida –dieta y actividad física– pero no se requiere medicación; si el riesgo es elevado, entonces, es probable que el médico recomiende tratamiento; si el riesgo es intermedio, se suele indicar la DXA. Luego se calcula el riesgo establecido por FRAX® y se decide si es necesario indicar medicación. A las mujeres que ya han sufrido una fractura después de la menopausia se les puede ofrecer tratamiento sin necesidad de calcular su riesgo.35, 37,38
MODELO FRIDEX
El modelo FRIDEX incluyó 23.434 mujeres y 2.349 hombres derivados a una Unidad de Densitometría hospitalaria del Hospital Valle de Hebron, Barcelona, España por médicos de familia y otros especialistas desde el año 2000, escogiendo una muestra aleatorizada de 770 mujeres españolas mujeres de 40 a 90 años y seguidas durante 10 años entre enero y diciembre del 2000. Posteriormente fue validado en otra cohorte representativa de la población general.39 Se estratificaron en 3 grupos de niveles de riesgo de fractura principal en base a los resultados reales de fractura sufrida durante 10 años (bajo<10%, intermedio 10-20% y alto>20%) y se buscaron los puntos de corte equivalentes de FRAX® basal. Los umbrales de FRAX® basal para fractura principal fueron: riesgo bajo<5; intermedio≥5 y <7,5 y alto≥7,5.40 En esta cohorte se observó que, en las mujeres <55 años, un 91% de las fracturas se producían con valores basales de osteopenia o normalidad, mientras que en las mujeres entre 55 y 65 años de edad este porcentaje era del 80%. En cambio, se corregía en las mujeres entre 65 y 75 años de edad, con un 58% de fracturas en osteopenia o normalidad, y un 42% a partir de los 75 años de edad. Según el modelo FRIDEX, una mujer sin factores de riesgo según FRAX® y sin incluir el T-score de la densitometría deja de ser de bajo riesgo a los 69 años. Si tuviera una fractura osteoporótica lo sería a partir de los 61 años. De alto riesgo lo sería a partir de los 75 y 66 años, respectivamente. FRIDEX propone «considerar el tratamiento» no «indicar el tratamiento», especialmente sin DMO.41 La aplicación del modelo FRIDEX también aporta que paciente y médico conozcan que existe un riesgo intermedio-alto de fractura osteoporótica. Entre las limitaciones, puede argumentarse que ambas cohortes forman parte de una sola comunidad autónoma española cuando sabemos que existen diferentes tasas de fracturas de cadera entre ellas41. (Fig.1) No obstante, esta limitación es aplicable a prácticamente todos los modelos y en medicina, se asume que los modelos matemáticos de predicción de riesgo son ajustados en una población y necesitan ser validados en otras como en el caso FRIDEX. 39, 41

Fig. 1. Aplicación del Modelo Fridex. Fuente: Georgios Kyriakosa, Alfonso Vidal-Casariegoa, Estudio comparativo de la aplicación de la calibración FRIDEX
y de la guía NOGG en el manejo de la Osteoporosis en la práctica clínica habitual. Reumatología Clínica.2017, Vol13. Nª5 258-263
MEDICIÓN DE LA DENSIDAD MINERAL ÓSEA (DMO)
Desde el punto de vista conceptual, la osteoporosis es una enfermedad general que afecta a todo el esqueleto, pero en la práctica nos encontramos con que la desmineralización no es uniforme y suele afectar más a unas zonas que a otras. Por eso interesa medir la DMO en lugares en los que las fracturas son más problemáticas y revisten mayor importancia: la columna vertebral y la cadera. 37 En las mujeres la desmineralización suele ser más precoz en la columna y la afectación de la cadera aparece en las de mayor edad, generalmente por encima de los sesenta y cinco años. La medida de la DMO en las vértebras torácicas se ve distorsionada por la proximidad de las costillas y por el esternón; por eso la densitometría se realiza en la columna lumbar. 42 Para ello se utilizan la L2, L3 y L4. La L1 generalmente se desestima debido a la proximidad de las costillas y a la presencia ocasional de elementos supernumerarios; en la L5 suelen darse con frecuencia sacralizaciones que también pueden afectar a los resultados, l fémur se mide en tres regiones: el trocánter mayor, el cuello femoral y el triángulo de Ward. Éste último no es una región anatómica concreta: se denomina así a la zona de menor densidad de la cadera. Su localización puede variar ligeramente de individuos a otros y viene definida por el “software” del densitómetro (figura 4). De las tres zonas que habitualmente se miden en el fémur, la que mejor se correlaciona con el riesgo de sufrir una fractura es la DMO del cuello.42
PORCENTAJE DE SUBVALORACIÓN DEL DIAGNÓSTICO EVALUANDO SOLO EL CUELLO FEMORAL
Un editorial de Gupta SK, 43,44 sobre el estudio de prevalencia de osteoporosis en mujeres de Buenos Aires, señala la utilidad de estos estudios y enfatiza la importancia de medir simultáneamente tres áreas: columna lumbar (CL), cuello femoral (CF) y fémur total, ya que los resultados pueden discrepar de acuerdo con el área evaluada. NHANES 2005-2008: 54% de subdiagnóstico de osteoporosis evaluando solo el CF.45 En los hombres, se revisaron solo 3 estudios, todos efectuados en poblaciones asiáticas; la subvaloración diagnóstica desaparece ya en la franja 70-79 y en la valoración total.
A pesar de las recomendaciones de algunos autores, la revisión de 9 estudios efectuados en distintas poblaciones muestra claramente la necesidad de evaluar CL y CF para establecer la prevalencia de osteoporosis, especialmente en mujeres menores de 80 años.46
OBJETIVOS
GENERAL: Definir el perfil clínico, lipídico, el metabolismo óseo y la mineralización ósea en las mujeres postmenopáusicas de 40 y más años asistidas en la Unidad de Climaterio (UCLIM) del Instituto de Maternidad y Ginecología “Nuestra Sra. de las Mercedes”, Provincia de Tucumán, Argentina.
ESPECÍFICOS
- Evaluar la probabilidad del riesgo futuro de fractura osteoporótica a 10 años por medio de la Herramienta FRAX y Modelo Fridex.
- Comparar los resultados sin y con DMO de la herramienta Frax y del Modelo Fridex.
- Analizar la concordancia diagnóstica de los T-score y densidad mineral ósea en las regiones estudiadas: L1-L4 y cuello de fémur.
- Describir la asociación de los factores de riesgo cardiovascular, metabólico con densidad mineral ósea y T-Score informados por DMO.
TIPO DE ESTUDIO: Estudio descriptivo de corte transversal.
POBLACIÓN OBJETIVO: Mujeres de 40 y más años postmenopáusicas asistidas en la Unidad de Climaterio del Instituto de Maternidad y Ginecología “Ntra. Sra. de las Mercedes” en el período comprendido entre 1° de Junio de 2018 y 1° de junio de 2019.
MUESTRA: 77 mujeres postmenopáusicas y voluntarias asistidas en la UCLIM
CRITERIOS DE INCLUSIÓN: Mujeres con edad igual o superior a 40 años postmenopáusicas que acepte ingresar en el estudio y firme el consentimiento informado.
PACIENTES Y MÉTODOS: Se analizaron los factores de riesgo para osteoporosis en las mujeres postmenopáusicas que acudían a la consulta en la UCLIM. Se estudió el perfil clínico y de riesgo cardiovascular al igual que el perfil óseo a través de la analítica y de la DMO. Se utilizó el densitómetro óseo por rayos x con software en CORE v17 (GE Healthcare Lunar Prodigy Primo) adquirido por la Institución e informado por el médico encargado de dicho servicio. Para evaluar la probabilidad de fractura ósea en una proyección futura de 10 años se utilizó la herramienta online FRAX. Para ello se completaron los datos solicitados y se calculó el riesgo en 2 etapas. Primero sin ingresar los datos del T-score de la DMO de cuello femoral solicitada en la consulta y posteriormente con su inclusión. Al utilizar la opción que considera la DMO el sistema deja de considerar el IMC y las otras causas de osteoporosis porque ya no contribuyen al cálculo de predicción de riesgo. Después de detectar los umbrales de la herramienta FRAX® se determinó la categorización de los grupos de riesgo de fractura osteoporótica principal: riesgo bajo<5; intermedio≥5 y <7,5 y alto≥7,5 siguiendo el Modelo FRIDEX47, 48
De esta manera se evaluaron los 2 resultados obtenidos y sus diferencias. Por otra parte se obtuvieron las discrepancias de los valores informados por la DMO entre el T-score de columna Lumbar L1-L4 y el de cuello de fémur.
VARIABLES: 1. Edad, Edad de Menopausia, Tiempo de Postmenopáusia, IMC, 2. DMO: Normal hasta 1, Osteopenia: entre -1 y -2,5, Osteoporosis: < - 2,5, Osteoporosis grave: < - 2.5 más la presencia de fractura, 3. Menopausia precoz (< 40 años), Amenorrea Primaria o secundaria superior al año, 4. Sedentarismo (inactividad física), 5. Tratamiento prolongado con corticoides (> 3 meses) inmunosupresores, anticoagulantes, 6. Abuso de alcohol (3 o más dosis; 1 dosis: 8-10 gr. de alcohol (1 caña cerveza, 1 copa licor, 1 copa vino), de café (> 4 cafés/día), 7. Tendencia a las caídas, 8. Consumo pobre de calcio (< 1200 mgrs/día), 9. Existencia de otras patologías crónicas: Cushing, Hepatopatías graves, Hiperparatiroidismo, Mieloma múltiple, Hipertiroidismo, Insuficiencia renal crónica, Artritis reumatoide, Malabsorción, Malnutrición, Enfermedad Inflamatoria intestinal, Celiaquía, Anorexia nerviosa, Hipogonadismo, 6. Pérdida de altura, Deformidad de columna: Cifosis de predominio dorsal, escoliosis, 8. Tratamiento hormonal sustitutivo (THS) y tratamientos con antiresortivos, Calcio + vitamina D.
Se utilizó las definiciones de la World Health Organization (OMS) y del National Institutes of Health (NIH) para la definición de los niveles de DMO (Tabla 1)
Tabla 1. Definición de los niveles de DMO.

Fuente: Prueba de la Densidad Ósea: Lo que significan los números. NIH Osteoporosis and related Bone Diseases National Resource Centers. https://www.bones.nih.gov/health-info/bone/espanol-/salud.../bone-mass-espanol
Umbral de Fractura: Nivel por debajo del cual la fuerza del hueso es insuficiente para resistir una caída desde la posición de bipedestación. (Tabla2)
Tabla 1. Umbrales de fractura según el lugar óseo estudiado por DMO.
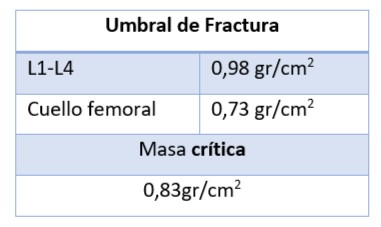
Fuente: Elaboración propia en base a datos de Luis Vidal Neira. Bases y Principios de Densitometría clínica, CEDOR (Centro Diagnóstico de Osteoporosis y Enfermedades Reumáticas). Disponible en: www.cedor.pe/web/documentos/densitometria11.pdf
CONSIDERACIONES ÉTICAS: Se consideraron los principios fundamentales de la Declaración de Helsinki, sobre derechos humanos y biomedicina y la confidencialidad de los datos de carácter personal. El informe final y publicación de resultados garantizará el anonimato de los pacientes estudiados. Los pacientes incluidos en el estudio no fueron sometidos a ninguna consideración experimental, y por ello no presentaron ningún riesgo adicional por su participación en el mismo, ni tampoco por su rechazo a participar. El desarrollo del estudio no implicaba riesgos añadidos al paciente respecto a los propios del control de su patología en la práctica clínica habitual.
ANÁLISIS ESTADÍSTICO
El análisis Estadístico fue Epidemiológico descriptivo, se emplearon cuadros y gráficos uni y bivariados. Se emplearon técnicas del análisis exploratorio de datos. Se aplicó Test chi2 para el estudio de asociaciones y comparación de proporciones al 5% de significación. Se emplearon los programas Excel 2013 y SPSS v 22.
RESULTADOS
Tabla 1. Características de la población de estudio. 77 mujeres postmenopáusicas asistidas en U.CLIM del Instituto Maternidad y Ginecología “Ntra. Sra. de las Mercedes”

Nota: Edad mínima de menopausia =30 años corresponde a paciente de 45 años con diagnóstico de leucemia linfoblàstica. Las pacientes no incluidas en edad de Menopausia son las que no identificaron el tiempo en que ocurrió.
La edad media de las pacientes fue de 58 años (Mn=40, Mx=76); la edad media de Menopausia fue de 47 años (Mn=30; Mx=53). El promedio de años de postmenopausia fue de 12 años. El 90 % de las pacientes tenían a lo sumo 25 años desde su menopausia y el 5% por lo menos 28 años.
Tabla 2. Perfil clínico, lipídico, metabólico de la población de estudio. 77 mujeres postmenopáusicas asistidas en U.CLIM del Instituto Maternidad y Ginecología “Ntra. Sra. de las Mercedes”
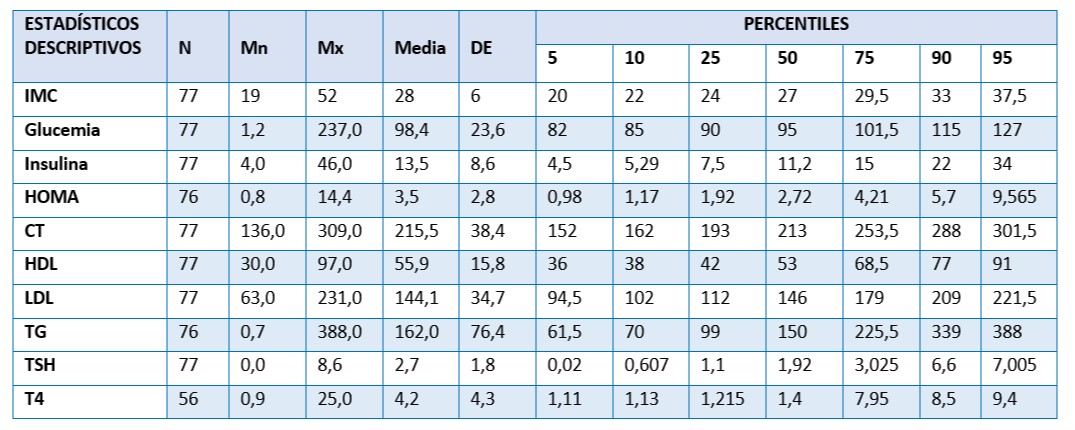
Nota: IMC (18.5-24.9=normal-saludable; 25.0-29.9=sobrepeso,>30=obesidad); Glucemia(VR: 70-105mgr/dl);insulina(VR:2,6-15uUI/ml); insulino resistencia 2.5; CT(VR<200 mg/dl);HDL(VR>50 mg/dl);LDL(VR < 130 mg/dl); <150);TSH(VR: 0.27-4.0 u U/ml)
El 25% del total tenían peso saludable y en el 50% de ellas los valores correspondían a peso inadecuado. El 10 % del IMC estuvo dentro de los valores de obesidad. El 75% de las mujeres tuvieron glucemia > 100 mgr/dl y el 5% eran diabéticas. El 50% tenían cifras de CT >200 mgr, 25% valores de HDL <50, el 75% presentó TG >150 mgr y el 10% eran hipotiroideas.
Tabla 3. Perfil del metabolismo óseo en la población de estudio. 77 mujeres postmenopáusicas asistidas en U.CLIM del Instituto Maternidad y Ginecología “Ntra. Sra. de las Mercedes”
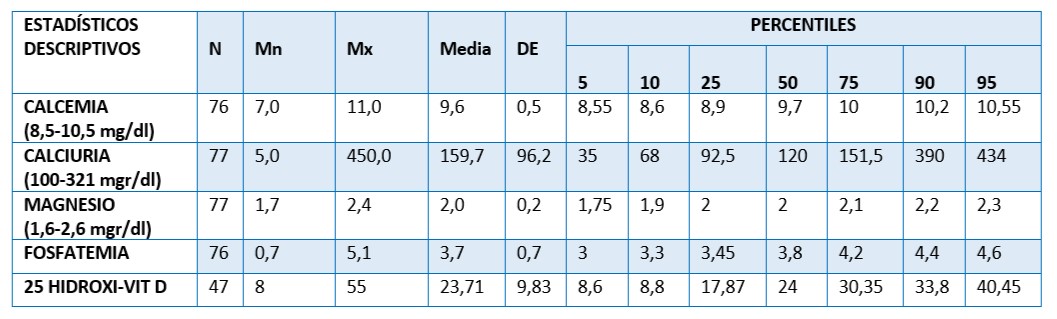
Nota: Metabolismo óseo y valores de referencia: Calcemia total: 8,5-10,5; Calciuria: 100-321mgr/dl, Magnesio: 1,6 -2,6 mgr/dl; Fosfatemia: 2,7- 5,5mgr/dl; 25(OH) Vit. D (Deficiencia: <10 ng/ml; Insuficiencia: 10 <30 ng/ml; Suficiencia 30 ng/ml, Óptima: ≥ 40 - 100 ng/ml; Tóxica:>100 ng/ml de 25(OH)
La concentración en sangre de calcio, fósforo y magnesio mostraron valores dentro del intervalo mínimo y máximo aceptables en todas las pacientes. Las medias respectivas fueron de 9,6, 159 y 2,4 mgr/dl. Respecto a los niveles de 25(OH) Vit D se observó en el 50% de las mujeres valores insuficientes y deficientes en el 15% de ellas. Sólo el 25% tuvo niveles suficientes y un 5% valores óptimos. Ninguna de ellas obtuvo valores tóxicos de 25(OH) Vit D.
Tabla 4. Perfil de los niveles de Densidad Mineral Ósea en la población de estudio. 77 mujeres postmenopáusicas asistidas en U.CLIM del Instituto Maternidad y Ginecología “Ntra. Sra. de las Mercedes”
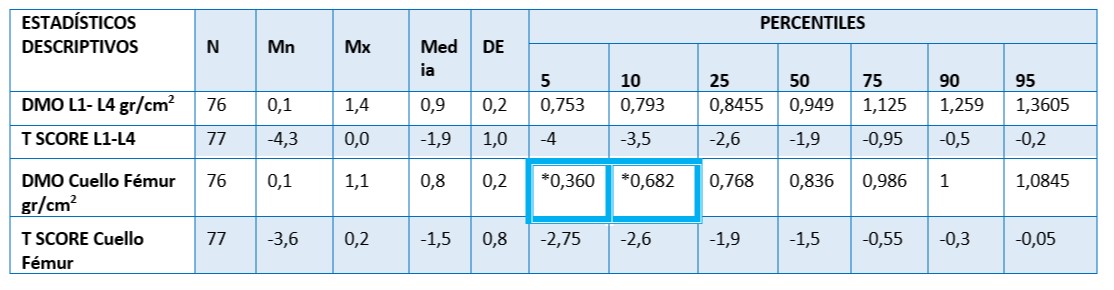
Nota: Normal hasta - 1.0 DE o un valor superior; Osteopenia: entre - 1.0 y - 2.5 DE; Osteoporosis: - 2.5 DE o un valor superior; Osteoporosis grave: - 2.5 DE o un valor superior y presencia de fractura.
El 75% de las mujeres tuvieron DMO >1 en columna lumbar (L1-L4) y sólo el 10% >1 en cuello femoral. Se observó que entre las mujeres con DMO L1-L4 por debajo de 0,98 gr/cm2 el 75% tenían entre osteopenia y osteoporosis. El 50% del total de mujeres tuvieron osteopenia L1-L4, el 10 % osteoporosis en cuello femoral y con densidad mineral ósea por debajo de 0,73 gr/cm2 (umbral de fractura)*
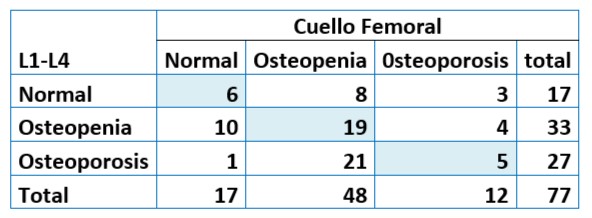
Tabla 5. Niveles de Concordancia entre T-Score L1-L4 y Cuello Femoral en la población de estudio. 77 mujeres postmenopáusicas asistidas en U.CLIM del Instituto Maternidad y Ginecología “Ntra. Sra. de las Mercedes”
Se observó una concordancia diagnóstica del 39% (n=30) entre los niveles de T-score informados en columna lumbar (L1-L4) y cuello de fémur. El 5/77 de las mujeres fueron diagnosticadas con osteoporosis en columna y fémur. La discordancia fue de 61% (n=47). De las 47 mujeres con discordancia, 32% de ellas (15/47) fueron diagnosticadas como osteopénicas - osteoporóticas en la DMO de cuello femoral y no en columna L1-L4. El 68% (32/47) restante de informes discordantes lo hicieron a la inversa.
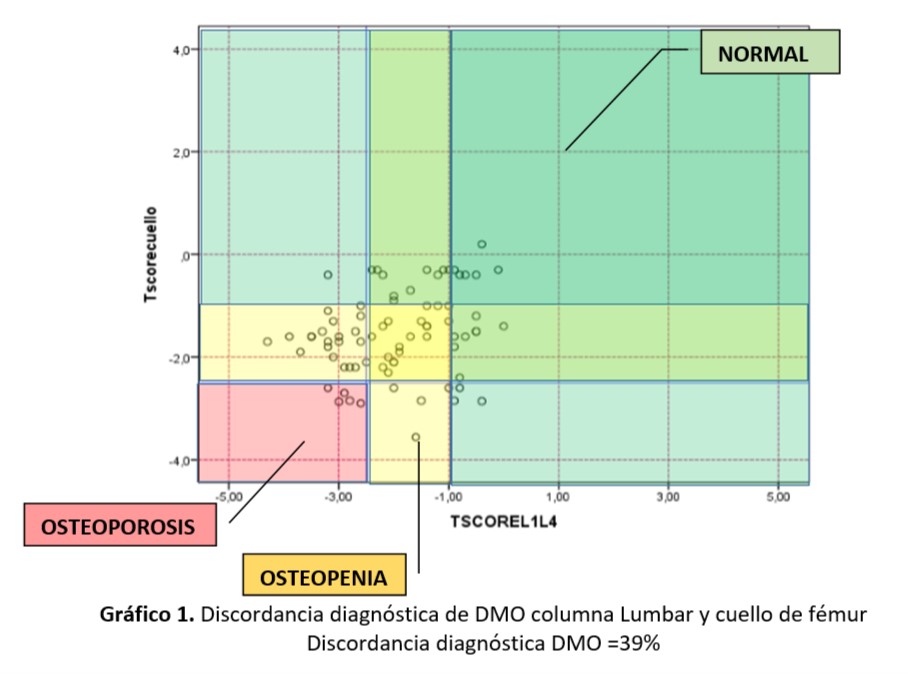
Tabla 6. Concordancia entre niveles de densidad mineral ósea de columna (L1-L4) y Cuello Femoral en la población de estudio. 77 mujeres postmenopáusicas asistidas en U.CLIM del Instituto Maternidad y Ginecología “Ntra. Sra. de las Mercedes”
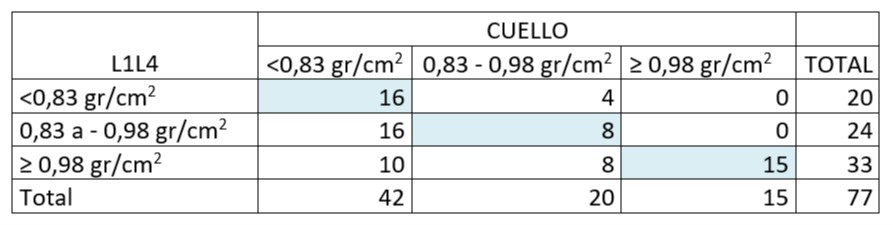
Al analizar la concordancia entre los niveles de densidad mineral ósea entre columna lumbar (L1-L4) y cuello de fémur se observó la concordancia en 39 de los niveles informados, representando 50,6% de concordancia. En los restantes 38 informes la discordancia fue del 49,4%. De este total en el 47% de ellos (18/38) la densidad mineral en L1-L4 se encontraba por encima del umbral de fractura y no concordaba con el diagnóstico de masa crítica en cuello de fémur. 4/20
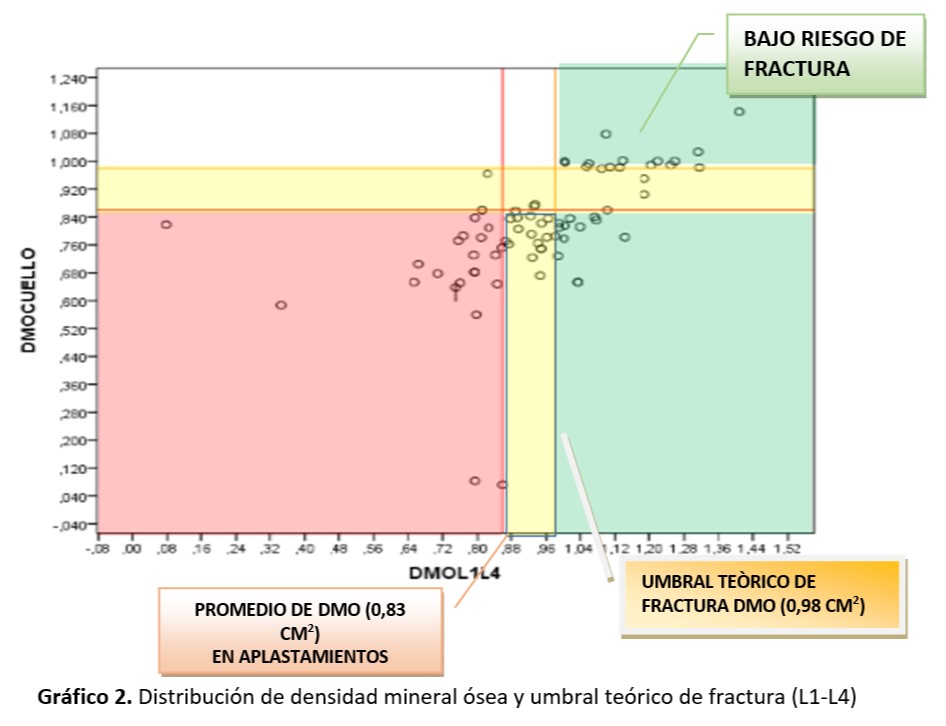 El 57% de las mujeres asistidas (44/77) presentaron su DMO por debajo del umbral de fractura (0.98/cm2) y de las 27 mujeres con osteoporosis en L1-L4, el 74% (20/27) tuvieron DMO por debajo del promedio (≤0.83 g/cm2) para aplastamiento vertebral en mujeres postmenopáusicas con osteoporosis. El 43% del total de pacientes (33/77) tuvo densidad mineral ≥0.98/cm2 con poco riesgo de fractura si se considera el umbral teórico.Tabla 7. Distribución de DMO de columna lumbar (L1- l4) considerando el tiempo de postmenopausia en años. U.CLIM del Instituto Maternidad y Ginecología “Ntra. Sra. de las Mercedes” (n= 71 mujeres)
El 57% de las mujeres asistidas (44/77) presentaron su DMO por debajo del umbral de fractura (0.98/cm2) y de las 27 mujeres con osteoporosis en L1-L4, el 74% (20/27) tuvieron DMO por debajo del promedio (≤0.83 g/cm2) para aplastamiento vertebral en mujeres postmenopáusicas con osteoporosis. El 43% del total de pacientes (33/77) tuvo densidad mineral ≥0.98/cm2 con poco riesgo de fractura si se considera el umbral teórico.Tabla 7. Distribución de DMO de columna lumbar (L1- l4) considerando el tiempo de postmenopausia en años. U.CLIM del Instituto Maternidad y Ginecología “Ntra. Sra. de las Mercedes” (n= 71 mujeres)

Se observa que a medida que se incrementa el tiempo en años de postmenopausia (PM) es mayor el número de mujeres con DMO por debajo del umbral crítico de fractura. A un tiempo mayor de 10 años el número de mujeres se duplica (2,2 veces) si se lo compara con el número de casos a un tiempo menor de 10 años

Del total de mujeres que tuvieron su menopausia en tiempo menor de 10 años (n=26) la mitad de ellas tuvieron niveles de DMO inferior a nivel teórico de fractura (n=13). Se observa aumento de la desmineralización en las mujeres con más de 10 años de PM.
Tabla 8. Distribución de DMO de cuello femoral (L1- l4) considerando el tiempo de postmenopausia en años. U.CLIM del Instituto Maternidad y Ginecología “Ntra. Sra. de las Mercedes” (n= 71 mujeres)
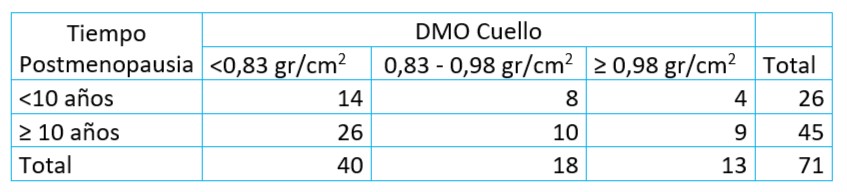
Se detectó que en menos de 10 años de PM el 84 % de las mujeres (22/26) presentaron niveles de mineralización ósea inferior al nivel de fractura y de ellas el 63% (14/22) tuvieron una densidad mineral de <0.83g/ cm2. A un tiempo ≥ 10 años de PM se observó un 80% de mujeres por debajo del umbral de fractura (<0,98 gr/cm2) y de ellas el 72% presentó <0,83 gr/cm2.

Gráfico 4. Distribución de densidad mineral ósea de cuello de fémur y tiempo de
Postmenopausia en años
Se observa que a medida que se incrementa el tiempo en años de postmenopausia (PM) es mayor el número de mujeres con DMO por debajo de 0,98gr/cm2. Sin embargo a menor tiempo de PM se encontró un número importante de mujeres que comparten la misma condición (22/26) y dentro de este grupo predominó el nivel óseo crítico <0,83 gr/cm2).
Tabla 9. Riesgo de fractura calculado con Herramienta FRAX en la población de estudio. 77 mujeres postmenopáusicas asistidas en U.CLIM del Instituto Maternidad y Ginecología “Ntra. Sra. de las Mercedes”
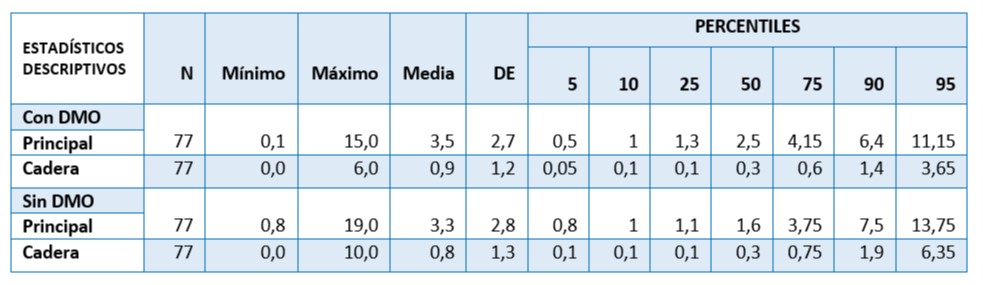
FRAX con DMO: El 90 % de las mujeres tuvieron riesgo de fractura principal ≤ 6,4% y el 5% >11% de riesgo en 10 años. El 90% de las pacientes tuvieron una probabilidad de cadera <1,4% y sólo el 5% >3%.
FRAX sin DMO: En el 5% de ellas se reportó un riesgo de fractura principal >10% y >3%de cadera. El 90 % registró riesgo de fractura principal del 7.5% y de cadera del 1,9%.
Tabla 10. Calculo de Riesgo de fractura con Herramienta FRAX y categorización de riesgo con Umbrales de Modelo Fridex. U.CLIM del Instituto Maternidad y Ginecología “Ntra. Sra. de las Mercedes”(n=77)
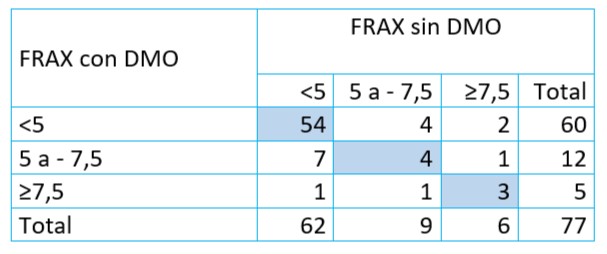
Nota: Categorización de Umbrales Modelo Fridex basal para fractura principal: riesgo bajo<5; intermedio≥5 <7,5 y alto≥7,5.
En esta tabla se considera el riesgo en tres niveles: bajo, moderado y alto por Modelo Fridex. Los resultados según riesgo concuerdan en un 79,2% (61/77). La mayor discordancia se observa en riesgo moderado (8/12). En riesgo alto 2 casos no se detectarían sin DMO (2,6%).
Nota: Umbrales de FRAX =10; Modelo Fridex para Fractura Principal: Riesgo Bajo<5; Intermedio≥5 <7,5 y Alto≥7,5.
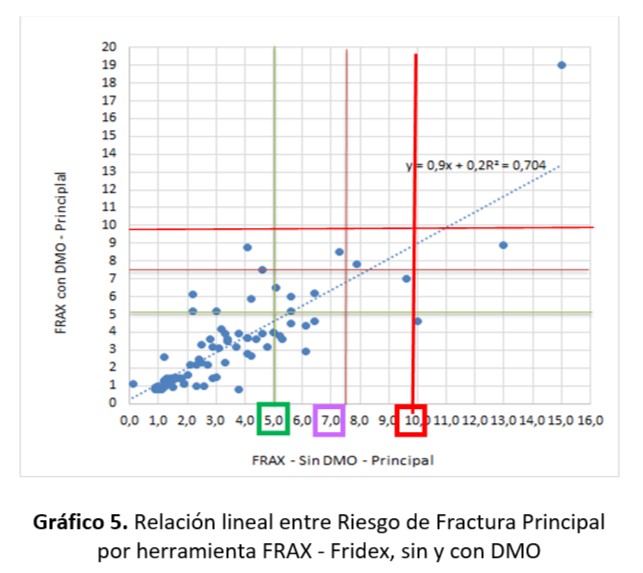
Al relacionar ambos FRAX (sin y con DMO) se obtuvo una relación lineal positiva de un 84%. La pendiente es igual a 0,90 es decir que el grado de variación de riesgo de fractura detectada con FRAX con DMO y aplicando FRAX sin DMO fue del 10%.
Si se considera que valores mayores o iguales a 10 (Umbral FRAX) se observa que existe un caso que sería diagnosticado de igual manera con ambos métodos. Y otro caso que se puede considerar como un falso positivo (detectado con Frax sin DMO) que correspondería a riesgo Alto con DMO en el Modelo Fridex.
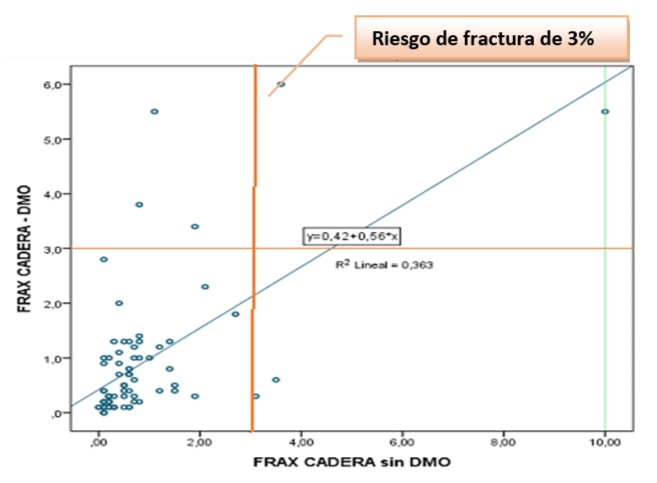
Gráfico 6. Relación lineal entre Riesgo de fractura de cadera por herramienta
FRAX sin y con DMO
Se identificaron 5 casos con FRAX ≥ 3% (con DMO) de los cuales 3 casos no hubieran sido detectados con FRAX sin DMO. Con DMO no se observaron casos con FRAX de Cadera de 10 o más riesgo, Con FRAX sin DMO se observó un caso con riesgo de fractura =10 (falso positivo); el resto de las pacientes mostraron un riesgo entre 3-4%.
Asociación entre FRCV (lipídicos – metabólicos) y niveles de densidad mineral ósea en los lugares óseos estudiados
DMO (L1-L4): Al analizar relación entre niveles de colesterol total (p=0,21), HDL (p=0,17), LDL (p=0,93), TG (p=0,98), Glucemia (p=0,94) e IR (p=0,56), SM (p=0,20) no se observó asociación significativa.
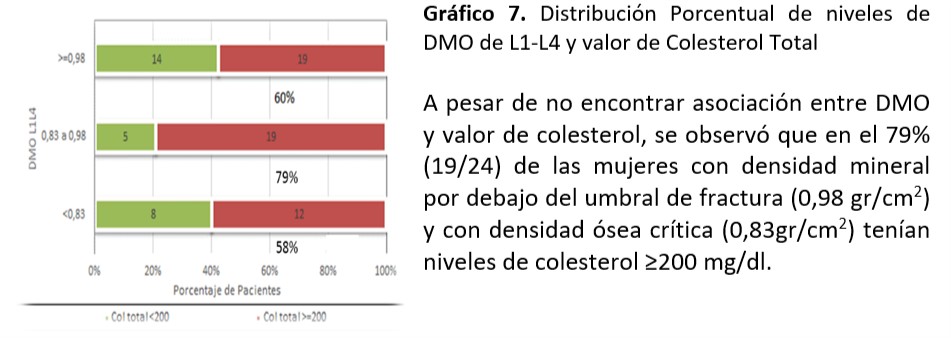
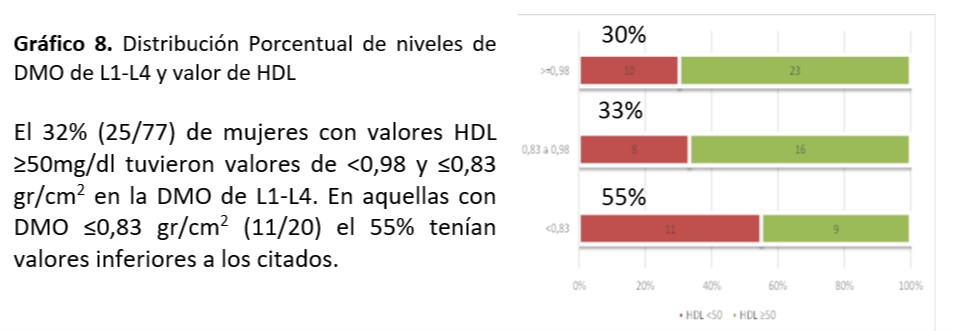
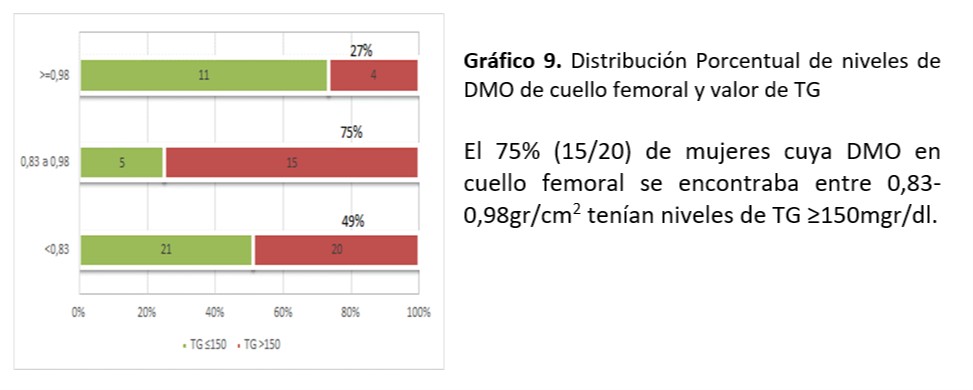
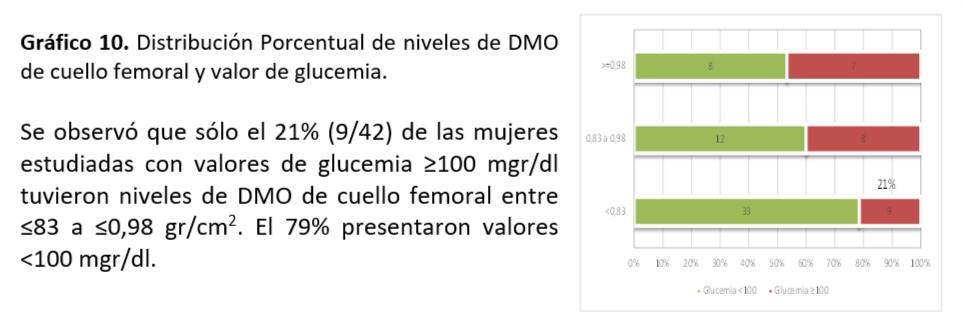
Cuello Femoral: Se observó asociación significativa entre valor de TG encontrado y mineralización de cuello femoral (p=0,016)
Al analizar relación entre niveles de colesterol total (p=0,51), HDL (p=0,34), LDL (p=0,36), Glucemia (0,12) e IR (0,39), SM (0,17) no se observó asociación significativa.
Asociación entre FRCV (lipídicos – metabólicos) y T-Score en los lugares óseos estudiados
Se seleccionaron los valores de FRCV próximos a p=0,10 para el cálculo de las condicionales horizontales de T-score
T-score (L1-L4): Al analizar relación entre niveles de colesterol total (p=0,96), TG (p=0,91), Glucemia (p=0,59) no se observó asociación significativa.
T-score (cuello femoral): Al analizar relación entre niveles de colesterol total (p=0,21), TG (p=0,50), Glucemia (p=0,18) no se observó asociación significativa.
DISCUSIÓN
La medición de los niveles séricos permitió determinar que el 65% de las mujeres asistidas tenían niveles inadecuados de 25(OH) Vit D y que sólo el 5% tenían valores óptimos. Por ese motivo se debería incentivar la consejería cálcica y de suplementos con Vitamina D y calcio con el objetivo de lograr además de los efectos esqueléticos una acción protectora sobre la fuerza muscular, el equilibrio y el riesgo de caídas.49
En este estudio se detectó que superado los 10 años de PM el número de mujeres con densidad mineral por debajo del umbral teórico de fractura se duplica. A medida que se incrementaba el tiempo en años de postmenopausia (PM) fue mayor el número de mujeres con disminución de la DMO por debajo del umbral crítico de fractura en el cuello femoral. Sin embargo a menor tiempo de PM se encontró un número importante de mujeres que comparten la misma condición (22/26) y dentro de este grupo predominó el de nivel óseo crítico (<0,83 gr/cm2). Esta desesperanza reinará en la mujer PM sino se implementan medidas correctivas que ya debieran haberse iniciado desde la juventud y permitirle llegar en mejor condición de mineralización. El 50% de las mujeres tucumanas asistidas en UCLIM tenían osteopenia L1-L4 y el 10 % osteoporosis en cuello femoral. Conocemos que si bien la tasa de fragilidad es más alta en mujeres con osteoporosis, el número absoluto de fracturas es mayor en pacientes con osteopenia.50 Nuestras cifras permiten sostener que ellas se encuentran en un estado de debilidad y no de fortaleza respecto al futuro óseo que enfrentan y debemos sostenerlas terapéuticamente. Según la Guía Nacional de Osteoporosis y las Guías NOF (Nacional Osteoporosis Foundation de EEUU) 49 cuando el riesgo de fractura es ≥20% para fractura principal y cuando es ≥3% para cuello femoral (Modelo FRAX) se debe determinar la necesidad de efectuar tratamiento. Sin embargo al considerar la categorización de los grupos de riesgo de fractura osteoporótica principal en riesgo bajo<5; intermedio≥5 y <7,5 y alto≥7,5 siguiendo el Modelo FRIDEX, se encontró que el 22% de las mujeres (17/22) tuvieron riesgo moderado y alto. Este hallazgo replantea su valoración y necesidad terapéutica. Para ello se debiera también considerar que el riesgo de fractura es un gradiente y no un umbral. La discrepancia de diagnóstico según el área informada concuerda con lo sostenido por Mautalen y cols.51 al afirmar que existe subdiagnóstico de osteoporosis en mujeres mayores de 50 años cuando no se considera el cuello de fémur como sugiere la International Osteoporosis Foundation (IOF). En nuestro estudio este resultado fue del 32%. En el trabajo de Silvina Mastaglia y Alicia Bagur y Alfredo Mautalen (UBA) 52 se informó un subdiagnóstico del 52% si la Osteoporosis era dimensionada sólo por cuello femoral mientras que en nuestros resultados ocurrió en el 68% de los casos. Debido a estas discrepancias confirmadas en la investigación realizada es que concordamos con la International Society for Clinical Densitometry (ISCD) 50 que sugiere evaluar Columna Lumbar y fémur proximal. El subdiagnostico cuando se estima únicamente por cuello femoral podría deberse a la tasa de remodelamiento diferente que tiene el hueso trabecular respecto al cortical. Por otra parte existe el concepto de riesgo de fractura y éste dependerá de su salud ósea. Así por ejemplo en una paciente con T- score -2.4 (osteopenia) el riesgo será igual al de otra con T- Score -2.6 (osteoporosis) y sin embargo serà mayor en una paciente con T-score -5 que otra con T-score -2.5 a pesar de pertenecer a la misma categoría diagnóstica51 El grado de variación de riesgo de fractura detectada por FRAX con DMO y aplicando FRAX sin DMO fue del 10% en columna lumbar. La herramienta de FRAX sin DMO online resultó más confiable al aplicarla para el cálculo de riesgo de fractura principal en L1-L4.
Se sigue planteando la conexión entre metabolismo óseo y factores de riesgo CV. El dilema es si existe relación entre los niveles lipídicos y la DMO ya que los resultados no son concluyentes. En el trabajo de relación entre dislipemia y parámetros de metabolismo óseo realizada de Irena Sushko52-55 se documenta que no se objetiva correlación entre los niveles lipídicos y los parámetros densitométricos en las mujeres mientras que existe correlación positiva en los varones entre la DMO de cadera y niveles de CT y LDL. También se encontró en las mujeres asociación entre valores de TG y valores de DMO (p=0, 0001) coincidente al nuestro donde se observó asociación significativa entre valor de TG≥ 150mg/dl encontrado y la desmineralización de cuello femoral (p=0,016). Por otra parte informaron correlación inversa en relación a niveles de HDL y DMO. En nuestra investigación a pesar de no demostrarse asociación, el 32% de mujeres con valores HDL ≥50mg/dl tuvieron valores de ≤0,83 gr/cm2 en la DMO de L1-L4. En aquellas con DMO ≤0,83 gr/cm2 (11/20) el 55% coincidían con esos valores. La fortaleza de nuestro estudio está dada por ser el primer reporte sobre la búsqueda de asociaciones entre los FRCV y los informes de DMO en mujeres climatéricas tucumanas. La limitación está en la relación temporal entre la densidad mineral ósea y la dislipidemia, situación que ocurre por ser un estudio de cohorte transversal.
CONCLUSIÓN
Debemos considerar que el valor aislado del FRAX® no debe suponer la toma de una decisión diagnóstico-terapéutica por sí misma, sino que se debe realizar una valoración global de la paciente y de sus factores de riesgo, para lo cual el FRAX® representa una herramienta útil ya que consolida la educación sanitaria de la atención. Cuando la densidad mineral ósea es extremadamente baja debemos profundizar la búsqueda de factores asociados a la misma. Considerar el riesgo a través de FRAX y categorizarla con el Modelo Fridex permitió descender el límite de riesgo del 20% para fractura principal e inicio del tratamiento. Al incluir a un mayor número de mujeres candidatas al tratamiento preventivo se las ayudaría a disminuir su riesgo óseo futuro. Se conoce que la pérdida de masa ósea comienza antes de la menopausia en forma solapada y al haber registrado en este estudio, en los primeros 10 años de PM, un 84% de mujeres con cifras inferiores a 0.83gr/cm2, es que recomendamos la medición de la DMO al inicio de la menopausia. Otro indicador a ser pesquisado y que reforzaría dicha indicación serían los valores de TG ≥150mgr/dl, ya que quedó demostrada como en otros estudios dicha asociación. Respecto a esto debería considerarse el hallazgo que reportamos sobre la densidad mineral ósea presente entre 0,83-0,98gr/cm2 asociada con esos niveles de TG. Finalmente ante la evidencia de que nuestras mujeres en esta etapa de la vida cursan con déficit de 25(OH) Vit D es que se transforman en candidatas para ser evaluadas a través del screening de la misma.
BIBLIOGRAFIA
- Francisco R. Spivacow, Ariel Sánchez Epidemiología y costos financieros de la Osteoporosis en Argentina Actualizaciones en Osteología, VOL. 6 - Nº 3 – 2010. Disponible en: osteologia.org.ar/files/pdf/rid25_5.pdf
- Schurman L, Bagur A, Claus-Hermberg H, et al (2007) [Argentine Guidelines for the Diagnosis, Prevention, and Treatment of Osteoporosis.] Actual Osteol 3:117-136; and Rev Arg Osteol 6(3):27-42 (double publication). Disponible en: iofbonehealth.org/health-professionals/national-regional-guidelines/
- The Latin America Regional Audit International Osteoporosis. Disponible en: https://www.iofbone-health.org/sites/default/.../2012-Latin_America_Audit-.
- Somma LF, Rosso GZ, Trobo RI, Barreira JC, Messina OD (2000) [Epidemiology of hip fracture in Luján, Argentina.] (Abstract). Osteology 3:267. Disponible en: https://www.iofbonehealth.org/.../2012-Latin_America_Audit-key_findings-Es...00
- Rubin CD. Emerging concepts in osteoporosis and bone strength. Curr Med Res Opin 2005; 21:1049-56. Disponible en: https://www.ncbi.nlm.nih.gov-/pubmed/16723-616
- Seeman E, Dlmas PD. Bone quality- the material and structural basis of bone strengh and fragility. N Engl J Med 2006; 354:2250-61. Disponible en: https://www.ncbi.nlm.nih.gov/pubmed/16723616
- Paradiñeiro Somoza A, Valero Crespo LM Patología de la mineralización ósea (y II). Disponible en; study LIB
- José Luis Ferretti. Masa, Calidad, Direccionalidad, Resistencia, Osteoporosis. Revista Argentina de Osteología Año 2018/Vol 16/Nº 1 Pág 7-8. Disponible en: https://www.osteoporosis.org.ar/
- Fracturas en pre-menopausia y embarazo Dra. Claudia Gómez Acotto Revista Argentina de Osteología Año 2018/Vol 16/Nº 1Pág 10. Disponible en: https://www.osteoporosis.org.ar/
- Ronayne de Ferrer PA (2007) [Intake of dairy products in Argentina: Evolution and present situation.] Actual Osteol 3:81-88. Disponible en: www.dieteticactiva.-com.ar/descarga-/2016-Silvia-Viggiola.pptx
- Oliveri B, Plantalech L, Bagur A, et al (2004) High prevalence of vitamin D insufficiency in healthy elderly people living at home in Argentina. Eur J Clin Nutr 58:337-342. Disponible en: https://www.ncbi.nlm.nih.gov/pubmed/14749755
- Plantalech L. Mapa de la hipovitaminosis D en Argentina. Actual Osteol 2005; 1: 11-6. Disponible en: osteologia.org.ar/files/pdf/rid5_art4.pdf
- Rodríguez JA, Valdivia G, Trincado P (2007) Vertebral fractures, osteoporosis and vitamin D levels in Chilean postmenopausal women. Rev Méd Chile 135:31-36. Disponible en-: https://www.researchgate.net/.../6437511_Vertebral_fractures
- Yezerska I, Hernández Hernández JL, Olmos Martínez JM, González Macías J. Dislipemia y metabolismo óseo. ¿Un vínculo común de la osteoporosis y la aterosclerosis? Rev Osteoporos Metab.Miner.2011;3(1):41-50... Disponible en: https://revistadeosteoporosisy-metabolismomine-ralcom./dislipemia-metabolismo-oseo
- Hernández JL, Riancho JA, González J. Síndrome metabólico, ¿también del hueso? Med Clin (Barc) 2008; 130:745-50. Disponible en: https://www.medigraphic.com-/cgi-bin/new/resumen.cgi?IDARTICULO=76960
- Persy V, De Broe M, Ketteler M. Bisphosphonates prevent experimental vascular calcification: treat the bone to cure the vessels? Kidney Int 2006; 70:1537-8. Disponible en: https://www.ncbi.nlm.nih.gov/pubmed/17051257
- Executive summary of the third report of the National Cholesterol Education Program (NCEP) expert panel of detection, evaluation, and treatment of high blood cholesterol in adults (Adult Treatment Panel III). JAMA 2001; 285:2486-97. Disponible en: https://www.ncbi.nlm.nih.gov/pubmed/11368702
- EUROASPIRE II Study Group. Lifestyle and risk factor management and use of drug therapies in coronary patients from 15 countries. Principal results from EUROASPIRE II Euro Heart Survey Programme. Eur Heart J 2001; 22:554-72 doi:10.1053/euhj.2001.2610. Disponible en: http://www.idealibrary.com on
- Nuzzo V, d´Milita AM, Cerraro T, Monaco A, Florio E, Miano P, et al. Analysis of skeletal status by quantitative ultrasonometry in a cohort of postmenopausal women with high blood cholesterol without documented osteoporosis. Ultrasound Med Biol 2009; 35:717-22. Disponible en: https://books.google.com.ar/
- Orozco P. Atherogenic lipid profile and elevated lipoprotein (a) are associated with lower bone mineral density in early postmenopausal overweight women. Eur J Epidemiol 2004; 19:1105-12. Disponible en: https://www.ncbi.nlm.nih. gov/pubmed
- Adami S, Braga V, Zamboni M, Gatti D, Rossini M, Bakri J, et al. Relationship between lipids and bone mass in two cohorts of healthy women and men. Calcif Tissue Int 2004; 74:136-42. Disponible en: https://www.ncbi.nlm.nih.gov/pmc-/articles/
- Dennison EM, Syddall HE, Aihie A, Martin HJ, Cooper C. Lipid profile, obesity and bone mineral density: the Hertfordshire Cohort Study. QJM 2007; 100:297-303. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2080690/
- Peter Vestergaard Incremento del riesgo de fracturas en pacientes con diabetes. Suplemento de Salud Ciencia 3, Nº2. 2007. Disponible en: www.siicsalud-.com/des/-expertoimpreso.php/84372
- Vestergaard P, Krogh K, Rejnmark L, Mosekilde L. Fracture rates and risk factors for fractures in patients with spinal cord injury. Spinal Cord 1998; 36:790-6. Disponible en: https://www.ncbi.nlm.nih.gov/pubmed/9848488
- Song Y, Wang L, Pittas AG, et al. Blood 25-hydroxy vitamin D levels and incident type 2 diabetes: a meta-analysis of prospective studies. Diabetes Care 2013; 36:1422-8. Disponible en: https://www.ncbi.nlm.nih.gov/pubmed/23613602
- Brance ML, Ramírez Stieben LA, Dobry R, Anca L, González A, Niveles de 25-hidroxi-vitamina D, densidad mineral ósea y fracturas vertebrales en pacientes con diabetes mellitus tipo 2 Actualizaciones en Osteología, VOL. 13 - N° 3 – 2017. Disponible en: https://www.ncbi.nlm.nih.gov/pubmed/23613602
- Chonchol M, Scragg R. 25-Hydroxyvitamin D, insulin resistance, and kidney function in the Third National Health and Nutrition Examination Survey. Kidney Int 2007; 71:134-9}. Disponible en: https://www.ncbi.nlm.nih.gov/pubmed
- León Schurman. Medicamento que afectan al hueso en positivo y en negativo – Antidiabéticos Revista Argentina de Osteología Año 2018 / Vol 16 / Nº 1Pág 13-14 Disponible en: https://www.osteoporosis.org.ar/
- De Boer IH, Tinker LF, Connelly S, et al; Women’s Health Initiative Investigators. Calcium plus vitamin D supplementation and the risk of incident diabetes in the Women’s Health Initiative. Diabetes Care 2008; 31:701-7. Disponible en: https://www.ncbi.nlm.nih.gov/pubmed/18235052
- Avenell A, Cook JA, MacLennan GS, McPherson GC; RECORD trial group. Vitamin D supplementation and type 2 diabetes: a substudy of a randomized placebo-controlled trial in older people. Age Ageing 2009; 38:606-9. Disponible en: https://www.ncbi.nlm.nih.gov/pubmed/19617604
- Wortsman J, Matsuoka LY, Chen TC, Lu Z, Holick MF. Decreased bioavailability of vitamin D in obesity. Am J Clin Nutr 2000; 72:690-3. Disponible en: https://www.ncbi.nlm.nih.gov/pubmed/10966885
- Wood RJ. Vitamin D and adipogenesis: new molecular insights. Nutr Rev 2008; 66:40-6. Disponible en: https://www.ncbi.nlm.nih.gov/pubmed/18254883
- Parker J, Hashmi O, Dutton D, et al. Levels of vitamin D and cardiometabolic disorders: systematic review and meta-analysis. Maturitas 2010; 65:225-36. Disponible en: https://www.ncbi.nlm.nih.gov/pubmed/20031348
- Oliveri B, Plantalech L, Bagur A, et al. High prevalence of vitamin D insufficiency in healthy elderly people living at home in Argentina. Eur J Clin Nutr 2004; 58:337-42. Disponible en: https://www.ncbi.nlm.nih.gov/pubmed/14749755
- Eugene McCloskey. FRAX - International Osteoporosis Foundation. Disponible en: ttps://www.iofbonehealth.org/sites/default/files/PDFs/.../FRAX_
- Siris ES1, Miller PD, Barrett-Connor E, Faulkner KG, Wehren LE, Abbott TA, Berger ML, Santora AC, Sherwood LM Osteopenia Identification and fracture outcomes of undiagnosed low bone mineral density in postmenopausal women: results from the National Osteoporosis Risk Assessment. 2001 Dec 12; 286(22):2815-22. Disponible en: https://www.ncbi.nlm.nih.gov/pubmed/
- Kanis JA, Johnell O, De Laet C, Johansson H, Oden A, Delmas P, Eisman J, Fujiwara S, Garnero P, Kroger H, McCloskey EV, Mellstrom D, Melton LJ, Pols H, Reeve J, Silman A, Tenenhouse A. A meta-analysis of previous fracture and subsequent fracture riskBone. 2004 Aug; 35(2):375-82. Disponible en: https://www.ncbi.nlm.nih.-gov/pubmed?db=pubmed...
- Kanis J.A. et al. (2008). Case finding for the management of osteoporosis with FRAX-assessment and intervention thresholds for the UK. Osteoporos Int 19(10): 1395-408. Disponible en: shef.ac.uk/NOGG
- Azagra, M. Zwart, A. Aguyé, J.C. Martín-Sánchez, E. Casado, M.A. Díaz-Herrera, et al. Fracture experience among participants from the FROCAT study: What thresholding is appropriate using the FRAX tool. Maturitas, 83 (2016), pp. 65-71. Disponible en: https://www.ncbi.nlm.nih.gov/pubmed/26546077
- Cristian Tebéa,b, Luis Miguel del Ríoc,d, Lidia CasaseRisk factors for fragility fractures in a cohort of Spanish women. Gac Sanit Vol.25 Nº6 Barcelona. 2011. Disponible en: cielo.isciii.es/scielo.php?script=sci_arttext&pid=S0213-91112011000600012.
- Azagra, G. Roca, J.C. Martín-Sánchez, E. Casado, G. Encabo, M. Zwart, et al.FRAX® thresholds to identify people with high or low risk of osteoporotic fracture in Spanish female population.Med Clin (Barc), 144 (2015), pp. 1-8. Disponible en: https://www.ncbi.nlm.nih.gov/pubmed/24461732
- Kanis, J.A. on behalf of the WHO Scientific Group (2008). Assessment of osteoporosis at the primary health-care level. Technical Report. Sheffield, WHO Collaborating Centre, University of Sheffield, UK. Disponible en: shef.ac.uk/FRAX
- Mastaglia S, Bagur A, Mautalen C. Prevalencia de osteoporosis: ¿qué medir: columna lumbar o fémur?, Salud e Investigación. Laboratorio de Enfermedades Metabólicas Oseas, Instituto de Inmunología, Genética y Metabolismo (INIGEM-UBA).Disponible en: aaomm.org.ar/reunion-2016/files/libro-resumenes-congreso.
- Gupta SK. Editorial: Prevalence of Osteoporosis in Women in Buenos Aires Based on Bone Mineral Density at the Lumbar Spine and Femur. J Clin Densitom 2016. Disponible en: dx.doi.org/10.1016/j. jocd.2016.03.005
- Mautalen C, et al. J Clin Densitom 2016 (en prensa) (10.1016/j. jocd.2016.01.003). Disponible en: osteologia.org.ar/files/pdf/rid51_
- Wright NC, et al. The recent prevalence of osteoporosis and low bone mass in the United States based on bone mineral density at the femoral neck or lumbar spine. J Bone Miner Res 2104; 29:2520-6. Disponible en: https: //www.ncbi.nim.nih.gov.
- Bagur A, Mautalen Prevalencia de osteoporosis: ¿qué medir: columna lumbar o fémur? Revista Argentina de Osteología. 2016 - Volumen 15; 2:4-5. Disponible en: https://www.osteoporosis.org.ar-/revista-/revistaSAO2016-12.pdf
- Rafael Azagra, Genís Roca., FRAX® thresholds to identify people with high or low risk of osteoporotic fracture in Spanish female population. Medicina Clínica. Volume 144, Issue 1, 6 January 2015, Pag. 1-8 Vol. 144. Disponible en: https://www.elsevier.es/es-revista-medicina-clinica-umbrales-frax-identificar-pdf
- León Schurman, Ana Galich. Guías Argentinas para el Diagnóstico, Prevención y el Tratamiento de la Osteoporosis. Medicina 2017; 77:46-60. Disponible en: osteologia.org.ar
- Francisco R. Spivacow. Ariel Sánchez. Epidemiología y Costos Financieros de Osteoporosis en Argentina, 2009. Actual Osteol.6 (3):184-193,2010. Disponible en: http//www.osteologìa.org.ar
- Mautalen C; Schlanchi A, Sigal D, et al. Prevalence of Osteoporosis in Woman in Bs. As. Base Bone Mineral Density at the Lumbar Spine and Femur. J Clin Densitom 2016; 19: 471-476. Disponible en: https://www.siicsalud.com/dato/
- Silvina Mastaglia y Alicia Bagur y Alfredo Mautalen. Prevalencia de Osteoporosis: Discrepancia de Acuerdo a las Áreas Esqueléticas de Medición. Actual Osteol 2016; 12 (3):162-168. Disponible en: osteologia.org.ar/files/pdf/rid52_mastaglia.pdf
- International Society for Clinical Densitometry 2013 ISCD Official positions Adult. Middletown CT: International Society for Clinical Densitometry. Disponible en: https://www.iscd.org/official-positions/2013-iscd-official-position.
- Luis del Rìo. Papel de la DMO en la Era del Disponible en: https://docplayer.es/27273036-Papel-de-la-densitometria-osea-en-la-era-del-frax-
- Irena Sushko Relación entre dislipemia y parámetros de metabolismo óseo en mujeres posmenopáusicas y varones mayores de 50 años en Cantabria. Disponible en: https://dialnet.unirioja.es/servlet/tesis?codigo=41708
Doctor en Medicina, Prof. Cátedra de Ginecología, Directora de la Carrera de Especialización de Tocoginecología, Médico Encargado de la Unidad de Climaterio1; Profesora de Cátedra de Bioestadística2; Comité Científico 3. Facultad de Medicina. Universidad Nacional de Tucumán1, 2; Instituto de Maternidad y Ginecología “Nuestra Señora de las Mercedes”.1, 2, 3
