Cáncer de Endometrio Concurrente en Pacientes con Diagnóstico de Hiperplasia Endometrial Atípica Sometidas a Histerectomía en el Hospital Privado Universitario de Córdoba: Nuestra Experiencia
Autores:
Beltramone N.1, de la Rocha H. G.1, Travella C.2, Bonin, M.3
Condensación
Análisis de prevalencia de cáncer de endometrio en pacientes con diagnostico de hiperplasia epitelial atípica y la influencia de sus factores de riesgo.
Palabras clave: biopsia endometrial, hiperplasia endometrial atípica, adenocarcinoma de endometrio, histerectomía.
Objetivo
Describir la prevalencia de cáncer de endometrio (CE) en pacientes con diagnóstico de hiperplasia endometrial atípica (HEA) mediante biopsia endometrial sometidas a histerectomía.
Materiales y métodos
Estudio retrospectivo, observacional y descriptivo. Se incluyeron 56 pacientes con diagnóstico de HEA (Clasificación OMS) en biopsia endometrial con posterior histerectomía sin tratamiento de intervalo. Luego se analizaron aquellas pacientes con hallazgo de CE en la pieza de histerectomía.
Resultados
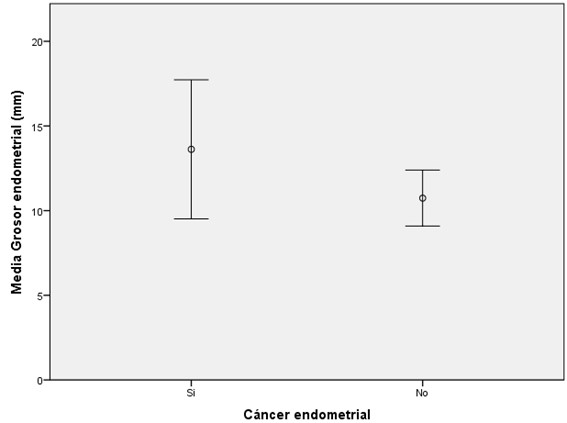
24 de 56 pacientes (42.8%) fueron diagnosticadas con CE en la pieza de histerectomía. El método de biopsia fue mediante cánula de Pipelle en 2 pacientes (3.5%) y biopsia histeroscópica en 54 pacientes (96.5%). En las pacientes con diagnóstico final de CE se observó un mayor grosor endometrial ecográfico que en las pacientes sin CE (13.6 vs 10.7mm, p=0.15). En cuanto al análisis histológico, un 62.5% de los CE fueron grado histológico I y un 37.5% grado histológico II. Por último, 18 de 24 pacientes (75%) con CE correspondieron a estadio FIGO IA, mientras que 5 (20.8%) correspondieron a estadio FIGO IB y una (4.2%) correspondió a estadio FIGO IIIA por compromiso ovárico.
Objectives
To describe the prevalence of endometrial cancer (EC) in patients diagnosed with atypical endometrial hyperplasia (AEH) that underwent hysterectomy.
Materials and methods
Retrospective, observational and descriptive study. 56 patients with AEH diagnosis (WHO criteria) were included, who underwent hysterectomy with no interval treatment after the endometrial byopsy. Patients with EC in the hysterectomy specimen were analysed.
Results
24 out of 56 (42.8%) were diagnosed with EC in hysterectomy specimen. The endometrial biopsy method was pipelle cannula in 2 cases (3.5%) and hysteroscopic biopsy in 54 cases (96.5%). In patients diagnosed with EC we observed increased endometrial thickness measured with ultrasound (13.6mm vs 10.7mm in the no EC group – p=0.15). The histologic grading of the EC revealed: G1 - 62.5%; G2 37.5% and no G3 cases. Finally, 18 out of 24 patients with CE (75%) corresponded to stage FIGO IA, 5 patients (20.8%) FIGO IB and one patient (4.2%) corresponded to stage FIGO IIIA due to ovarian involvement.
Introducción
El CE corresponde al tumor ginecológico más frecuente en países desarrollados, y ocupa el segundo lugar en países en vías de desarrollo, luego del cáncer de cérvix. Su diagnóstico en estadio I o II (estadios FIGO) se corresponde con sobrevida a 5 años de 92 y 75% respectivamente. La edad media de presentación de la patología es de 63 años y solo el 9% de los tumores ocurre en menores de 45 años, con un pico de incidencia entre los 55 a 74 años. (1)
En nuestro país la incidencia es de 8 tumores cada 100.000 mujeres y la mortalidad de 2 por 100.000 mujeres año, representando en frecuencia el 6to cáncer entre las mujeres. La incidencia en Argentina es menor que la de Europa y mucho menor que la de EEUU. Sin embargo, su incidencia se ve en continuo ascenso desde 1970 hasta la actualidad. Son dos los factores fundamentales que explican el aumento de la incidencia de esta patología: el envejecimiento de la población y el aumento de la obesidad en el transcurso de los últimos tiempos. Los principales factores de riesgo para desarrollar CE son sobre todo aquellos que producen exposición elevada y prolongada a los estrógenos: menarca temprana, obesidad, menopausia tardía, síndrome de ovario poliquístico, tumores productores de estrógenos, uso de tamoxifeno en la postmenopausia, antecedente familiar de primer grado y síndrome de Lynch. Algunos factores son claramente factores independientes mientras que otros como la Diabetes y la Hipertensión arterial están en revisión. (2)
Múltiples líneas de trabajo demuestran que la hiperplasia endometrial (HE) es una lesión precursora de esta patología, y que ambas comparten factores predisponentes. La HE es un diagnóstico histológico que se caracteriza principalmente por un aumento del índice glándula/estroma, comparado con el endometrio proliferativo normal. La incidencia de HE es tres veces mayor a la del CE, y las variantes con atipia celular se consideran precursores directos de dicha patología. (3) La clasificación histológica de la HE más utilizada es la propuesta por OMS en 1994, modificada en 2014, que diferencia entre HE benigna y premaligna, según la presencia o no de atipia citológica.(4) Actualmente la OMS clasifica a la HE en hiperplasia sin atipia e hiperplasia con atipia o neoplasia intraepitelial endometrial.(5)
El cuadro histológico de la HE sin atipia consiste en la presencia de una proliferación desordenada de glándulas que afectan a toda la mucosa endometrial. La citología es similar en todas las zonas examinadas y esto es el reflejo de que todo el endometrio responde de igual forma a la exposición de las hormonas, lo cual permite diferenciarlo de la HEA. El riesgo de progresión a CE es de 1 a 3%. (5)
Por otra parte, la HE con atipia consiste en una lesión premaligna monoclonal, con estratificación con presencia de hasta cuatro capas de células, pérdida de la polaridad y núcleos vesiculosos, hipercromáticos con nucléolo prominente.(6) Además, las células demuestran múltiples mutaciones genéticas presentes en el adenocarcinoma de endometrio (PTEN, KRAS, CTNNB1). El riesgo de progresión a CE es de 20-25% en pacientes con HE atípica.(5)
La principal manifestación clínica de la HE es la hemorragia uterina anormal, y aproximadamente en un 15% de pacientes con historia de hemorragia uterina anormal, se hace diagnóstico de alguna forma de HE.(7) En cuanto a marcadores ecográficos de HE y CE, se han descripto numerosos (13) , dentro de los cuales el principal corresponde a un grosor endometrial mayor a 4mm en pacientes postmenopáusicas, presencia de microquistes endometriales, señal doppler presente a nivel endometrial y heterogeneidad endometrial.
El tratamiento de la HE atípica en pacientes con paridad cumplida o postmenopáusicas es la histerectomía total con o sin salpingooforectomía bilateral. Para garantizar la seguridad oncológica del tratamiento es importante tener en cuenta el riesgo de CE concurrente en pacientes con HE atípica, que varía entre un 17% y un 52% (8), pero el riesgo en nuestra población aún no ha sido calculado. Un metaanálisis que evaluó 36 trabajos científicos en 2020, demostró que existe un riesgo de progresión anual de HE atípica a CE de 8%. (9)
Objetivos
Describir la prevalencia de CE concurrente en mujeres con diagnóstico de HEA en biopsia endometrial. en pacientes sometidas a histerectomía en nuestra institución. Además, analizar las características de pacientes con y sin CE en la pieza de histerectomía.
Material y Métodos
Es un estudio retrospectivo, descriptivo, observacional. Se realizó la búsqueda en los registros de Anatomía Patológica del Hospital Privado Universitario de Córdoba y del Hospital Raúl Ángel Ferreyra de aquellas pacientes con diagnóstico de HEA realizado mediante histeroscopia o con cánula de pipelle utilizando los siguientes términos “Hiperplasia simple con atipia”, “Hiperplasia compleja con atipia”, “Hiperplasia compleja”, “Hiperplasia con Atipia”, “Cáncer de endometrio”, “Adenocarcinoma de endometrio”.
Se incluyeron a pacientes con diagnóstico histológico de HEA, realizado mediante biopsia endometrial con cánula de Pipelle o biopsia histeroscópica entre los años 2010 y 2022. Además, se seleccionaron aquellas pacientes con hallazgo posterior de CE en pieza de histerectomía con biopsia previa compatible con HEA.
Criterios de elegibilidad
- Pacientes con diagnóstico de HE atípica mediante biopsia endometrial (pipelle, legrado o biopsia histeroscópica)
- Pacientes con diagnóstico de CE en pieza de histerectomía, con biopsia previa compatible con HEA.
Criterios de exclusión
- Paciente con diagnóstico de HE sin atipia
- Paciente con diagnóstico histológico previo de otro carcinoma del tracto genital.
- Paciente con diagnóstico anatomopatológico en otra institución de HEA.
- Paciente con diagnóstico anatomopatológico en otra institución de CE
Entre enero de 2010 y mayo de 2022 se encontraron 64 pacientes con diagnóstico de HEA mediante biopsia endometrial. De ellas, 2 pacientes fueron excluidas del estudio por haber sido sometidas a tratamiento médico, y 6 pacientes fueron excluidas al no haber continuado el tratamiento en nuestra institución. En total, se incluyeron 56 pacientes en el estudio. (Ver gráfico 1) Se dividió la muestra según el resultado de la pieza de histerectomía en pacientes con o sin CE, y a su vez estas últimas se las clasificó en base a la clasificación tumoral de la American Cancer Society.
Se analizaron las siguientes variables: edad, estado menopáusico, nuliparidad, diabetes, obesidad, hipertensión arterial, tabaquismo, antecedente familiar de CE y tratamiento previo con tamoxifeno. Además, se tuvo en cuenta el tiempo entre el diagnóstico y la realización de la cirugía, clasificándose esta según la vía realizada, ya sea abdominal, vaginal o laparoscópica.
Las biopsias de endometrio fueron analizadas por el mismo equipo de anatomía patológica, utilizando la clasificación histológica de la OMS para HE. Luego se diferenciaron aquellas pacientes con hallazgo de CE en la pieza de histerectomía. En cuanto al análisis histológico el grado tumoral y el estadio se basaron en la clasificación FIGO vigente.
Se revisaron las ecografías transvaginales, las cuales fueron realizadas por el mismo equipo de diagnóstico por imágenes. La exploración ecográfica se realizó con un ecógrafo Voluson S8 versión 2018 de GE Medical Systems, con sonda transvaginal RIC5-9A-RS de 3.8-9.3MHz con ángulo de 180°, que lleva incorporado Doppler pulsado y codificación color. En cuanto a los marcadores ecográficos asociados con HE, se analizaron el grosor endometrial, la presencia de pólipos endometriales, la detección de señal doppler a nivel endometrial, la presencia de microquistes y la presencia de heterogeneidad endometrial.
Los datos fueron registrados en base de datos de Excel y analizados con el programa estadístico IBM SPSS Statistics versión 2014. Las variables categóricas se expresaron en porcentaje. Las variables continuas se expresaron en promedio, mediana y desviación standard (DE) o rango intercuartílico según su distribución. Al tener un N superior a 50, se realizó el test de normalidad con el test de Kolmogorov – Smirnov. Las variables categóricas se compararon con chi2 o Fisher según el número y las variables continuas con test de ANOVA.
Resultados
Se analizaron los factores de riesgo de cada grupo de pacientes, los cuales se grafican en la Tabla 1. En total, 24 pacientes (42.8%) fueron diagnosticadas con adenocarcinoma de endometrio en la pieza de histerectomía, con una edad promedio de 62 años (DE 12.9). En las 32 pacientes restantes (57.2%) el diagnóstico final fue de HEA, con una edad promedio de 59 años (DE 9.4). El método de biopsia endometrial fue mediante biopsia histeroscópica en 54 pacientes (96.5%) y mediante cánula de Pipelle en 2 pacientes (3.5%).
No se encontraron diferencias significativas en cuanto a factores de riesgo para CE en las pacientes con o sin cáncer.
En cuanto a los hallazgos ecográficos, en las pacientes con CE se observó un mayor grosor endometrial medido por ecografía transvaginal que en las pacientes sin CE, sin diferencia estadísticamente significativa (13.6 vs 10.7mm, p=0.15) (Ver gráfico 2 y tabla 3). Se analizaron los informes ecográficos, y se clasificaron según hallazgo de doppler patológico a nivel endometrial, heterogeneidad endometrial, microquistes, pólipo endometrial, y la presencia de más de un hallazgo. Los resultados se grafican en la tabla 4.
El tiempo entre la biopsia endometrial y la histerectomía fue de 76 días en promedio (DE: 36) . Respecto a la vía de la histerectomía, 32 casos (57.1%) fueron por vía laparoscópica, 22 casos (39.2%) por vía laparotómica y 2 casos por vía vaginal (3.5%). En cuanto al análisis histológico, todos los CE correspondieron a adenocarcinoma endometroide. En total, 15 (62.5%) fueron bien diferenciados (grado histológico 1) y 9 (37.5%) moderadamente diferenciados (grado histológico 2). 18 pacientes (75%) con CE correspondieron a estadio FIGO IA, mientras que 5 de las restantes (20.8%) correspondieron a estadio FIGO IB y una paciente (4.2%) correspondió a estadio FIGO IIIA por compromiso ovárico (Tabla 2).
Discusión
Este estudio de pacientes con CE concurrente en pacientes con HEA sometidas a histerectomía reclutó un total de 56 pacientes y encontramos una tasa de CE concurrente del 42.8%. En otras poblaciones estudiadas la tasa varía desde un 17 a un 52%. 8-9 Al tratarse de un estudio en un único centro de tercer nivel que recibe derivaciones del interior del país, podríamos estar sobreestimando el riesgo de CE en comparación con estudios de población general o multicéntricos.
El diagnóstico histológico de HEA en la biopsia endometrial fue realizado por el mismo grupo de patología y con la clasificación propuesta por la OMS de 1994 - actualizada en 2004 - en todas las pacientes.5 La alta prevalencia de CE concurrente en pacientes con HEA puede deberse en parte a la variabilidad interobservador entre los patólogos, inclusive aquellos con experiencia. La tasa de acuerdo entre patólogos en un estudio con 306 biopsias identificadas como HEA fue solo del 38%. 15 La distinción morfológica entre HEA y CE de bajo grado suele ser muy sutil, inclusive para patólogos experimentados. Además, no hay ningún estudio molecular que hoy nos permita distinguir entre una y otra patología.
El tiempo transcurrido entre el diagnóstico de HEA y la histerectomía fue de 76 días en promedio. Los estudios que investigan CE concurrente en pacientes con HEA sugieren un tiempo máximo entre la biopsia e histerectomía de 90 días para catalogarlo como concurrente.9
Es interesante remarcar qué implicancia tiene el método de biopsia endometrial en la subestimación de CE concurrente. Un metaanálisis publicado en 2016 por Bourdel et al(12), estudió la relación entre el método de biopsia endometrial en casos de HEA (mediante legrado, ablación endometrial histeroscópica o biopsia histeroscópica) y el riesgo de subestimar al CE concurrente, y evidenció que la tasa de diagnóstico de CE fue de 32.7%, 5.8% y 45.3% respectivamente. En nuestras pacientes el método de biopsia fue mediante biopsia histeroscópica en un 96.5% de las pacientes, por lo que la tasa de CE concurrente coincide con la evidencia actual. Es importante tener en cuenta que la ablación endometrial no está disponible en todos los centros ya que es un método más costoso y requiere una mayor curva de aprendizaje en comparación a la biopsia guiada por histeroscopia y al legrado. 12
La edad promedio de nuestra población al momento del estudio fue de 62 años. Nuestro trabajo reclutó pacientes en pre y postmenopáusicas a diferencia de muchos estudios en donde solo se reclutaron pacientes postmenopáusicas.9
En el estudio de Vetter, M.H et al, no se lograron identificar factores predictores para la presencia de CE en aquellas pacientes con HEA, a excepción de la valoración del grosor endometrial. Ellos observaron que aquellas pacientes con HEA que presentaban un grosor endometrial mayor a 2cm tenían una probabilidad 4 veces mayor de presentar CE en la pieza de histerectomía. En nuestro trabajo se analizaron diferentes factores de riesgo para CE y obtuvimos resultados similares en ambos grupos de pacientes. 14 Sin embargo encontramos que el grupo de pacientes con CE concurrente tuvo mayor prevalencia de obesidad (79.1 vs 71.8% en pacientes sin CE), hipertensión arterial (50 vs 37.5%), nuliparidad (25 vs 18.7%), tabaquismo (20.8 vs 15.6%) y tratamiento previo con tamoxifeno (12.5 vs 6.2%), aunque ninguna de estas diferencias fue estadísticamente significativa (p>0.05). Además, la incidencia de sangrado uterino anormal fue mayor para el grupo de pacientes con CE (83.3%) que para el grupo sin CE (71.8%).
Estudiamos diferentes marcadores ecográficos para HEA y CE: la presencia de engrosamiento endometrial, pólipos, microquistes y heterogeneidad endometrial. Ninguno de ellos demostró influir en la presencia de CE en la pieza de histerectomía. Sin embargo encontramos una diferencia en cuanto al grosor endometrial, el cual fue mayor en el grupo de pacientes con diagnóstico final de CE concurrente pero sin alcanzar la significancia estadística (p>0.05). Este resultado en nuestro estudio puede deberse al pequeño tamaño de nuestra muestra. 13 El estudio retrospectivo Stachowicz et al considera el grosor endometrial como uno de los factores de mayor impacto a la hora de predecir aquellas pacientes con CE, sin importar la presencia o no de sangrado anormal. Esto nos hace pensar que el grado de engrosamiento endometrial tendría una relación con el hallazgo de CE concurrente. Como sugiere Stachowizs et al, es importante siempre una valoración inicial con ecografía transvaginal ya que el CE infiltrante, puede no presentarse como un engrosamiento focal sino infiltrando directamente el miometrio lo cual puede ser pasado por alto con la sola realización de histeroscopia.13 Todas las pacientes incluidas en nuestro estudio fueron sometidas a una evaluación ecográfica previa a la biopsia endometrial..
En cuanto al análisis histológico de las piezas de histerectomía con CE, el 99% presentaron un grado histológico bajo y el 75% de las pacientes con CE presentaron un estadio FIGO IA - infiltración miometrial menor al 50% -, resultados similares a otros autores. 14 La presencia de HEA en una pieza de histerectomía con CE suele ser factor de buen pronóstico, ya que se asocia con tumores indolentes y en estadios tempranos. Teniendo en cuenta los hallazgos la derivación temprana de estas pacientes a un cirujano ginecólogo-oncólogo le permitiría al paciente recibir el tratamiento adecuado evitando linfadenectomías de rutina.
El subdiagnóstico de CE puede resultar en una estadificación inadecuada y potencialmente un tratamiento subóptimo, sin embargo, se requieren estudios de mayor calidad y población para poder determinar con mayor certeza la proporción de pacientes con CE que tienen diagnóstico de HEA.
Conclusión
La tasa de CE concurrente en pacientes con diagnóstico de HEA varía según las poblaciones estudiadas, entre un 17 y un 52 %(8-10) siendo más frecuente en aquellas pacientes postmenopáusicas, obesas, hipertensas, tabaquistas y nulíparas. En nuestra población encontramos una tasa de CE concurrente de 42.8%. Coincidente con la evidencia actual (8-9), todos los casos de CE correspondieron a tumores de bajo grado (grado histológico 1 o 2). Además, la gran mayoría de los tumores (95.8%) fueron confinados al útero (estadio FIGO I A o B). Esto debe influir en la toma de decisiones terapéuticas, sobre todo en pacientes con deseo de fertilidad o con comorbilidades importantes que contraindiquen una histerectomía. Se necesita de un trabajo multicéntrico en nuestra población para investigar qué factores predicen la probabilidad de CE concurrente en pacientes con HEA.
Referencias
- Creasman WT, et al. Carcinoma of the corpus uteri. FIGO 26th annual report on the results of treatment in gynecological cancer. Int J Gynaecol Obstet 2006;95:S105–S143
- Franco G, et al. Cáncer de endometrio. Consenso de ginecología FASGO 2019.
- Sanderson P, et al. New concepts for an old problem: the diagnosis of endometrial hyperplasia. Hum Reprod Update. 2017, Mar. 23(2): 232-254
- Travagllino A, et al. Cancer risk in endometrial hyperplasia: WHO vs EIN. Histopathology 2018. doi: 10.1111/his.13776
- Emons G, et al. New WHO Classification of Endometrial Hyperplasias. Geburtsh Frauenheilk 2015; 75: 135-136
- Consenso Nacional Intersociedades sobre Cáncer de Endometrio. Rev Argent Radiol, w2017;81(3):242-255
- García Ayala E, et al. Hiperplasia endometrial: análisis de serie de casos diagnosticados en biopsia endometrial. Rev Chil Obstet Ginecol 2010; 75(3): 146-152.
- Trimble et al., Concurrent Endometrial Carcinoma in women with a biopsy diagnosis of Atypical Endometrial Hyperplasia. Cancer 2006;106:812-9.
- Doherty MT, et al. Concurrent and future risk of endometrial cancer in women with endometrial hyperplasia: A systematic review and metaanalysis (2020). PLoS ONE 15(4): e0232231.
- Tavassoli F, Kraus FT. Endometrial lesions in uteri resected for atypical endometrial hyperplasia. Am J Clin Pathol. 1978;70:770–779.
- Janicek MF, Rosenshein NB. Invasive endometrial cancer in uteri resected for atypical endometrial hyperplasia. Gynecol Oncol. 1994;52:373–378.
- 12. Bourdel N, Chauvet P, et al. Sampling in Atypical Endometrial Hyperplasia: Which Method Results in the Lowest Underestimation of Endometrial Cancer? A Systematic Review and Meta-analysis. J Minim Invasive Gynecol. 2016; 23(5):692–701. https://doi.org/10.1016/j.jmig.2016.03.017 PMID: 27058769
- 13. Stachowicz, N.; Smole´n, A. et al. Risk Assessment of Endometrial Hyperplasia or Endometrial Cancer with Simplified Ultrasound-Based Scoring Systems. Diagnostics 2021, 11, 442. https://doi.org/10.3390/ diagnostics11030442
- Vetter, M. H., Smith, B., Benedict, J., Hade, E. M., Bixel, K., Copeland, L. J., … Backes, F. J. (2019). Preoperative predictors of endometrial cancer at time of hysterectomy for endometrial intraepithelial neoplasia or complex atypical hyperplasia. American Journal of Obstetrics and Gynecology. doi:10.1016/j.ajog.2019.08.002
15.Zaino RJ, Kauderer J, Trimble CL, Silverberg SG, Curtin JP, Lim PC et al. (2006) Reproducibility of the diagnosis of atypical endometrial hyperplasia: a Gynecologic Oncology Group study. Cancer. 2006;106:804-811
Gráfico 1
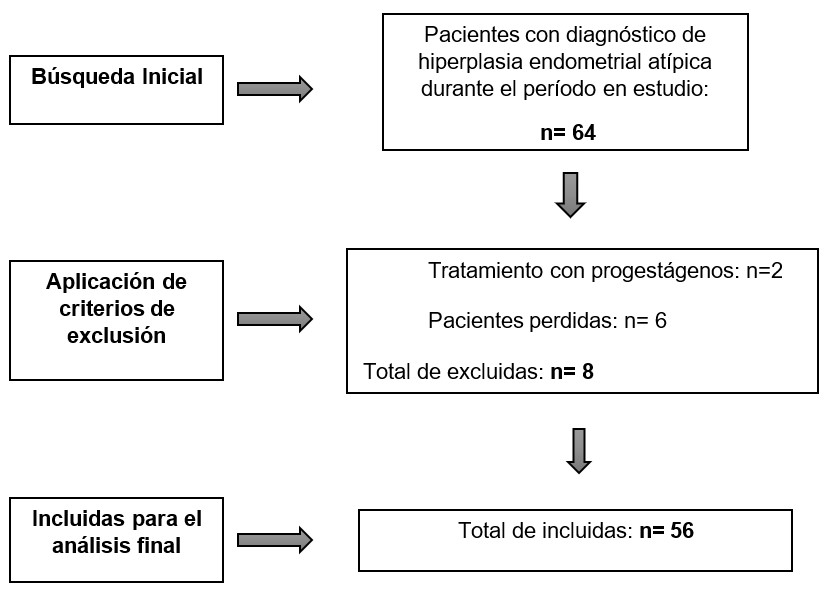
Gráfico 2
|
TABLA 1 |
Cáncer endometrial en pieza de histerectomía |
|||
|
Si (%) |
No (%) |
OR (95% IC) |
Valor de p |
|
|
Edad (DE) |
62 (12.9) |
59 (9.4) |
0.31 |
|
|
Sangrado uterino anormal |
20 (83.3) |
23 (71.8) |
1.95 (0.52 - 7.33) |
0.35 |
|
Antecedente familiar de cáncer endometrial |
2 (8) |
0 |
-- |
0.18 |
|
Postmenopausia |
19 (79.1) |
26 (81.2) |
0.87 (0.23-3.03) |
0.84 |
|
Nuliparidad |
6 (25) |
6 (18.7) |
1.44 (0.4-5.2) |
0.57 |
|
Diabetes mellitus |
7 (29.1) |
9 (37.5) |
1.05 (0.32 - 3.4) |
0.93 |
|
Obesidad |
19 (79.1) |
23 (71.8) |
1.48 (0.42 - 5.19) |
0.53 |
|
Hipertensión Arterial |
12 (50) |
12 (37.5) |
1.66 (0.57 - 4.87) |
0.35 |
|
Tamoxifeno |
3 (12.5) |
2 (6.2) |
2.14 (0.32 - 13.9) |
0.64 |
|
Tabaquismo |
5 (20.8) |
5 (15.6) |
1.42 (0.36 - 5.6) |
0.61 |
|
TABLA 2 |
Estadío FIGO |
||||
|
Estadío IA |
Estadío IB |
Estadío IIIA |
Total |
||
|
Grado histológico |
GH 1 |
11 |
4 |
0 |
15 |
|
GH 2 |
7 |
1 |
1 |
9 |
|
|
Si (%) |
No (%) |
Valor de p |
|||
|
Grosor endometrial en mm (DE) |
13.6 (9.7) |
10.7 (4.5) |
0.15 |
||
|
TABLA 3 |
Cáncer endometrial |
|
|
|
|
Si (%) |
No (%) |
Valor de p |
|
Grosor endometrial en mm (DE) |
13.6 (9.7) |
10.7 (4.5) |
0.15 |
|
TABLA 4 |
Cáncer endometrial
|
|
|
|
Hallazgo ecográfico |
Si (N=24) |
No (N=32) |
|
|
Doppler patológico |
2 |
2 |
|
|
Endometrio heterogéneo |
5 |
4 |
|
|
Microquistes |
1 |
6 |
|
|
Pólipo endometrial |
8 |
6 |
|
|
Más de un hallazgo |
4 |
8 |
|
|
Ningún hallazgo |
4 |
6 |
|
1. Medico Residente del Servicio de Ginecología y Obstetricia del Hospital Privado Universitario de Córdoba.
2. Medico Staff del Servicio de Ginecología y Obstetricia del Hospital Privado Universitario de Córdoba. Especialista en Alto Riesgo Obstétrico. Profesora Titular de Obstetricia IUCBC. Profesora adjunta carrera de grado de la UNC y UCC. Miembro del Comité Editorial de FASGO.
3. Medico Staff del Servicio de Ginecología y Obstetricia del Hospital Privado Universitario de Córdoba. Jefa del departamento de Ginecología y Cirugía Mínimamente Invasiva del Hospital Privado Universitario de Córdoba. Directora del Programa de Tratamiento Integral de Endometriosis del Hospital Privado Universitario de Córdoba. Miembro de la comisión directiva de SACIG y SAE.
