Jaque al diagnóstico de SAF. De la asistencia a la evidencia.
Autores:
Sebastián Udry1,2,3; Beatriz Grand4; Gabriela de Larrañaga2, Facundo Fiameni5,6, Fazio Juan Alberto7, Soledad Sagarna7, Diana Micaela Wagner1, Uranga Imaz Matias5;2, Voto Liliana4 y José Omar Latino1.
Objetivo
Evaluar el grado de asociación que presentan los criterios clínicos obstétricos asociados a Síndrome Antifosfolípido (SAF) con la presencia de anticuerpos antifosfolipídicos (aPL).
Pacientes y métodos
Estudio multicéntrico, retrospectivo y observacional de cohorte.
515 mujeres, a las cuales se les solicito aPL. Estratificadas en 2 grupos:
- Grupo 1: 408 pacientes que presentaban criterio clínico asociados a SAF obstétrico.
- Grupo 2: 107 pacientes con historia de al menos un hijo vivo, que no presentaron criterios clínicos asociados con el SAF obstétrico.
Para evaluar el grado de asociación de cada criterio clínico, comparamos la presencia de aPL de las pacientes del Grupo 1 vs Grupo 2 (para cada criterio clínico). Análisis estadístico: se utilizó una prueba de chi-cuadrado o Fisher para comparar proporciones. Se calcularon las razones de probabilidad (OR) y los intervalos de confianza (IC) del 95 % para evaluar la fuerza de la asociación. Se consideró que P<0,05 indicaba significación estadística.
Resultados
Perdida de 2 abortos tempranos: no asociado con aPL (p=0.17), perdida de 3 embarazos tempranos: no asociado con aPL (p= 0.12), perdida de 4 o más embarazos tempranos: asociado con aPL (p=0.0019, ODDS=5.0691, CI= 1.810-14.195), Feto Muerto: Asociado con aPL (p=0.036, ODDS= 2.765, CI= 1.033-7.4007), Preeclampsia: Asociado con aPL (p=<0.0001, ODDS= 6.8966, CI= 2.5446-18.6913) y Restricción de crecimiento intrauterino: Asociado con aPL (p= 0.00001, ODDS: 6.4286. CI= 2.4938-16.5715).
Conclusiones
Los aPL se encuentran fuertemente asociados a los criterios clásicos de SAF, por sobre todo en el caso de complicaciones vasculo-placentarias. No existe asociación entre presentar 2 perdidas tempranas y aPL, por lo que no se debería considerar a estas pacientes al momento de solicitar aPL.
Numero de Citas: 33
Palabras Claves: Aborto Recurrente, Síndrome Antifosfolípido, Perdida de Embarazo.
Introducción
El Síndrome Antifosfolípido (SAF) es una enfermedad autoinmune, que se caracteriza por la presencia persistente de anticuerpos antifosfolípidos (aPL), tales como anticoagulante lúpico (AL) y/o anticuerpos anticardiolipinas (aCL) y/o anticuerpos antiβ2Glicoproteína I (aβ2GPI), y clínica trombótica y/o morbilidad obstétrica. Los últimos criterios revisados para SAF incluyen la trombosis vascular (SAF trombótico) y la morbilidad durante el embarazo (SAF Obstétrico) (criterios del consenso de Sapporo revisados en Sídney en el año 2006).
Los eventos clínicos Obstétricos descriptos en el criterio de Sídney son:
- Pérdidas de embarazo después de la semana 10.
- Nacimiento prematuro de menos de 34 semanas debido a preeclampsia y/o a insuficiencia placentaria.
- 3 pérdidas de embarazo recurrentes de menos de 10 semanas de gestación.
En el año 2023 se plantearon nuevos criterios por la ACR/EULAR, con fines de investigación. En estos nuevos criterios, se realizó un replanteamiento de los criterios obstétricos: Los criterios asociados a problemas vasculo-placentarios fueron los que estuvieron más asociados con el síndrome antifosfolipídico, mientras que se disminuyo el peso que presentan los criterios asociados a perdidas de embarazo.
A pesar de este planteamiento, muchos autores plantean la necesidad de jerarquizar las perdidas de embarazo, a tal punto de solicitar estudios cuando la paciente presenta tan solo 2 abortos de menos de 10 semanas.
Ante esta controversia, nuestro grupo de estudio plantea la necesidad de re-evaluar la asociación de cada criterio clínico, con la presencia de anticuerpos antifosfolipídicos.
Objetivo:
- Evaluar la asociación que presenta cada criterio clínico obstétrico asociado a Síndrome antifosfolípido (SAF) con la presencia de anticuerpos antifosfolipídicos (aPL)
Materiales y Métodos:
Diseño
Estudio retrospectivo observacional multicéntrico de cohorte.
Población
515 mujeres asistidas desde 2008 hasta 2023 en diferentes centros de referencia (estudio Multicentrico), a las cuales se les solicito aPL.
Estas pacientes fueron estratificadas acorde a criterios clínicos asociados a el SAF:
Grupo 1: Pacientes que presentaban criterio clínico asociados a SAF obstétrico. Es decir, aquellas pacientes que presentaron:
- Al menos 3 abortos de menos de 10 semanas,
- Al menos un aborto mayor de 10 semanas y/o
- Un nacimiento de <34 semanas debido a preeclampsia, eclampsia y/o insuficiencia placentaria.
- Al menos 2 abortos de menos de 10 semanas
Grupo 2: Pacientes con historia de al menos un hijo vivo, que no presentaron perdidas de embarazo y/o criterios asociados con el SAF obstétrico.
Para evaluar el grado de asociación de cada criterio clínico, comparamos la presencia de aPL de las pacientes del Grupo 1 vs Grupo 2 (para cada criterio clínico). Realizamos un subanálisis de pacientes por cada criterio clínico evaluado.
Criterios de Inclusión
Grupo 1 y 2
- Pacientes mayores de 18 años, que se les solicito aPL
Grupo 1
- Pacientes que presentaron al menos uno de los siguientes criterios clínicos.
- Al menos 3 abortos de menos de 10 semanas,
- Al menos un aborto mayor de 10 semanas y/o
- Un nacimiento de <34 semanas debido a preeclampsia, eclampsia y/o insuficiencia placentaria.
- Al menos 2 abortos de menos de 10 semanas
- Pacientes mayores de 18 años
Grupo 2
- Pacientes que presentaron al menos un hijo vivo y sano
Criterios de Exclusión
Grupo 1 y Grupo 2
- Criterios clínicos para SAF trombótico
- Presentar otra enfermedad autoinmune
- Presentar otra patología que afecte severamente la salud y/o el análisis de los datos
- Presentar otra trombofilia asociada.
- Falta de datos para evaluar variables y/o falta de temporalidad de los datos
Grupo 2:
Presentar al menos uno de los siguientes criterios obstétricos:
a. Al menos 1 aborto
c. Un nacimiento de <34 semanas debido a preeclampsia, eclampsia y/o insuficiencia placentaria.
Muestreo
Secuencial: se ingresaron a todas las pacientes que fueron atendidas en los centros de estudio y cumplieron con los criterios de inclusión y no presentaron ningún criterio de exclusión.
Metodología del Estudio
Se buscaron los datos de pacientes con en historias clínicas de las instituciones. Se estableció una base de datos de Excel, con todos los datos y variables de las pacientes. Se realizo una evaluación estadística a través del programa SPSS 15.0 comparando las diferentes etapas.
Análisis Estadístico
Para el análisis estadístico se realizó utilizando el programa SPSS 15.0 para Windows (SPSS, Chicago, IL, USA). Se utilizó una prueba no paramétrica para comparar datos cuantitativos y la prueba de chi-cuadrado o Fisher para comparar proporciones. Se realizaron análisis de regresión logística binaria para evaluar la asociación entre los criterios clínicos y la presencia de aPL. Se calcularon las razones de probabilidad (OR) y los intervalos de confianza (IC) del 95 % para evaluar la fuerza de la asociación. Se consideró que P<0,05 indicaba significación estadística.
Procedimiento para garantizar los aspectos Étidos de la Investigación
Los datos sensibles relacionados al paciente estarán al resguardo de la confidencialidad y privacidad como así también de los datos surgidos de la investigación, mediante codificación de los mismos. Solamente tendrán acceso a estas informaciones los investigadores directamente relacionados al ensayo, los integrantes del Comité de Docencia y del Comité de Ética y autoridades competentes. Todos estos aspectos son tenidos en cuenta según las normativas de la Declaración Universal sobre el Genoma Humano y los Derechos Humanos UNESCO 1997, Declaración Internacional sobre los datos genéticos humanos UNESCO 2003, la Declaración Universal sobre Bioética, Derechos Humanos UNESCO 2005 y de la Declaración de Helsinski, versión 2008 y guía para Investigaciones en Salud Humana (GISH), resolución 1480/2011 MSN.
Laboratorio
Los criterios de laboratorio para SAF incluyen títulos moderados/altos de anticuerpos anticardiolipinas (aCL) IgG o IgM (> 40 GPL o MPL o > percentil 99) y/o anticuerpos anti Beta-2-Glicoproteina-1 (aβ2GPI) IgG o IgM (> percentil 99) y/o anticoagulante lúpico (LA), al menos dos veces con 12 semanas de diferencia. Se utilizaron ensayos de cribado para detectar LA de acuerdo con las directrices internacionales actuales. Los títulos ≥ 80 GPL o MPL para aCL o ≥ 80 AU para aβ2GPI se definieron arbitrariamente como títulos altos de anticuerpos antifosfolipídicos (aPL) según publicaciones anteriores.
Las mujeres se clasificaron según la positividad de aPL en las categorías de laboratorio de la siguiente manera: triple positivo para aPL (LA+, aCL+ y aβ2GPI+), doble positivo para aPL (LA+ y aCL+ o LA+ y aβ2GPI+, o aCL+ y aβ2GPI+) y positivo simple para aPL (LA+ o aCL+, o aβ2GPI+).
Resultados
515 pacientes divididas en 2 grupos:
- Grupo 1: 408 pacientes que presentaron al menos un criterio clínico obstétrico para APS y no presentaron criterio trombótico.
- Grupo 2: 107 pacientes con historia de al menos un hijo vivo, que no presentaron criterios asociados con el APS
Se comparo el grado de asociación entre aPL y cada uno de los criterios clínicos de APS, comparando Grupo 1 vs Grupo 2.
a. Pérdidas de 2 abortos de menos de 10 semanas.
- Grupo 1: 9/67 (13,4%)
- Grupo 2: 7/107 (6,54%)
No se encuentra asociado. P= 0.17
b. Pacientes con únicamente 2 abortos de menos de 10 semanas, no asociado a otros eventos obstétricos.
- Grupo 1: 1/35 (2,8%)
- Grupo 2: 7/107 (6,54%)
No se encuentra asociados a p=0.68
c. Pérdidas de 3 abortos de menos de 10 semanas
- Grupo 1: 9/59 (15,25%)
- Grupo 2: 7/107 (6,54%)
The p-value is .122158.
d. Perdidas de 3 abortos de menos de 10 semanas no asociado a otros eventos obstétricos.
- Grupo 1: 5/32 (15,6%)
- Grupo 2: 7/107 (6,54%)
The p-value is .212609
e. Perdidas de x>4 perdidas de 10 semanas
- Grupo 1: 11/42 (26,2%)
- Grupo 2: 7/107 (6,54%)
The p-value is .0019. ODDS = 5.0691, CI= 1.810 - 14.195
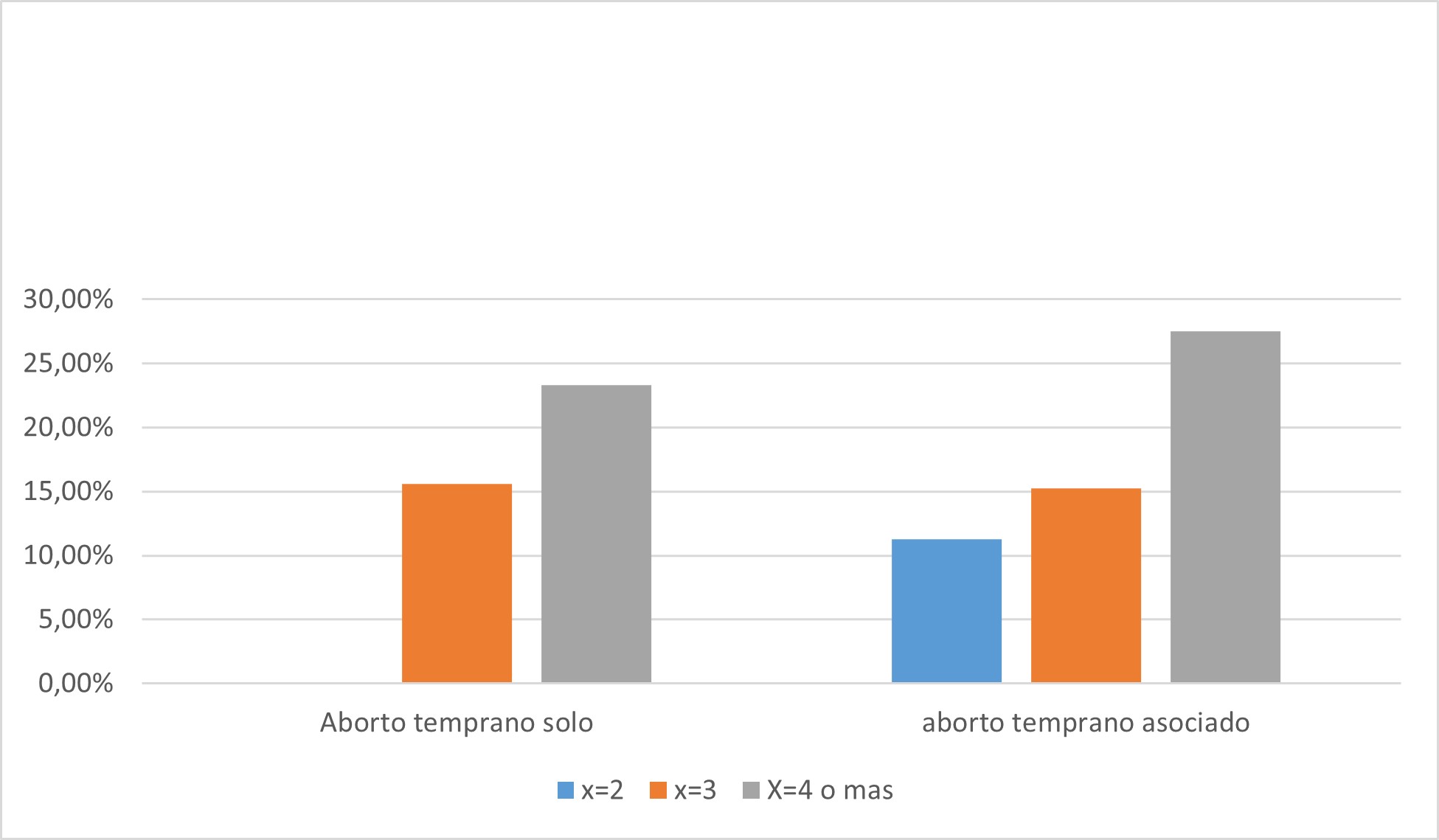
f. Perdidas de x>4 perdidas de 10 semanas únicamente
- Grupo 1: 7/32 (21,9%)
- Grupo 2: 7 /107 (6,54%)
The p-value is .0187 ODDS= 4.0, CI: 1.2849 – 12.452
El grado de asociación aumenta a mayor cantidad de perdidas de embarazo tempranas tenga la paciente
g. Perdidas de x>10 semanas
- Grupo 1: 30/ 163 (18,4%)
- Grupo 2: 7/107 (6,54%)
The p-value is 0.005. ODDS= 3.2223, CI= 1.36 - 7.6351
h. Perdida x>10 semanas no asociado a otro evento
- Grupo 1: 12/74 (16,2%)
- Grupo 2: 7/107 (6,54%)
The p-value is 0.036. ODDS= 2.765, CI= 1.033 - 7.4007
i. RCIU
- Grupo 1: 18/ 58 (31,0%)
- Grupo 2: 7/107 (6,54%)
P= 0.00001, ODDS: 6.4286 . CI= 2.4938 - 16.5715
j. Preeclampsia
- Grupo 1: 14/43 (32,5%)
- Grupo 2: 7/107 (6,54%)
P= <.0001, ODDS= 6.8966, CI= 2.5446 .- 18.6913
Discusión
Este es un estudio multicéntrico, representa una de las cohortes mas grandes a nivel mundial de pacientes con SAF OBSTETRICO PRIMARIO.
A nivel mundial, los criterios de SAF, continúan siendo un debate. Este debate tiene varios puntos de discusión. Algunos autores sostienen que no es necesario cumplir con la totalidad de los criterios, para iniciar el estudio de anticuerpos. El ejemplo mas claro de esta situación es el de la paciente que presenta 2 abortos tempranos. EN nuestro estudio se ha demostrado, que no existe ningún grado de asociación entre las pacientes que tienen 2 abortos y la presencia de aPL. En el ultimo consenso de FASGO en relación a la trombofilia, se sugiere considerar cada paciente por separado cuando se quiere solicitar anticuerpos. Un ejemplo de este caso seria los pacientes que presentan 2 abortos y que presentan algún marcador como podría ser la presencia de livedo racemosa. Esto también estará sustentado por el nuevo criterio de la ACR.
En nuestro estudio también se observo que a mayor cantidad de perdidas consecutivas presente la paciente, mayor será el grado de asociación con los aPL.
Nuestro panel de expertos sugiere tener en cuenta estos resultados y sugiere NO solicitar aPL en pacientes con 2 abortos espontáneos (salvo en casos muy puntuales en donde los marcadores reumatológicos lo sugieran).
En cuanto a el análisis de las complicaciones vasculoplacentarias, parecería ser que el SAF se encontraría altamente asociadas a las mismas. En nuestro estudio pudimos observar que existe una mayor asociación con complicaciones vasculoplacentarias, en comparación con las perdidas de embarazo. Estos resultados son en parte sustentados por los nuevos criterios de clasificación de la ACR, en donde le suman importancia a la Preeclampsia y al RCIU.
Conclusiones
Los aPL se encuentran fuertemente asociados a los criterios clásicos de SAF, por sobre todo en el caso de complicaciones vasculo-placentarias. No existe asociación entre presentar 2 perdidas tempranas y aPL, por lo que no se debería considerar a estas pacientes al momento de solicitar aPL.
Bibliografia
- Miyakis S, Lockshin MD, Atsumi T, Branch DW, Brey RL, Cervera R, et al. International consensus statement on an update of the classification criteria for definite antiphospholipid syndrome (APS). J Thromb Haemost. 2006;4:295–306.
- Massimo Radin , Silvia Grazietta Foddai, Alice Barinotti, Irene Cecchi , Elena Rubini , Savino Sciascia and Dario Roccatello. Reducing the diagnostic delay in Antiphospholipid Syndrome over time: a real world observation. J Rare Dis (2021) 16:280 https://doi.org/10.1186/s13023-021-01906-1
- Rai R, Cohen H, Dave M, Regan L. Randomised controlled trial of aspirin and aspirin plus heparin in pregnant women with recurrent miscarriage associated with phospholipid antibodies (or antiphospholipid antibodies). Bmj. 1997;314(7076):253-7.
- Franklin RD, Kutteh WH. Antiphospholipid antibodies (APA) and recurrent pregnancy loss: treating a unique APA positive population. Hum Reprod. 2002;17(11):2981-5.
- Mak A, Cheung MW, Cheak AA, Ho RC. Combination of heparin and aspirin is superior to aspirin alone in enhancing live births in patients with recurrent pregnancy loss and positive anti-phospholipid antibodies: a meta-analysis of randomized controlled trials and meta-regression. Rheumatology. 2010;49(2):281-8. doi:10.1093/rheumatology/kep373.
- Ruffatti A, Tonello M, Visentin MS, Bontadi A, Hoxha A, De Carolis S et al. Risk factors for pregnancy failure in patients with anti-phospholipid syndrome treated with conventional therapies: a multicentre, case-control study. Rheumatology. 2011;50(9):1684-9. doi:10.1093/rheumatology/ker139.
- Bramham K, Thomas M, Nelson-Piercy C, Khamashta M, Hunt BJ. First-trimester low-dose prednisolone in refractory antiphospholipid antibody-related pregnancy loss. Blood. 2011;117(25):6948-51. doi:10.1182/blood-2011-02-339234.
- Danowski A, de Azevedo MN, de Souza Papi JA, Petri M. Determinants of risk for venous and arterial thrombosis in primary antiphospholipid syndrome and in antiphospholipid syndrome with systemic lupus erythematosus. The Journal of rheumatology. 2009;36(6):1195-9. doi:10.3899/jrheum.081194.
- Simchen MJ, Dulitzki M, Rofe G, Shani H, Langevitz P, Schiff E et al. High positive antibody titers and adverse pregnancy outcome in women with antiphospholipid syndrome. Acta obstetricia et gynecologica Scandinavica. 2011;90(12):1428-33. doi:10.1111/j.1600-0412.2011.01236.x.
- De Carolis S, Botta A, Santucci S, Garofalo S, Martino C, Perrelli A et al. Predictors of pregnancy outcome in antiphospholipid syndrome: a review. Clinical reviews in allergy & immunology. 2010;38(2-3):116-24. doi:10.1007/s12016-009-8144-z.
- Ruffatti A, Tonello M, Cavazzana A, Bagatella P, Pengo V. Laboratory classification categories and pregnancy outcome in patients with primary antiphospholipid syndrome prescribed antithrombotic therapy. Thrombosis research. 2009;123(3):482-7. doi:10.1016/j.thromres.2008.03.012.
- Ruffatti A, Calligaro A, Hoxha A, Trevisanuto D, Ruffatti AT, Gervasi MT et al. Laboratory and clinical features of pregnant women with antiphospholipid syndrome and neonatal outcome. Arthritis care & research. 2010;62(3):302-7. doi:10.1002/acr.20098.
- Ruffatti A, Calligaro A, Del Ross T, Favaro M, Tonello M, Banzato A et al. Risk-based secondary prevention of obstetric antiphospholipid syndrome. Lupus. 2012;21(7):741-3. doi:10.1177/0961203312446388.
- Ruffatti A, Salvan E, Del Ross T, Gerosa M, Andreoli L, Maina A et al. Treatment strategies and pregnancy outcomes in antiphospholipid syndrome patients with thrombosis and triple antiphospholipid positivity. A European multicentre retrospective study. Thrombosis and haemostasis. 2014;112(4):727-35. doi:10.1160/TH14-03-0191.
- Saccone G, Berghella V, Maruotti GM, Ghi T, Rizzo G, Simonazzi G et al. Antiphospholipid antibody profile based obstetric outcomes of primary antiphospholipid syndrome: the PREGNANTS study. American journal of obstetrics and gynecology. 2017;216(5):525 e1- e12. doi:10.1016/j.ajog.2017.01.026.
- Latino JO, Udry S, Aranda FM, Peres Wingeyer SDA, Fernandez Romero DS, de Larranaga GF. Pregnancy failure in patients with obstetric antiphospholipid syndrome with conventional treatment: the influence of a triple positive antibody profile. Lupus. 2017;26(9):983-8. doi:10.1177/0961203317692432.
- Miyakis S, Lockshin MD, Atsumi T, Branch DW, Brey RL, Cervera R et al. International consensus statement on an update of the classification criteria for definite antiphospholipid syndrome (APS). Journal of thrombosis and haemostasis : JTH. 2006;4(2):295-306. doi:10.1111/j.1538-7836.2006.01753.x.
- Yelnik CM, Porter TF, Branch DW, Laskin CA, Merrill JT, Guerra MM et al. Brief Report: Changes in Antiphospholipid Antibody Titers During Pregnancy: Effects on Pregnancy Outcomes. Arthritis & rheumatology. 2016;68(8):1964-9. doi:10.1002/art.39668.
- Topping J, Quenby S, Farquharson R, Malia R, Greaves M. Marked variation in antiphospholipid antibodies during pregnancy: relationships to pregnancy outcome. Human reproduction. 1999;14(1):224-8.
- Carmona F, Font J, Azulay M, Creus M, Fabregues F, Cervera R et al. Risk factors associated with fetal losses in treated antiphospholipid syndrome pregnancies: a multivariate analysis. American journal of reproductive immunology. 2001;46(4):274-9.
- De Carolis S, Santucci S, Botta A, Salvi S, Degennaro VA, Garufi C et al. The relationship between TORCH complex false positivity and obstetric outcome in patients with antiphospholipid syndrome. Lupus. 2012;21(7):773-5. doi:10.1177/0961203312447866.
- Ruffatti A, Tonello M, Hoxha A, Sciascia S, Cuadrado MJ, Latino JO et al. Effect of Additional Treatments Combined with Conventional Therapies in Pregnant Patients with High-Risk Antiphospholipid Syndrome: A Multicentre Study. Thrombosis and haemostasis. 2018. doi:10.1055/s-0038-1632388.
- Del Papa N, Vaso N. Management of antiphospholipid syndrome. Therapeutic advances in musculoskeletal disease. 2010;2(4):221-7. doi:10.1177/1759720X10365969.
- de Larranaga GF, Forastiero RR, Carreras LO, Alonso BS. Different types of antiphospholipid antibodies in AIDS: a comparison with syphilis and the antiphospholipid syndrome. Thrombosis research. 1999;96(1):19-25.
- De Carolis S, Botta A, Salvi S, di Pasquo E, Del Sordo G, Garufi C et al. Is there any role for the hydroxychloroquine (HCQ) in refractory obstetrical antiphospholipid syndrome (APS) treatment? Autoimmunity reviews. 2015;14(9):760-2. doi:10.1016/j.autrev.2015.04.010.
- Viall CA, Chamley LW. Histopathology in the placentae of women with antiphospholipid antibodies: A systematic review of the literature. Autoimmunity reviews. 2015;14(5):446-71. doi:10.1016/j.autrev.2015.01.008.
- Devreese KM. Antiphospholipid antibodies: evaluation of the thrombotic risk. Thrombosis research. 2012;130 Suppl 1:S37-40. doi:10.1016/j.thromres.2012.08.270.
- Knight CL, Nelson-Piercy C. Management of systemic lupus erythematosus during pregnancy: challenges and solutions. Open access rheumatology : research and reviews. 2017;9:37-53. doi:10.2147/OARRR.S87828.
- Song Y, Wang HY, Qiao J, Liu P, Chi HB. Antiphospholipid Antibody Titers and Clinical Outcomes in Patients with Recurrent Miscarriage and Antiphospholipid Antibody Syndrome: A Prospective Study. Chinese medical journal. 2017;130(3):267-72. doi:10.4103/0366-6999.198934.
- Mekinian A, Loire-Berson P, Nicaise-Roland P, Lachassinne E, Stirnemann J, Boffa MC et al. Outcomes and treatment of obstetrical antiphospholipid syndrome in women with low antiphospholipid antibody levels. Journal of reproductive immunology. 2012;94(2):222-6. doi:10.1016/j.jri.2012.02.004.
- Riancho-Zarrabeitia L, Daroca G, Munoz P, Lopez-Hoyos M, Haya A, Martinez-Taboada VM. Serological evolution in women with positive antiphospholipid antibodies. Seminars in arthritis and rheumatism. 2017;47(3):397-402. doi:10.1016/j.semarthrit.2017.05.001.
- Broder A, Putterman C. Hydroxychloroquine use is associated with lower odds of persistently positive antiphospholipid antibodies and/or lupus anticoagulant in systemic lupus erythematosus. The Journal of rheumatology. 2013;40(1):30-3. doi:10.3899/jrheum.120157.
- Medha Barbhaiya # 1, Stephane Zuily # 2, Ray Naden, The 2023 ACR/EULAR Antiphospholipid Syndrome Classification Criteria. Arthritis Rheumatol. 2023 Oct;75(10):1687-1702. doi: 10.1002/art.42624. Epub 2023 Aug 28.
- Hospital de Agudos "Dr. Carlos G. Durand", Av. Díaz Vélez 5044, Ciudad de Buenos Aires, Argentina.
- Hospital de Enfermedades Infecciosas "Dr. Francisco J. Muñiz", Uspallata 2272, Ciudad de Buenos Aires, Argentina.
- Centro de investigación “Fundación Respirar”, Av. Cabildo 1548, Ciudad de Buenos Aires, Argentina.
- Hospital de Agudos “Hospital Fernandez”, Av Cerviño 3356, Ciudad de Buenos Aires, Argentina.
- Hospital Alemán, Pueyrredón 1640, Ciudad de Buenos Aires, Argentina.
- Hospital Ramos Mejia, General Urquiza 609, Ciudad de Buenos Aires, Argentina.
- Hospital Materno Infantil de San Isidro, “Carlos Gian Antonio”, Diego Palma 505, Buenos Aires, Argentina.