Implementación del Test de VPH en el Algoritmo Diagnóstico para la Prevención del Cáncer de Cuello Uterino en Hospital Materno Infantil (HPMI) de Salta

Autores:
Romero, Valeria Luciana; Haro, Julieta; Sierralta, Marianela; Pastorutti, Sofía; Romero, Analía; Rivas, Hugo; Sanchez Wilde, Cristina; Condorí Vanina Jacqueline; Poma, Hugo Ramiro; Zago María Paola,
Introducción
Salta lidera las provincias del Noroeste con la mayor tasa de mortalidad por CCU. El test del Virus del Papiloma Humano (VPH) demostró ser superior en sensibilidad a otras estrategias para la detección de lesiones preneoplásicas que sí pueden ser tratadas y así evitar el progreso a Cáncer Cervicouterino (CCU). El HPMI incorporó la tecnología para detectar como tamizaje primario los VPH de alto riesgo oncogénico con genotipificación extendida ya que no todos tienen el mismo poder oncogénico. Esta estrategia se la desea incluir en un nuevo algoritmo diagnóstico propuesto por el hospital para disminuir la incidencia de CCU en nuestra población y aumentar la cobertura de mujeres testeadas.
Objetivos
Estudiar la epidemiología local de infecciones por VPHar: positividad y frecuencia de genotipos. Además, analizar la distribución de genotipos en aquellas pacientes con citodiagnóstico positivo (ASCUS, ASC-H, LSIL y HSIL).
Materiales y métodos
Estudio descriptivo transversal. Entre noviembre del 2023 y julio del 2024, se estudiaron los cepillados endocervicales de 951 mujeres entre 25 y 65 años, no embarazadas, que acudieron al HPMI a su control ginecológico. Las muestras fueron tomadas con BD OnclarityTM HPV Cervical Brush Collection Kit y analizadas con la tecnología de BD Onclarity™ HPV Assay en la plataforma automatizada BD Viper. Los genotipos analizados para cada paciente fueron 16, 18, 31, 45, 51, 52, y grupos (33/58), (56/59/66) y (35/39/68). En la consulta también se tomó una muestra para citodiagnóstico que fue teñida con la técnica de Papanicolau y clasificadas según Bethesda en Negativo, LSIL y HSIL, ASCUS y ASC-H.
Resultados
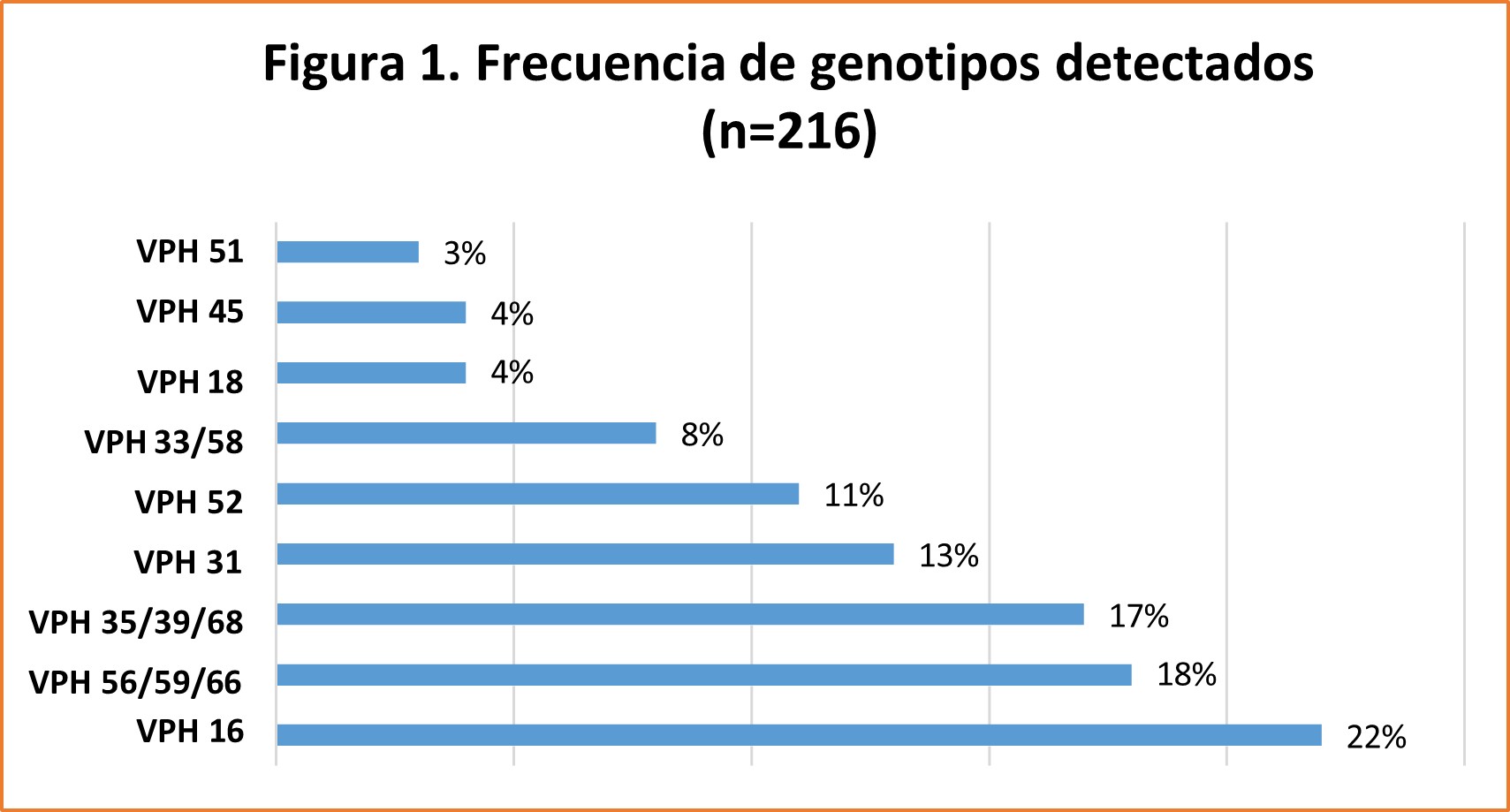
La proporción de pacientes positivas para VPHar fue de un 23%. EL VPH 16 resultó ser el más frecuente (22%), seguido por los genotipos (56/59/66) (18%), (35/39/68) (17%), 31 (13%), 52 (11%), (33/58) (8%), 18 y 45 (4%) y 51 (3%). Figura 1
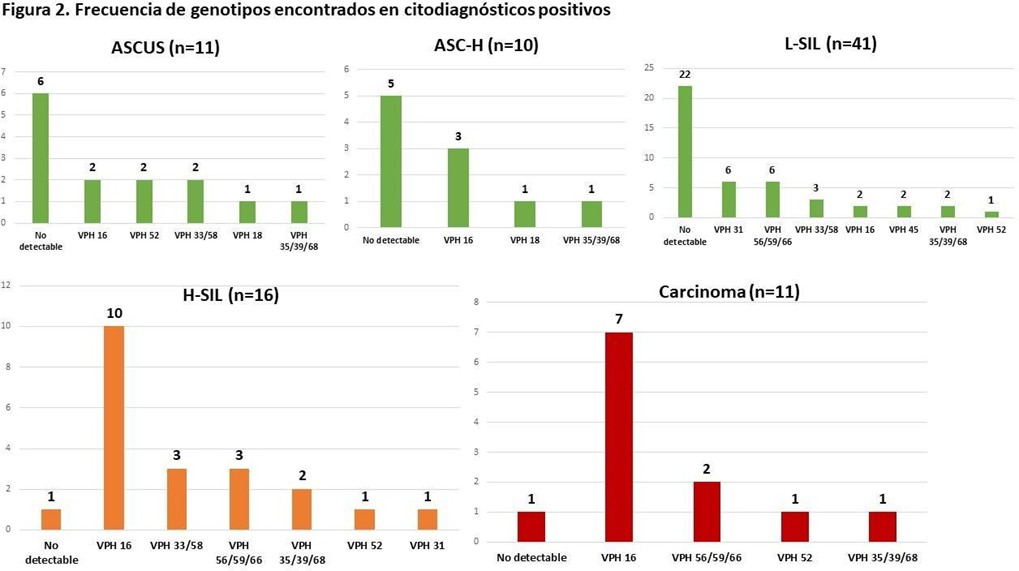
En cuanto a los vidrios analizados por Papanicolau (n=907), se observó que en pacientes con ASCUS, ASC-H y L-SIL, la mayoría de los tests de VPH fueron No detectables, seguidos por el VPH 16 en ASCUS y ASC-H y el genotipo 31 en L-SIL. En lesiones de alto grado, sólo un caso fue No detectable y la mayoría resultó VPH 16, seguida en frecuencia por 33/58, 56/59/66 y 35/39/68. En los carcinomas detectados se observó un patrón de distribución similar al H-SIL. Figura 2.
Conclusión
La elevada positividad para el test de VPH hallada en nuestra población (positividad nacional: 15%) podría ser una razón para la alta tasa de CCU diagnosticado en nuestro medio. En la población que estudiamos, observamos que el genotipo 16 predomina de manera significativa en las lesiones de alto grado y en los casos de carcinoma cervical, lo
que subraya su papel crítico en la progresión hacia neoplasias malignas. Este hallazgo es consistente con su inclusión en las vacunas actuales, dado su alto riesgo oncogénico. Sin embargo, identificamos que los genotipos (56/ 59/ 66) y (35/39 68) los cuales no están incluidos en las vacunas disponibles, también presentan una frecuencia notable en H-SIL y CCU, lo que destaca la necesidad de vigilancia y potencialmente de nuevas estrategias preventivas. Estos genotipos emergentes podrían tener un impacto relevante en la oncogénesis cervical, lo que sugiere que la cobertura vacunal actual podría no ser completamente efectiva en prevenir todas las lesiones precancerosas en nuestra población.
Referencias
- American Society of Colcoscopy and Cervical (2019). ASCCP Risk- Based Management Consensus Guidelines for Abnormal Cervical Cancer Screening Tests and Cancer Precursors.
- Bottari F, Iacobone AD. (2019). Profile of the BD HPV OnclarityTM assay. Expert Review of Molecular Diagnostics 19(7): 565–570.
- Bouvard V, Baan R, Straif K, Grosse Y, Secretan B, El Ghissassi F, y (2009). WHO International Agency for Research on Cancer Monograph Working Group. A review of human carcinogens – Part B: biological agents. Lancet Oncology 10(4): 321–332.
- Burd EM. (2003). Human papillomavirus and cervical cancer. Clinical Microbiology Reviews 16: 1-17
- Correa RM, Baena A, Valls J, Colucci MC, Mendoza L, Rol M, etal (2022). Distribution of human papillomavirus genotypes by severity of cervical lesions in HPV screened positive women from the ESTAMPA study in Latin PLoS One. 29 de julio de 2022;17(7):e0272205.
- de Villiers EM, Fauquet C, Broker TR, Bernard HU, zur Hausen H. (2004). Classification of papillomaviruses. Virology 324: 17-27.
- (2019) Executive Summary New Approaches in the Evaluation for High-Risk Human Papillomavirus Nucleic Acid Detection Devices Prepared for the March 8, 2019 meeting of the Microbiology Devices Panel of the Medical Devices Advisory Committee. Available at: https://www.fda.gov/media/122799/download. Accessed November 2, 2019.
- International Agency for Research on Cancer, IARC. (2012). Biological agents. IARC Monogr Eval Carcinog RisksHum. 100B:1–475.
- International Agency for Research on Cancer, IARC (2022). IARC handbooks of cancer prevention. Cervical CancerScreening (Vol. 18). Lyon, France: IARC Press.
- Karlsen FK, Kalantari M, Jenkins A, Pettersen E, Kristensen G, Holm R, Johansson B, Hagmar B. (1996). Use ofMultiple PCR Primer Sets for Optimal Detection of Human Papillomavirus. Journal of Clinical Microbiology: 2095–2100.
- Khan MJ, Castle PE, Lorincz AT, Wacholder S, Sherman M, Scott DR, Rush BB, Glass AG, Schiffman M (2005). Theelevated 10-year risk of cervical precancer and cancer in women with human papillomavirus (HPV) type 16 or 18and the possible utility of type-specific HPV testing in clinical practice. J Natl Cancer Inst. 20;97(14):1072-9. doi:10.1093/jnci/dji187. PMID: 16030305.
- Koliopoulos G, Nyaga VN, Santesso N, Bryant A, Martin-Hirsch PPL, Mustafa RA, y col. (2017). Cytology versus HPVtesting for cervical cancer screening in the general population. Cochrane Database Syst Rev. 8:CD008587.
- Martinelli M, Giubbi C, Saderi L, Musumeci R, Perdoni F, Leone BE, et al (2023). Evaluation of Human Papilloma Virus (HPV) Genotyping and Viral Load Determination as Diagnostic Biomarkers of Cervical Cancer Risk. Int J Mol Sci. 10 de enero de 2023;24(2):1320.
- Ministerio de Salud de la Nación – Instituto Nacional del Cáncer. (2024) Disponible en: Mortalidad por cáncer cervicouterino | Argentina.gob.ar
- Ministerio de Salud de la Nación - Instituto Nacional del Cáncer. (2015) Prevención del Cáncer Cérvico-Uterino Recomendaciones para el tamizaje, seguimiento y tratamiento de mujeres para la prevención del cáncer cervicouterino en el marco de la incorporación de la prueba de VPH.
- OMS (2014) Comprehensive cervical cancer control: a guide to essential practice, 2nd ed. Disponible en:https://apps.who.int/iris/handle/10665/144785
- OMS (2021) WHO guideline for screening and treatment of cervical pre-cancer lesions for cervical cáncer prevention, second edition. https://www.who.int/publications/i/item/9789240030824
- PAHO (2016) Incorporación de la prueba del virus del papiloma humano en programas de prevención de cáncer cervicouterino - Manual para gerentes de programas de salud. https://iris.paho.org/handle/10665.2/31223.
- Peirone V. Cortez Gamarra C. Miranda Saravia C. Rivas H. Nader M. (2017). Perfil epidemiológico del cáncerginecológico diagnosticado en el Hospital Público Materno Infantil de Salta en un periodo de 6 años. Trabajo deInvestigación del Hospital Público Materno Infantil.
- Schiffman M, Castle (2005). The promise of global cervical-cancer prevention. New England Journal of Medicine, 353(20), 2101-2104.
- Torres-Ibarra L, Cuzick J, Lorincz AT, Spiegelman D, Lazcano-Ponce E, Franco EL, et al (2019). Comparison of HPV-16 and HPV-18 Genotyping and Cytological Testing as Triage Testing Within Human Papillomavirus–Based Screening in Mexico. JAMA Netw Open. 20 de noviembre de 2019;2(11):e1915781.
- zur Hausen (2009). Papillomaviruses in the causation of human cancers: a brief historical account. Virology 384:260-265. Fabio Bottari & Anna Daniela Iacobone (2019) Profile of the BD HPV OnclarityTM assay, Expert Review of Molecular Diagnostics, 19:7, 565-570.
1. Hospital Materno Infantil (HPMI) de Salta