Resultados entre esquemas de estimulación ovárica controlada tratadas con monoterapia (FSHr) y esquema combinado (FSHr + hMG) a través del índice FOI
Results between controlled ovarian stimulation regimens treated with monotherapy (rFSH) and combined regimen (rFSH + hMG) through the FOI index.
Autores:
Ignacio Manuel Lagunas Bustos1, Eduardo González Franco2, Acela Marlen Santamaría Benhumea3
Resumen
Objetivo: Correlacionar el diámetro de la vaina del nervio óptico mediante ultrasonografía transorbitaria, con Hipertensión Inducida en el embarazo en gestantes del Hospital “Dr. Rafael Calles Sierra” Falcón Venezuela. Metodología: Estudio prospectivo, analítico, correlacional, transversal, de caso y control, muestra 40 gestantes con embarazo mayor de 20 semanas, divididas en 2 grupos, control: gestantes sanas y estudio: gestantes con enfermedad hipertensiva del embarazo, se realizó la medición del diámetro de la vaina del nervio óptico y posteriormente se asoció con la presencia de Hipertensión Inducida en el embarazo. Resultado: El diámetro de la vaina del nervio óptico fue normal (menor de 4mm) en gestantes sin trastorno hipertensivo, mientras que, en 13 gestantes (70%) del grupo estudio se encontró elevado (mayor de 4mm). Conclusión: Existe una relación estadísticamente significativa entre la alteración del diámetro de la vaina del nervio óptico y los trastornos hipertensivos del embarazo en la población estudiada.
Condensación: Respuesta con el uso de diferentes esquemas de gonadotropinas exógenas para hiperestimulación ovárica en pacientes sometidas a fertilización in vitro.
Palabras claves: estimulación ovárica, gonadotropinas, índice FOI.
Resumen
Objetivo: Describir los resultados entre esquemas de estimulación ovárica controlada tratadas con monoterapia (FSHr) y esquema combinado (FSHr + hMG) a través del índice FOI. Materiales y métodos: Estudio observacional, descriptivo, retrospectivo y transversal donde se evaluaron los expedientes de pacientes con infertilidad atendidas en el Hospital Materno Perinatal “Mónica Pretelini Sáenz” candidatas a Terapia de Reproducción Asistida de alta complejidad en el periodo comprendido entre 2021-2023 estimuladas con esquema de monoterpia (FSHr) o esquema combinado (FSHr + hMG). Resultados: Se analizaron 107 expedientes, de los cuales el grupo 1 de monoterapia se conformó por 64 pacientes, y el grupo 2 de terapia combinada se conformó por 43 pacientes. Se observó diferencia entre los grupos en la edad, el conteo folicular antral, la dosis total de gonadotropinas y el total de ovocitos recuperados. No se encontró diferencia en el índice FOI. Conclusiones: No se encontró diferencia entre utilizar un esquema combinado o con monoterapia en cuanto al índice FOI.
Abstract
Background: With the development of IVF, the natural menstrual cycle was replaced by the use of ovarian stimulation to obtain multiple oocytes. Different types of exogenous gonadotropins have been evaluated, such as recombinant FSH and LH, highly purified urinary FSH, combined regimens and single-drug regimens. The follicle-to-oocyte index (FOI) refers to the relationship between the baseline antral follicular count at the beginning of the stimulated cycle and the number of oocytes retrieved at egg retrieval, and gives an indicator of the efficacy of the regimen used. Objective: To describe the results between controlled ovarian stimulation schemes treated with monotherapy (rFSH) and a combined scheme (rFSH + hMG) through the FOI index. Material and methods: Observational, descriptive, retrospective and cross-sectional study where the records of patients with infertility treated at the "Mónica Pretelini Sáenz" Maternal and Perinatal Hospital were evaluated, candidates for high-complexity Assisted Reproduction Therapy in the period between 2021-2023 stimulated with a monotherapy scheme (rFSH) or a combined scheme (rFSH + hMG). Results. 107 records were analyzed, of which monotherapy group 1 consisted of 64 patients, and combined therapy group 2 consisted of 43 patients. Differences were observed between the groups in age, antral follicular count, total gonadotropin dose, and total number of oocytes retrieved. No difference was found in the FOI index. Conclusions: No difference was found between using a combined regimen or monotherapy regarding the FOI index.
Introducción
De acuerdo con la Organización Mundial de la Salud (OMS) la infertilidad es un problema de salud a nivel global que afecta a millones de personas. Una de cada seis personas sufrirá infertilidad durante algún periodo de su vida.1
Para poder lograr un embarazo se requiere un ovocito competente (requiriendo función ovulatoria normal en la mujer); un espermatozoide funcional (requiriendo función endocrina normal y capacidad espermatogénica en el hombre); capacidad anatómica para la interacción entre el espermatozoide y el ovocito (cérvix funcional, útero y trompas uterinas en la mujer y vasos deferentes funcionales, epidídimo y pene en el hombre); y la capacidad para implantación del embrión (ambiente endocrino y anatómica adecuado). La infertilidad o la fecundidad reducida puede resultar de anormalidades en cualquiera de estas áreas.2
En Latinoamérica, de acuerdo con la OMS, se encuentra una prevalencia de infertilidad de 8-12%, representando en México al menos 1.5 millones de parejas, de las cuales sólo el 20% busca tratamiento. Los porcentajes de éxito para el caso de la FIVET/ICSI reportados por las clínicas de fertilidad en México oscilan entre 60% y hasta 96%, pero en relación con la cantidad de intentos es del 21.9%, similar a los reportes internacionales, tanto de la RED LARA (29.4%) como del reporte de la ESHRE (27.3%).3
Las técnicas de reproducción asistida (TRA) abarcan todas las técnicas que implican la manipulación directa de los ovocitos fuera del cuerpo. La primera forma de TRA, y todavía la más frecuente, es la fecundación in vitro (FIV), pero existen otras técnicas relacionadas dentro del campo de las TRA.4
La FIV consiste en una secuencia de pasos muy coordinados que comienza con la hiperestimulación ovárica controlada con gonadotropinas exógenas, seguida de la recuperación de los ovocitos de los ovarios bajo guía de la ecografía transvaginal, fecundación en el laboratorio y transferencia transcervical del embrión al útero.5
El desarrollo de la FIV como herramienta para el tratamiento de la infertilidad como resultado de la enfermedad tubárica, causas severas del factor masculino, anovulación e incluso infertilidad inexplicable, ha aportado un enorme potencial al arsenal de tratamiento de la infertilidad.6
La estimulación ovárica es un paso fundamental en el proceso de tratamiento de FIV, ya que la cantidad de óvulos recuperados durante la recolección de ovocitos se asocia con una mayor probabilidad de un nacimiento vivo posterior. Se han propuesto varios protocolos de estimulación ovárica para pacientes sometidas a un tratamiento de FIV y diseñados para maximizar la producción de ovocitos.7
La Hormona Folículo Estimulante (FSH) es una hormona glicoproteica sintetizada y secretada por la glándula pituitaria anterior bajo el estímulo pulsátil del péptido de la hormona liberadora de gonadotropina (GnRH). Esta gonadotropina, junto con la hormona luteinizante (LH) y la gonadotropina coriónica humana (hCG), desempeña un papel central en la reproducción de los mamíferos.8
Como todas las hormonas glicoproteicas, la FSH consta de dos subunidades distintas unidas de forma no covalente, a saber, α y β. Si bien la subunidad α es común a todas las hormonas glicoproteicas (FSH, LH, hCG y la hormona estimulante de la tiroides TSH), la subunidad β es distinta para cada hormona y determina la especificidad del receptor y las propiedades biológicas e inmunológicas. Cada subunidad tiene dos sitios de glicosilación unidos a N; la subunidad α está glicosilada en ambos sitios, mientras que los sitios de la subunidad β pueden estar ocupados o no por glicanos. La unión de glicanos unidos a N y O a las proteínas y el grado de glicosilación determinan la configuración tridimensional de las glicoproteínas, lo que da como resultado una variedad de glicoformas que difieren en estabilidad estructural y función. La glicosilación es crítica para la acción de las glicoproteínas, así como para determinar su farmacocinética (PK) y farmacodinamia (PD).8
Se han evaluado distintos tipos de gonadotropinas exógenas como FSH y LH recombinantes, FSH urinarias altamente purificadas, esquemas combinados y de un solo medicamento, así como la función de LH en pacientes de distintos grupos de edad. 6
Las gonadotropinas urinarias y recombinantes son usadas rutinariamente para estimulación ovárica en terapia de reproducción asistida. Dependiendo de las diferencias en su origen, producción y métodos de purificación, estas gonadotropinas tienen diferencias en su pureza, perfil de degradación y de glucosilación.9
Folitropina alfa (Gonal F) es una preparación de FSH recombinante pura, y su proceso de manufactura asegura consistencia entre lotes con respecto a su perfil de isoformas y las especies de glicanos, así como la folitropina beta (Puregon). En contraste, algunas gonadotropinas de origen urinario (Gonadotropinas menopáusicas humanas, hMG) o FSH altamente purificada, contienen una miscelanea de gonadotropinas (FSH, gonadotropina coriónica humana hCG, y hormona luteínizante LH) y hasta 20% de proteínas no gonadotrópicas y hasta 40% de formas oxidadas.9 Estas variaciones afectan la actividad biológica, aclaramiento metabólico y vida media, lo que ocasiona diferencias en la efectividad terapéutica de las mujeres en tratamiento de reproducción.9
La respuesta ovárica se define por el número de folículos antrales y ovocitos desarrollados en el ovario después de la estimulación, que a su vez se correlaciona directamente con la reserva ovárica.7
La capacidad de respuesta ovárica puede predecirse mediante las características de la paciente, el diagnóstico clínico y los marcadores de laboratorio, como la hormona antimulleriana (HAM), la FSH, la LH y el estradiol (E2) basales. Sin embargo, estos predictores no son muy sensibles y no siempre es factible predecir el resultado. La experiencia en un resultado de estimulación ovárica previa sigue siendo el mejor predictor de la capacidad de respuesta ovárica.7
La EHSRE en su guía de 2019 sugiere utilizar la terminología de respuesta baja, normal y alta para clasificar la respuesta ovárica , utilizando las siguientes definiciones:
- La respuesta ovárica alta es una respuesta exagerada a la estimulación ovárica convencional (150-225 UI FSH), caracterizado por la presencia de más folículos y/u ovocitos de los previstos. Generalmente, más de 18 folículos ≥11 mm el día del disparo de hCG para maduración y/o 18 ovocitos recolectados caracterizan una respuesta alta definido por un aumento del riesgo de SHO.10
- La baja respuesta ovárica es una respuesta disminuida a la estimulación ovárica convencional, caracterizado por la presencia de un bajo número de folículos y/u ovocitos. Generalmente, ≤ 3 folículos el día del disparo de hCG de maduración de los ovocitos y/o ≤ 3 ovocitos obtenidos caracterizan una baja respuesta.10
La estimulación enfrenta diferentes retos. Para empezar, la tasa de recién nacido vivo por cada ovocito maduro recuperado es tan bajo como 5%. Por otro lado, el número de ovocitos necesarios para obtener al menos un recién nacido vivo aumenta exponencialmente con la edad. Además, un número importante de pacientes ( 9% a 24%) muestran una pobre respuesta ovárica a la estimulación con gonadotropinas exógenas. Por todo esto, las bajas tasas de embarazo y de recién nacido vivo obtenidas varían desde 3% hasta 14%.11
La fuerza de la respuesta ovárica a la estimulación ovárica se había analizado considerando el número de folículos preovulatorios obtenidos al final de la estimulación ovárica. Sin embargo, el número de folículos preovulatorios obtenidos no refleja de forma fiable la capacidad de respuesta del folículo antral a la FSH, ya que depende en gran medida del número de folículos antrales pequeños previos al tratamiento. De manera similar, la relación cuantitativa entre los niveles de AMH y el número de folículos maduros y óvulos fertilizables observada en ciertos estudios puede resultar simplemente de la correlación positiva entre los niveles de AMH y el número de folículos antrales pequeños antes del tratamiento y no da fe de la sensibilidad al tratamiento con FSH. Por lo tanto, parecía crucial identificar un índice que considerara el número de folículos antrales pequeños antes del tratamiento.12
Genro et al.13 fueron los primeros en introducir el concepto de FORT en un estudio prospectivo de 162 pacientes. FORT se definió como la proporción del recuento de folículos preovulatorios (CFP) (16 a 22 mm de diámetro) en el día de hCG × 100 / recuento de folículos antrales pequeños (3 a 8 mm de diámetro) al inicio del estudio.
Un FORT bajo (30%) indica hipo respuesta por la discrepancia entra la relativamente baja cantidad de folículos preovulatorios que se desarrollan después de la estimulación ovárica en comparación con el número de folículos antrales disponibles al inicio del ciclo. Un FORT bajo no está asociado con marcadores ováricos reducidos, sugiriendo que pacientes en estimulación ovárica pueden presentar un FORT bajo a pesar de la presencia de marcadores ováricos adecuados.14
Se propuso en 2018 un método altero para evaluar la resistencia ovárica a la estimulación con gonadotropinas (o hipo respuesta) basados en el concepto del FORT pero utilizando el número total de ovocitos recuperados al final de la estimulación ovárica.14 (FOI = Número de ovocitos recuperados / Conteo folicular antral x 100).
El índice folículo a ovocito (FOI) se refiere a la relación que existe entre el conteo folicular antral basal al inicio del ciclo estimulado y el número de ovocitos recuperados en la captura ovular, y nos da un indicador de la eficacia del esquema utilizado.15
En la tabla 1 se ejemplifica la diferencia entre hipo respuesta y respuesta subóptima. En el caso número 1 se observa un FOI normal, en el que el número de ovocitos recuperados es consistente con el conteo folicular antral al inicio del ciclo. El caso número 2 muestra a una paciente con una recuperación subóptima de ovocitos (entre 4 y 9) pero con un FOI normal. El caso número 3 muestra a una paciente con ambos, hipo respuesta y número de ovocitos subóptimo. El caso número 4 muestra paciente con hipo respuesta y pobre respuesta.
Tabla 1: Índice folículo a ovocito
|
FOI NORMAL >50% |
1 |
|
2 |
|
|
FOI BAJO <50% |
3 |
|
4 |
Replicado de: Alviggi C, Conforti A, Esteves S, et al. Understanding ovarian hypo-reponse to exogenous gonadotropin in ovarian stimulation and its new proposed marker – The -Follice-to-Oocyte (FOI) Index. Frontiers in endocrinology, October 2018.
El FOI puede utilizarse solo o combinado con FORT para reflejar óptimamente la resistencia ovárica a la estimulación. Los resultados del FOI también pueden ayudar a entender si es posible explotar la reserva ovárica utilizando intervenciones farmacológicas. Por último, el FOI puede ser útil para predecir la probabilidad de éxito de terapia de reproducción asistida, entendiendo la probabilidad de conseguir al menos un blastocisto euploide para transferir que es el marcador más importante para éxito reproductivo, y también el éxito de embarazo.14
De este modo, los FOI bajos implican que sólo una fracción de los folículos antrales disponibles fueron estimulados durante la estimulación ovárica, sugiriendo que puede haber oportunidades terapéuticas para cambiar el destino de esas mujeres en una estimulación ovárica subsecuente.14
Objetivo
Describir los resultados entre esquemas de estimulación ovárica controlada tratadas con monoterapia (FSHr) y esquema combinado (FSHr + hMG) a través del índice FOI.
Material y métodos
Se realizó el estudio en la clínica de Biología de la Reproducción del Hospital Materno Perinatal “Mónica Pretelini Sáenz” en Toluca, Estado de México. Se trata de un estudio observacional, descriptivo, retrospectivo y transversal. Se incluyeron los expedientes clínicos de pacientes sometidas a Terapia de Reproducción Asistida de alta complejidad, que se sometieron a estimulación ovárica controlada en el periodo comprendido entre 2021-2023. Se analizaron los esquemas de estimulación ovárica utilizados y se compararon los resultados utilizando el índice FOI.
Análisis estadístico: Estadística descriptiva (frecuencias y medidas de tendencia central) y T Student para comparar los dos grupos estudiados.
Resultados
Se analizaron un total de 107 expedientes de pacientes correspondientes al periodo 2021 – 2023, de ellas 64 pacientes (Grupo 1) recibieron un protocolo de monoterapia con FSH recombinante, mientras 43 pacientes (grupo 2) recibieron tratamiento con protocolo combinado, utilizando FSH recombinante más menotropinas.
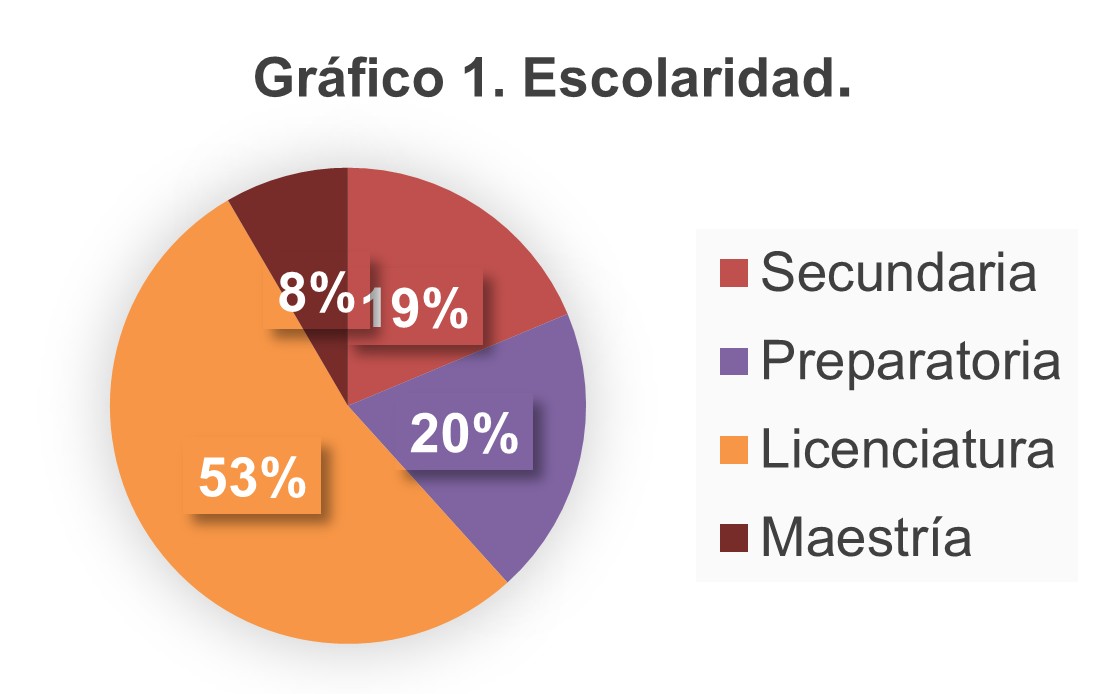
Se encontró que el 61% de la población estudiada contaba con educación superior. (Gráfico 1)
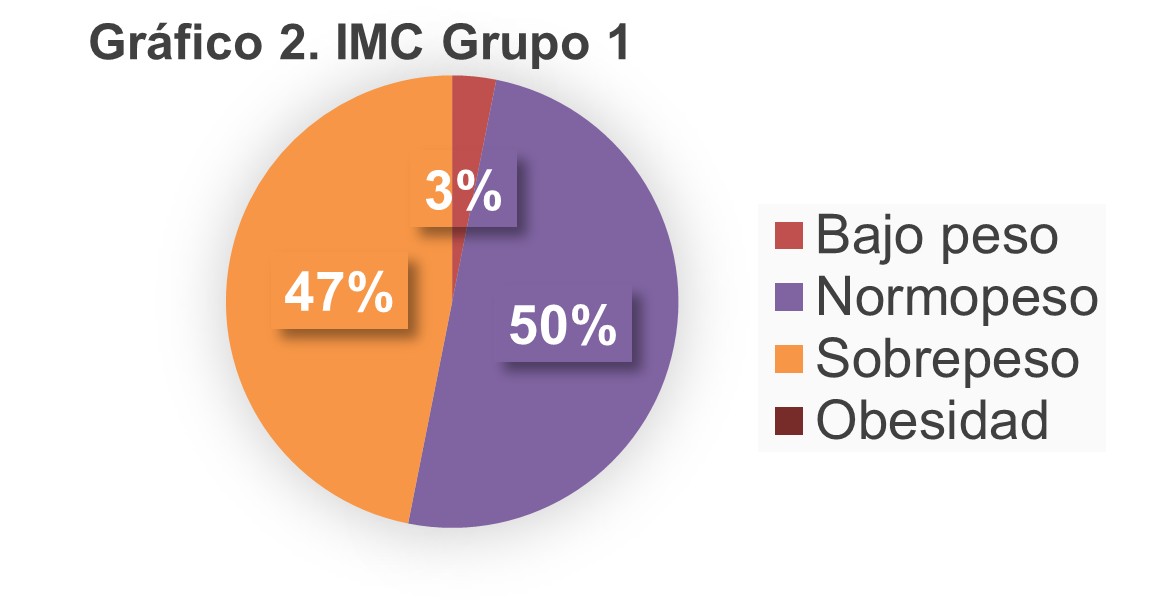
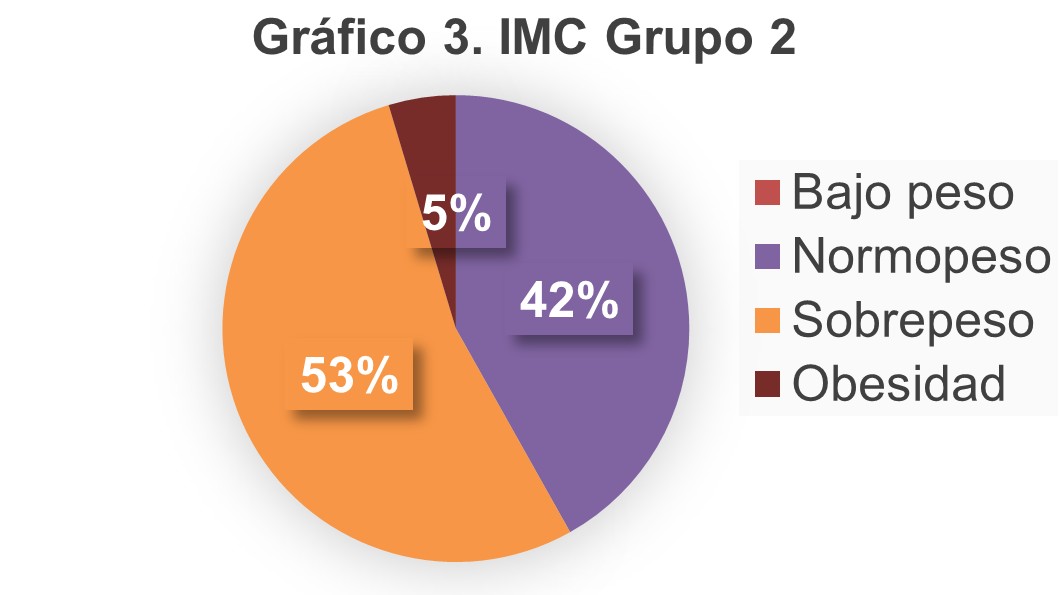
En cuanto al índice de masa corporal se encontró que en el grupo de monoterapia (Gráfico 2) el 50% tenía normopeso, 47% sobrepeso y 3% bajo peso. En el grupo de terapia combinada el 42% tenía normopeso, 53% sobrepeso y 5% obesidad. (Gráfico 3).
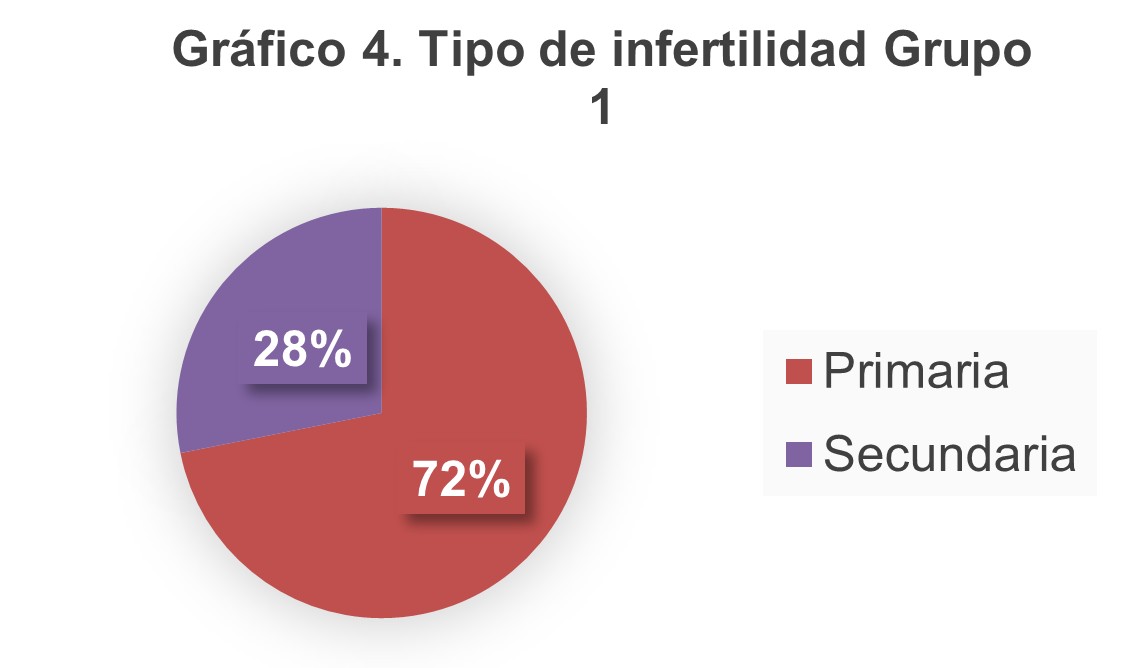
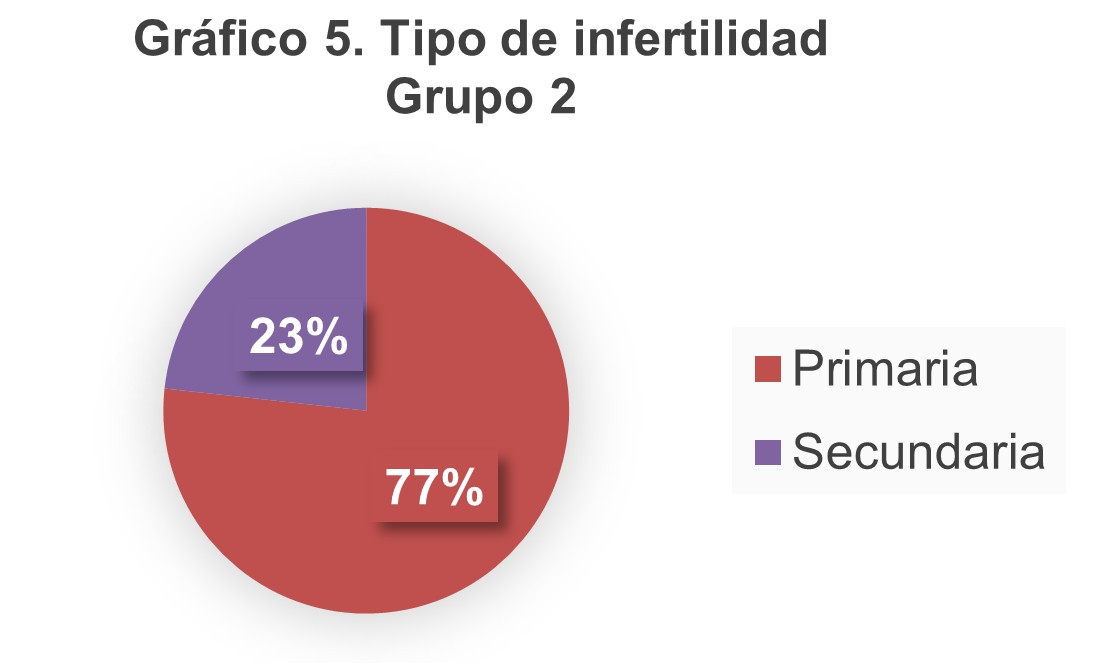
En el gráfico 4 y 5 se muestra el tipo de infertilidad en ambos grupos.
Las variables cuantitativas como la edad, el tiempo de infertilidad, el conteo folicular antral, los días y dosis de estimulación, los ovocitos recuperados y el cálculo del índice de FOI se realizaron para cada grupo y se compararon utilizando T de student. (Tabla 2).
Tabla 2. Resultados
|
Variable |
Grupo 1 |
Grupo 2 |
p |
|
Edad |
31.9 ±4.1 |
35.4 ±3.7 |
0.00000008 |
|
Tiempo de infertilidad |
4.45 ±2.6 |
4.97 ±2.9 |
0.17757057 |
|
Folículos antrales basales |
21.14 ±15.7 |
12.11 ±6.7 |
0.000005 |
|
Días de estimulación |
9.5 ±1.3 |
9.8 ±1.6 |
0.10157696 |
|
Dosis de estimulación |
1865.62 ±548 |
2895.34 ±630 |
0.000000001 |
|
Ovocitos recuperados |
11.04 ±9.3 |
6.27 ±4.4 |
0.00031159 |
|
Índice FOI |
57.26 ±34.2 |
55.37 ±35.7 |
0.394183125 |
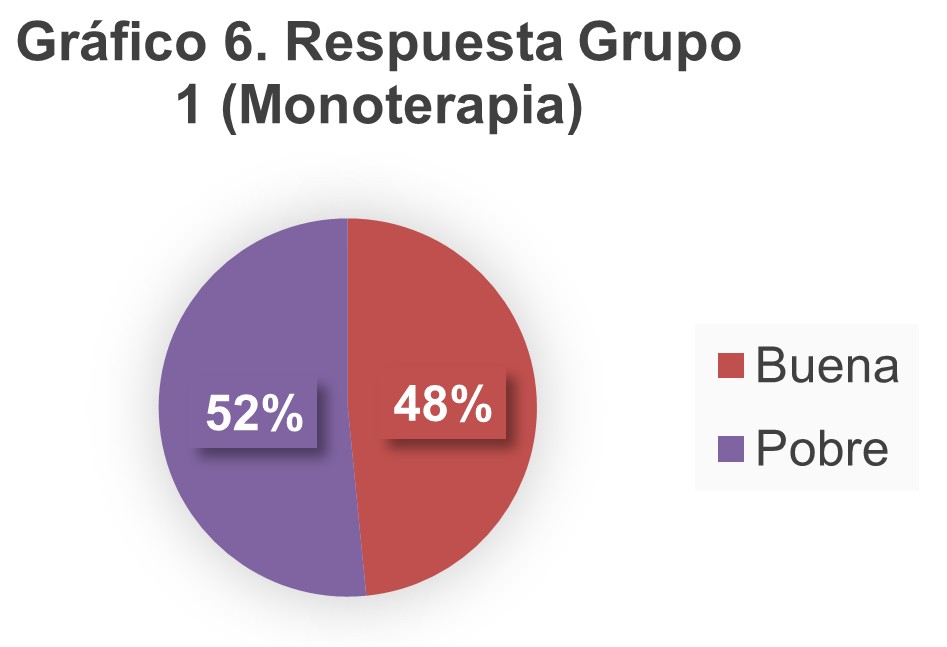
En los gráficos 6 y 7 se muestra la respuesta a la estimulación ovárica controlada en ambos grupos de acuerdo con el resultado del índice FOI.
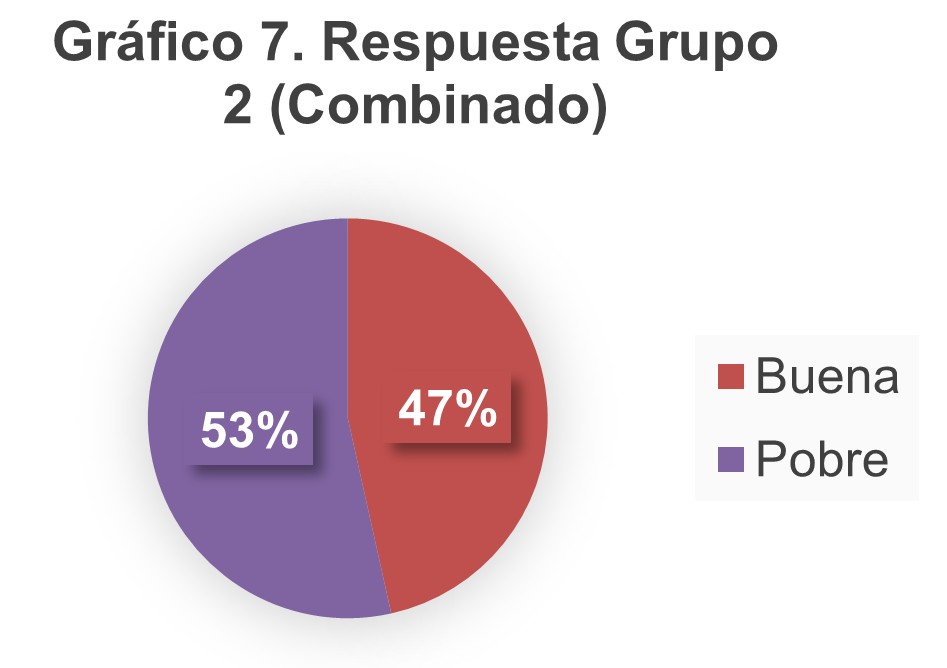
Discusión
En el estudio encontramos que diferencia significativa en cuanto a la edad, lo cual corresponde con la selección actual del régimen de medicamentos utilizado para la estimulación ovárica controlada, ya que de acuerdo con las recomendaciones de la ESHRE, para pacientes mayores de 35 años se recomienda utilizar un régimen combinado de FSH más LH.
El índice de masa corporal es otra de las variables que podría marcar diferencia en cuanto a la respuesta al tratamiento, como se ve en distintos estudios, como el realizado por Chen en Taiwan16, donde el IMC promedio fue de 22.49 + 3.51, más bajo que el encontrado en nuestro estudio y en la mayoría de los estudios realizados en otros países, sin embargo en el estudio similar realizado en 2018 por Lezama en Ciudad de México, se encontró un IMC promedio de 23.8 + 1.6.17
La prevalencia de infertilidad primaria en nuestro estudio fue del 77%, más alto que el encontrado en el estudio de Chen de 2022, donde la infertilidad primaria se encontraba en un 59.8%. Esto podría ser a causa de los criterios de inclusión que tenemos en nuestra clínica.
Una de las variables que demostró una diferencia significativa fue el conteo folicular antral, lo cual corresponde también con la diferencia de edad entre ambos grupos, ya que la reserva ovárica es inversamente proporcional a la edad en la mayoría de las pacientes, por lo que al ir disminuyendo se necesita mayor cantidad de gonadotropinas, como se demuestra en nuestros hallazgos. En nuestro estudio se encontró un promedio de 21.1 en pacientes del grupo de monoterapia, y 12.1 para pacientes en el grupo combinado. Tomando en cuenta la edad en ambos grupos donde en promedio máximo fue de 35.4, y comparándolo con estudios en grupos de mayor edad, como por ejemplo el realizado por Mario Mignini en Italia en 201718, donde se encontró un conteo folicular antral de 5.9, reafirmando que la edad se relaciona con una conteo más bajo.
En cuanto a días de estimulación no hubo diferencia significativa entre los grupos, con un promedio de 9.5 a 9.8 días, similar al estudio realizado por Bleau en Canadá19, donde los días de estimulación promedio fueron 9. En el estudio realizado por Peter G.A. en Amsterdam20, se encontró en promedio 11.7 días de estimulación.
La dosis total de estimulación entre los diferentes estudios fue muy variable, desde los 1759 UI reportados por Peter G. A en 20097 , 2550 UI reportadas en el estudio de Vuong en Vietnam21 , o las 4213 UI reportadas por Bleau en Canadá.
La cantidad total de ovocitos recuperados también demostró una diferencia significativa en nuestro estudio, obteniendo una mayor cantidad de ovocitos en el grupo de la monoterapia, pero no necesariamente por el medicamento utilizado, si no por el total de ovocitos viables a ser estimulados al inicio del ciclo.
En el estudio realizado por Lezama Ruvalcaba en Ciudad de México17, se encontró un promedio de 8.57 ovocitos recuperados, en nuestro estudio fue de 11.05, en el grupo de monoterapia y de 6.2 en el grupo de terapia combinada, demostrando un comportamiento similar al de nuestro estudio.
A pesar de las diferencias entre ambos grupos, el índice FOI no demostró diferencia significativa entre ambos grupos, ya que se obtuvieron alrededor del 55-57% independientemente de las condiciones basales y del régimen utilizado, lo cual no demostró que alguno de los regímenes fuera mejor que el otro.
Conclusión
No se encontró una diferencia significativa comparando el índice FOI entre esquemas de estimulación ovárica controlada de FSHr sola vs FSHr + hMG.
La edad y el conteo folicular antral es utilizado para decidir la adición o no de LH al esquema de hiperestimulación, sin embargo, a pesar de las diferencias entre ambos grupos, esto no afectó la proporción de ovocitos recuperados.
Referencias Bibliográficas
- Infertilidad [Internet]. Who.int. [citado el 22 de marzo de 2024]. Disponible en: https://www.who.int/es/health-topics/infertility
- Cedars MI. Evaluation of Female Fertility-AMH and Ovarian Reserve Testing. J Clin Endocrinol Metab. 2022 May 17;107(6):1510-1519
- Infertility prevalence estimates 1990-2021. World Health Organization
- Cabrera Cabrera A, Ramos Kuri M, Hernández Valdez P, Llaca García E. Tasas de éxito en clínicas de fertilidad. Med Ética. 2020;31(2):245–65.
- Taylor HS, Pal L, Sell E. Speroff. Endocrinología ginecológica clínica y esterilidad. 9a ed. la Ciudad Condal, España: Lippincott Williams & Wilkins; 2020
- ESHRE Reproductive Endocrinology Guideline Group. Ovarian stimulation for IVF/ICSI. October 2019
- Ip PNP, Mak JSM, Law TSM, Ng K, Chung JPW. A reappraisal of ovarian stimulation strategies used in assisted reproductive technology. Hum Fertil (Camb). 2023 Oct;26(4):824-844.
- Lispi M, Humaidan P, Bousfield GR, D'Hooghe T, Ulloa-Aguirre A. Follicle-Stimulating Hormone Biological Products: Does Potency Predict Clinical Efficacy? Int J Mol Sci. 2023 May 19;24(10):9020.
- Grynberg M, Cedrin-Durnerin I, Raguideau F, et al. Comparative effectiveness of gonadotropins used for ovarian stimulation during assisted reproductive technologies (ART) in France: A real-world observational study from the French nationwide claims database (SNDS). Best Pract Res Clin Obstet Gynaecol. 2023 Jun;88:102308.
- Griesinger G, Verweij PJ, Gates D, Devroey P, Gordon K, Stegmann BJ, Tarlatzis BC. Prediction of Ovarian Hyperstimulation Syndrome in Patients Treated with Corifollitropin alfa or rFSH in a GnRH Antagonist Protocol. PLoS One. 2016 Mar 7;11(3):e0149615.
- Barrenetxea G, Hernández C, Herrero J, Martínez Navarro L, Muñoz M, Rubio JM, Sánchez F, Zabaleta J. Use of gonadotropins in ovarian stimulation in Spain: Delphi consensus. J Obstet Gynaecol. 2023 Dec;43(1):2174692.
- Grynberg M, Labrosse J. Understanding Follicular Output Rate (FORT) and its Implications for POSEIDON Criteria. Front Endocrinol (Lausanne). 2019 Apr 16;10:246.
- Genro VK, Grynberg M, Scheffer JB, Roux I, Frydman R, Fanchin R. Serum anti-Mullerian hormone levels are negatively related to Follicular Output RaTe (FORT) in normo-cycling women undergoing controlled ovarian hyperstimulation. Hum Reprod. (2011) 26:671–7.
- Alviggi C, Conforti A, Esteves SC, Vallone R, Venturella R, Staiano S, Castaldo E, Andersen CY, De Placido G. Understanding Ovarian Hypo-Response to Exogenous Gonadotropin in Ovarian Stimulation and Its New Proposed Marker-The Follicle-To-Oocyte (FOI) Index. Front Endocrinol (Lausanne). 2018 Oct 17;9:589.
- Alviggi C, Conforti A, Esteves S, et al. Understanding ovarian hypo-reponse to exogenous gonadotropin in ovarian stimulation and its new proposed marker – The -Follice-to-Oocyte (FOI) Index. Frontiers in endocrinology, October 2018
- Chen MJ, Yi YC, Guu HF, Chen YF, Kung HF, Chang JC, Chuan ST, Chen LY. A retrospective, matched case-control study of recombinant LH versus hMG supplementation on FSH during controlled ovarian hyperstimulation in the GnRH-antagonist protocol. Front Endocrinol (Lausanne). 2022
- Lezama-Ruvalcaba Jorge Luis, Salazar-López Ortiz Carlos Gerardo, Téllez-Velasco Sergio, Bahena-Espinoza Natyeli. Resultados en ciclos de FIV-ICSI adicionando hormona luteinizante recombinante a la hormona folículo estimulante recombinante con menotropinas durante la estimulación ovárica en pacientes mayores de 35 años. Ginecol. obstet. Méx. [revista en la Internet]. 2018
- Mignini Renzini M, Brigante C, Coticchio G, Dal Canto M, Caliari I, Comi R, De Ponti E, Fadini R. Retrospective analysis of treatments with recombinant FSH and recombinant LH versus human menopausal gonadotropin in women with reduced ovarian reserve. J Assist Reprod Genet.
- Bleau N, Agdi M, Son W, Tan S, Dahan MH. A Comparison of Outcomes from In Vitro Fertilization Cycles Stimulated with Follicle Stimulating Hormone Plus either Recombinant Luteinizing Hormone or Human Menopausal Gonadotropins in Subjects Treated with Long Gonadotropin Releasing Hormone Agonist Protocols. Int J Fertil Steril. 2017
- Hompes PG, Broekmans FJ, Hoozemans DA, Schats R; FIRM group. Effectiveness of highly purified human menopausal gonadotropin vs. recombinant follicle-stimulating hormone in first-cycle in vitro fertilization-intracytoplasmic sperm injection patients. Fertil Steril. 2009
- Vuong TN, Phung HT, Ho MT. Recombinant follicle-stimulating hormone and recombinant luteinizing hormone versus recombinant follicle-stimulating hormone alone during GnRH antagonist ovarian stimulation in patients aged ≥35 years: a randomized controlled trial. Hum Reprod. 2015
1. Residente de sexto año de Biología de la Reproducción Humana del Hospital Materno Perinatal “Mónica Pretelini Sáenz”. Toluca, México.
2. Jefe de servicio de la clínica de fertilidad del Hospital Materno Perinatal “Mónica Pretelini Sáenz”, Toluca, México.
3. Unidad de investigación Hospital Materno Perinatal “Mónica Pretelini Sáenz”, Toluca, México