Actualización de Consenso - Síndrome de Ovario Poliquístico - FASGO 2025
Directora:
Gladys Isabel Fernández (CABA, ginecóloga)
Coordinadoras:
Eugenia Lamas Majek (CABA, ginecóloga)
Samanta Peri Cruzado (CABA, ginecóloga)
Expertos:
Natalia Allende (La Pampa, ginecóloga)
Luciana Carrizo (Tucumán, ginecóloga)
Gabriela Castro (Tucumán, ginecóloga)
Melina Clavero (Santa Fe, ginecóloga)
Alicia Díaz (Misiones, ginecóloga)
Vanina Di Pasquale (Mendoza, ginecóloga)
Cielo Frisone (Chaco, endocrinóloga)
Carolina Fux-Otta (Córdoba, endocrinóloga)
Marisa Geller (CABA, ginecóloga)
Fabian Gómez Giglio (Río Negro, ginecólogo)
Edith Jiménez (Mar del Plata, ginecóloga)
Carolina Lizárraga (Neuquén, ginecóloga)
Mariana López (CABA, endocrinóloga)
Doris Rodríguez Vidal (CABA, ginecóloga)
Julia Salinas (Salta, ginecóloga)
Fabiana Sayegh (Mendoza, ginecóloga)
Graciela Schabelman (San Juan, ginecóloga)
María Alejandra Schüle (Córdoba, ginecóloga)
1. DIAGNÓSTICO: Disfunción ovulatoria, hiperandrogenismo (HA) clínico y bioquímico, ecografía, hormona antimülleriana (HAM), diagnóstico en adolescencia y postmenopausia
El síndrome de ovario poliquístico (SOP) es la endocrinopatía más frecuente en mujeres en edad reproductiva, con una prevalencia entre el 5 y 15% de acuerdo al criterio diagnóstico utilizado. La heterogeneidad del SOP, la diversidad de sus manifestaciones clínicas, la incertidumbre sobre sus causas y los antecedentes de diagnósticos erróneos han caracterizado la afección desde su descubrimiento y continúan siendo motivo de debate.
El diagnóstico y el tratamiento del síndrome de ovario poliquístico han sido controvertidos, con dificultades para definir los componentes individuales dentro de los criterios diagnósticos y una heterogeneidad clínica significativa, que se ve influenciada por las diferencias étnicas y los cambios en las características clínicas a lo largo de la vida.
Durante las últimas décadas se han sucedido tres consensos diagnósticos. El primero fue en el año 1990, durante una conferencia de expertos del National Health Institute (NIH), donde se acordó como criterios diagnósticos del SOP: 1) Anovulación crónica y 2) Hiperandrogenismo (HA) clínico y/o bioquímico. Fue más adelante, durante el consenso de expertos que tuvo lugar en Rotterdam en 2003, que se agregó a esta definición un tercer criterio: ovarios de aspecto poliquísticos por ecografía, y se estableció como requisito diagnóstico la presencia de por lo menos 2 de los 3 criterios, excluyendo previamente otras patologías, como ser hiperplasia suprarrenal congénita, tumores secretores de andrógenos, hiperprolactinemia, síndrome de Cushing o disfunción tiroidea. En el año 2006, un panel de expertos de la Sociedad de Exceso de Andrógenos (AES) concluyó que el diagnóstico de SOP debería basarse predominantemente en el hiperandrogenismo (requisito obligatorio) junto con disfunción ovulatoria u ovarios ecográficamente de aspecto poliquísticos. Sin embargo, los criterios de AES no fueron universalmente aceptados y la existencia de más de un consenso ocasionó dificultades en la práctica clínica alrededor del mundo. Por tal motivo, en el 2012 el NIH organizó un panel de trabajo para reevaluar los criterios existentes. Como resultado, se recomendó la utilización del criterio de Rotterdam. Múltiples organizaciones están actualizando constantemente las directrices para el diagnóstico y el tratamiento del SOP. Recientemente, en el año 2023, un grupo de expertos convocados por la Sociedad Europea de Reproducción Humana y Embriología (ESHRE) publicó las últimas recomendaciones, que revisaremos a lo largo de este consenso.
Criterios Diagnósticos
El diagnóstico de SOP se realiza con la presencia de por lo menos 2 de los 3 elementos mencionados previamente:
- Disfunción ovulatoria (DO)
- Hiperandrogenismo clínico y/o bioquímico (HA)
- Ecografía con morfología de ovarios de aspecto poliquístico (MOP) o niveles elevados de HAM
Disfunción ovulatoria:
La misma se traduce clínicamente como la presencia de ciclos menstruales irregulares. La definición de ciclos irregulares se hace según la edad ginecológica de la paciente:
- Son normales en el primer año después de la menarca = transición puberal
- >1 a <3 años después de la menarca: <21 o >45 días
- > 3 años después de la menarca hasta la perimenopausia: < 21 o > 35 días o <8 ciclos por año
- >1 año después de la menarca: >90 días para cualquier ciclo
- Amenorrea primaria a los 15 años o >3 años después de la telarca (desarrollo mamario)
Recordar que la disfunción ovulatoria puede ocurrir incluso en presencia de ciclos regulares (hasta 32% reportados) y, de ser necesario, se deberá confirmar dosando progesterona en la fase lútea media del ciclo menstrual.
Hiperandrogenismo bioquímico:
Se solicita testosterona total y libre para el diagnóstico. La androstenediona y el sulfato de dehidroepiandrosterona (SDHEA) deben solicitarse en casos en que la testosterona se encuentre en rango normal, teniendo en cuenta su menor especificidad y que los niveles de SDHEA disminuyen con la edad.
Para la detección del hiperandrogenismo en el SOP la determinación bioquímica de andrógenos cobra gran valor en pacientes con mínimo o ningún signo de hiperandrogenismo clínico.
No es posible una evaluación fiable del hiperandrogenismo bioquímico bajo tratamiento con anticonceptivos hormonales. Por tanto, se puede indicar la interrupción del tratamiento durante ≥ 3 meses con un método anticonceptivo alternativo o diferir los estudios bioquímicos cuando la anticoncepción es prioritaria.
Si los valores de andrógenos están marcadamente elevados por encima del rango de referencia se deben considerar otras causas de hiperandrogenismo (neoplasia ovárica o adrenal).
Se debe recordar que repetir dosaje de andrógenos en el seguimiento del SOP tiene un rol limitado.
Hiperandrogenismo clínico:
Las manifestaciones clínicas de hiperandrogenismo incluyen: hirsutismo, acné y alopecía androgénica. Para el diagnóstico de hirsutismo se recomienda el uso de escalas, como la de Ferriman & Gallwey modificada (mFG). Mientras que para la evaluación de acné no existen escalas validadas, para la evaluación de la pérdida de cabello con patrón femenino se recomienda el uso de la Escala de Ludwing u Olsen.
La presencia de hirsutismo sin otros signos clínicos debe considerarse predictivo de hiperandrogenismo bioquímico y SOP en adultos. Por el contrario, la presencia aislada de acné o alopecia presentan un bajo valor predictivo positivo.
Debe tenerse en cuenta que el autotratamiento (depilación) es frecuente y puede limitar la evaluación clínica. La manifestación por parte de la paciente de vello no deseado en
ausencia de hirsutismo franco es un fuerte predictor de SOP, por tanto, no debe subestimarse.
Ecografía con morfología de ovarios de aspecto poliquístico (MOP):
El número de folículos por ovario es el marcador más eficaz, seguido en precisión por el recuento de número de folículos por sección transversal y la medición del volumen ovárico. Para el diagnóstico se debe considerar en al menos un ovario: número de folículos mayor o igual a 20 (de 2-9 mm), recuento de folículos por sección transversal mayor o igual a 10 y/o un volumen ovárico mayor o igual a 10 ml.
Se prefiere el abordaje ecográfico transvaginal en mujeres que ya han iniciado relaciones sexuales. En caso de realizarse por preferencia u otra razón la ecografía por vía transabdominal se debe informar principalmente el volumen ovárico o el recuento de folículos por sección transversal. De la misma manera, si se utilizan equipos con menor definición (<8 MHz) o con insuficiente calidad de imagen, el diagnóstico de MOP se debe basar en volumen ovárico o recuento de folículos por sección transversal.
En pacientes que presentan disfunción ovulatoria e hiperandrogenismo, no es necesaria la valoración ecográfica para el abordaje diagnóstico.
Hormona Antimülleriana (HAM):
La determinación de HAM resulta una alternativa a la ecografía transvaginal pero debe considerarse que el empleo de ambas en conjunto podría contribuir al sobrediagnóstico. Por tal motivo, sólo debería usarse uno de estos dos elementos para arribar al diagnóstico.
Desde la práctica resulta importante tener en cuenta que la HAM sérica alcanza su punto máximo entre los 20 a 25 años de edad, varía a lo largo del ciclo menstrual, puede estar disminuida por el uso de anticonceptivos hormonales orales y en mujeres con índice de masa corporal (IMC) aumentado.
En ANEXO 1 se resume el algoritmo diagnóstico del SOP.
Finalmente, debe recordarse que, según la presencia de cada elemento diagnóstico de acuerdo a los criterios de Rotterdam, las pacientes con SOP pueden clasificarse en cuatro fenotipos:
- Fenotipo A (también conocido como fenotipo clásico completo): incluye a aquellas mujeres que presentan HA/DO/MOP.
- Fenotipo B (fenotipo clásico incompleto): mujeres con HA/DO.
- Fenotipo C (u ovulatorio): pacientes con HA/MOP.
- Fenotipo D (o normoandrogénico): mujeres con DO/MOP.
SOP: diagnóstico en la adolescencia
Las variaciones fisiológicas que ocurren durante esta etapa de la vida hacen que el
diagnóstico de SOP en estas pacientes sea un desafío, haciendo muchas veces difícil distinguir lo fisiológico de lo patológico. Se deben tener en cuenta las particularidades clínicas en la adolescencia que a menudo imitan los síntomas del SOP con el fin de evitar el sobrediagnóstico y el sobretratamiento.
A la hora de evaluar una paciente adolescente, se deben considerar los siguientes factores de riesgo para desarrollar SOP: madre con diagnóstico de SOP, antecedente de pubarca precoz, niñas con sobrepeso u obesidad, niñas con síndrome metabólico y DBT2.
A continuación, se analizan las particularidades de los 3 elementos diagnósticos del SOP en esta etapa de la vida:
Disfunción ovulatoria:
La irregularidad de los ciclos menstruales es normal el 1er año post menarca; durante este período aproximadamente el 75% de las adolescentes informan que su ciclo es irregular. Desde 1 año post menarca y hasta 3 años los ciclos son normales entre 21 y 45 días. Luego de 3 años post menarca son normales si duran de 21 a 35 días. La ciclicidad menstrual regular solo se logra dentro de los 2-3 años posteriores a la menarca.
La anovulación, como un elemento diagnóstico crucial para el SOP se presenta en aproximadamente la mitad de las adolescentes y no siempre es patológica.
Hiperandrogenismo clínico y/o bioquímico:
El acné es fisiológico en la adolescencia; sospechamos hiperandrogenismo cuando el mismo es severo, con pústulas, comedones y no responde a los tratamientos dermatológicos habituales.
El hirsutismo es el marcador clínico más robusto del exceso de andrógenos, pero es importante interrogar a las pacientes acerca de si han realizado previo a la evaluación clínica depilación láser o electrólisis que lo podrían subvalorar. La alopecía androgénica es infrecuente en este grupo etario.
El hiperandrogenismo bioquímico se refiere a la producción y secreción excesiva de andrógenos y se utilizan las mismas determinaciones de laboratorio que en la mujer adulta.
Consideramos de importancia recordar que en la adolescencia hay insulinorresistencia fisiológica.
Ecografía con ovarios de aspecto poliquístico y HAM:
Se ha encontrado morfología de ovario poliquístico a través de ultrasonido en hasta el 40%, 35% y 33.3% de las pacientes cuando se evalúan a los 2, 3 y 4 años, respectivamente, luego de la menarca. La MOP en la adolescencia no se asocia con futuras anomalías en la tasa de ovulación o la duración del ciclo menstrual. Por esta razón, las guías internacionales desaconsejan el uso de ultrasonido pélvico hasta 8 años después de la menarca.
La morfología ovárica poliquística en ultrasonografía pélvica o los niveles de HAM no deben utilizarse para el diagnóstico durante la adolescencia.
Por todo lo anterior, en adolescentes con características compatibles con SOP pero que no
reúnen criterios diagnósticos, se debe considerar que presentan un riesgo incrementado de desarrollar la patología y debe realizarse seguimiento y reevaluación al completar la madurez reproductiva 8 años después de la menarca. (Ver ANEXO 2).
SOP: diagnóstico en la menopausia
El diagnóstico de SOP podría considerarse de por vida. Asimismo, el SOP puede diagnosticarse retrospectivamente durante la menopausia, basándose en la historia de oligomenorrea e hiperandrogenismo durante la edad reproductiva. La evaluación ecográfica a esta edad ya no ayudará al diagnóstico, pero se debe tener en cuenta que el hiperandrogenismo tanto clínico como bioquímico podrían persistir en la postmenopausia. Debe considerarse en la postmenopausia el diagnóstico de SOP en paciente con historia de oligoamenorrea, con hiperandrogenismo y/o morfología de ovarios poliquísticos durante la etapa reproductiva (20 a 40 años). Por el contrario, en pacientes que presentan hiperandrogenismo de nueva aparición, grave o en empeoramiento en esta etapa de la vida con hirsutismo severo, deben descartarse tumores secretores de andrógenos o hipertecosis ovárica. (Ver ANEXO 3).
2. SOP Y RIESGOS ASOCIADOS. Menopausia, enfermedad cardiovascular, intolerancia a la Glucosa y DBT, patología endometrial, SAHOS, impacto psicológico
SOP Y MENOPAUSIA
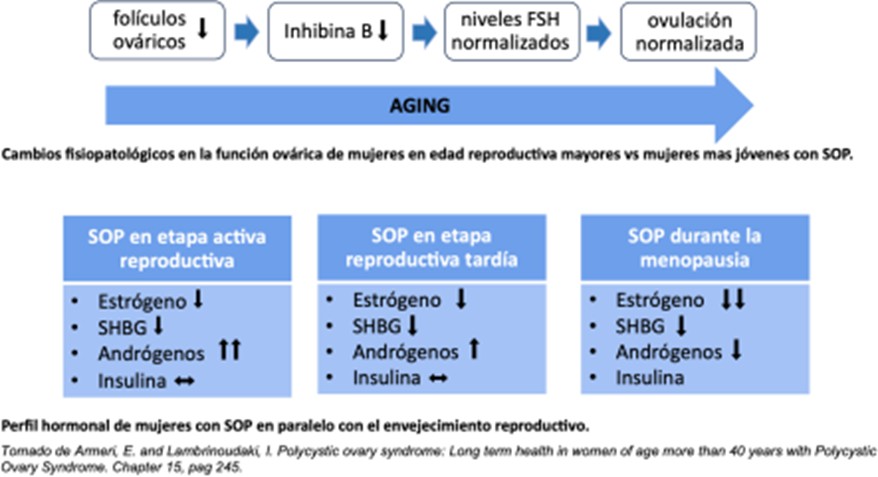
A partir de los 40 años las mujeres con SOP tienden a mejorar sus ciclos menstruales, restableciendo la ovulación, los niveles de hiperandrogenismo van disminuyendo hacia la transición a la menopausia, siendo más atenuados los diferentes fenotipos, como así también la morfología de ovarios poliquísticos, en especial el volumen ovárico, que va desapareciendo a partir de los 40 años.
Se debe tener presente que el riesgo de desarrollar DBT2 en peri y postmenopausia tiene más relación con la obesidad adquirida en edad reproductiva que con el antecedente de SOP.
Con respecto al riesgo oncológico se debe recordar que hay mayor incidencia de cáncer de endometrio en pacientes con SOP.
SOP Y ENFERMEDAD CARDIOVASCULAR
El SOP se asocia con un mayor riesgo de enfermedad cardiovascular (ECV) debido a la alta prevalencia de factores de riesgo cardiometabólicos, como sobrepeso u obesidad, resistencia a la insulina (IR), intolerancia a la glucosa, diabetes, dislipidemia, hipertensión arterial (HTA) y síndrome metabólico. Numerosos estudios sugieren mayor riesgo de cardiopatía isquémica, infarto de miocardio y accidente cerebrovascular en mujeres con SOP, por lo tanto, se establecen las siguientes recomendaciones:
- Detectar factores de riesgo cardiovascular ante el diagnóstico de SOP, interrogando sobre estilos de vida y evaluando: peso, índice de masa corporal (IMC), circunferencia de la cintura, perfil lipídico, presión arterial, niveles de glucosa.
- En controles posteriores, la frecuencia de estas mediciones debe basarse en los factores de Además, debe medirse la presión arterial anualmente y asesorar a la paciente antes de planificar un embarazo o buscar un tratamiento de fertilidad.
- Estrategias preventivas para reducir el riesgo cardiovascular, como cambios en el estilo de vida y el seguimiento a largo plazo, aún después de la menopausia.
SOP, INTOLERANCIA A LA GLUCOSA Y DIABETES
La resistencia a la insulina es un factor fisiopatológico en el SOP, teniendo relación con factores genéticos y epigenéticos, la hiperandrogenemia y la obesidad.
El clamp euglucémico-hiperinsulinémico representa el Gold Standard para evaluar la resistencia metabólica a la insulina; sin embargo, debido a su complejidad, no es adecuado para la práctica clínica.
Existen otros marcadores sencillos y eficaces para la detección de IR, como el IMC, la circunferencia de la cintura (CC) o el índice cintura-cadera. También pueden hallarse signos cutáneos relacionados con un exceso de factor de crecimiento similar a la insulina tipo 1 (IGF-1), como acantosis nigricans, queratosis folicular y acrocordones. Asimismo, biomarcadores séricos como la glucemia en ayunas para el diagnóstico de DBT o glucemia alterada en ayuno y el índice triglicéridos/HDL colesterol para diagnosticar IR, constituyen herramientas alternativas.
Teniendo esto en cuenta, se recomienda:
- Evaluar el estado glucémico al momento del diagnóstico en todas las pacientes con SOP. El mismo debe reevaluarse cada uno a tres años, en función de factores de riesgo individuales
- Se debe considerar la prueba de tolerancia oral a la glucosa (PTOG) en todas las mujeres con SOP que presenten alteración de uno o más de los marcadores antropométricos y/o séricos antes mencionados; y en pacientes con SOP embarazadas entre las 24 y 28 semanas de gestación.
- Tanto los profesionales como las pacientes deben priorizar las estrategias preventivas para reducir el riesgo de diabetes tipo 2.
SOP Y PATOLOGÍA ENDOMETRIAL
Las mujeres con SOP presentan un mayor riesgo de desarrollar hiperplasia endometrial y cáncer de endometrio. Se han propuesto varios mecanismos fisiopatológicos para explicar la posible asociación entre este último y el SOP:
- la exposición prolongada a estrógenos sin oposición, causada por la anovulación crónica.
- la resistencia a la insulina con la consiguiente hiperinsulinemia, observadas en algunas mujeres con SOP, que actuaría como factor de crecimiento en el endometrio. Además, la insulina aumenta la producción de andrógenos ováricos y disminuye la producción hepática de SHBG, lo que puede aumentar los niveles de estrógenos biodisponibles.
- a su vez, estos trastornos hormonales pueden llevar a subfertilidad y menor paridad, que son factores de riesgo independientes para el cáncer de endometrio.
Sin embargo, el riesgo absoluto de desarrollar cáncer de endometrio es bajo, por lo que se aconseja seguimiento acorde a guías de población general. Deben indicarse estrategias de prevención, tales como: descenso de peso, regulación del ciclo menstrual y tratamiento con progestágenos de ser necesario. Finalmente, considerar la realización de biopsia endometrial en casos de endometrio engrosado de forma persistente o sangrado uterino anormal.
SOP Y APNEA OBSTRUCTIVA DEL SUEÑO (SAHOS)
Las mujeres con SOP tienen una prevalencia significativamente mayor de SAHOS, independientemente de su IMC, por lo que deben ser interrogadas sobre síntomas específicos (ronquidos, despertarse sin haber descansado, somnolencia diurna o fatiga) y, de presentarlos, ser evaluadas con cuestionarios validados o referidas para un estudio formal del sueño.
SOP E IMPACTO PSICOLÓGICO
Las mujeres con SOP presentan mayor prevalencia de depresión y ansiedad, por lo que se recomienda el cribado de estas patologías, según enfoques validados en la población general. Asimismo, las personas con SOP obtienen puntuaciones más bajas en cuestionarios de función psicosexual en comparación con aquellas sin SOP, además de referir una imagen corporal negativa. Los profesionales de la salud deben considerar los múltiples factores que pueden influir, incluyendo el aumento de peso, el hirsutismo, los trastornos del estado de ánimo, la infertilidad y los medicamentos para el SOP. Finalmente, debe recordarse que la prevalencia de trastornos de la conducta alimentaria y sus factores de riesgo aumentan en el SOP, especialmente en el contexto del control del peso y las intervenciones en el estilo de vida.
3. SOP E INTERVENCIONES EN EL ESTILO DE VIDA. Dieta, ejercicio, estigmas del peso en SOP
Hoy en día las intervenciones en el estilo de vida (ejercicio físico solo o combinación de alimentación saludable y ejercicio físico) constituyen la primera línea de tratamiento del síndrome de ovario poliquístico, por tanto, deben recomendarse a todas las pacientes con
dicho diagnóstico, independientemente de su IMC. Tal recomendación permitirá optimizar la salud global de las pacientes, su calidad de vida y su composición corporal a la vez que mejorará su perfil lipídico y el manejo del peso (mantenimiento, prevención de la ganancia de peso y/o disminución en caso de requerirlo).
Resulta fundamental involucrar a la paciente en su tratamiento ya que está demostrado que un plan de cambio de hábitos trazado en conjunto con ella y en acuerdo con sus posibilidades tiene mayor tasa de éxito. El abordaje debe ser multidisciplinario y empático, con metas realistas y poniendo el foco no en el descenso de peso sino en la salud global de las pacientes, contemplando variables psicosociales, culturales y étnicas. Se debe recordar la existencia del estigma de peso que afecta a esta población a la hora de discutir los cambios en el estilo de vida con ellas, promoviendo la aceptación de la diversidad de los cuerpos.
El abordaje de las intervenciones en el estilo de vida debe incluir modificaciones de comportamiento, a través del establecimiento de metas, herramientas de automonitoreo, resolución de problemas, entrenamiento de la autoestima y refuerzo de cambios; ello optimiza los resultados en manejo de peso, estilo de vida saludable y bienestar emocional. Para ello, las metas SMART (Specific, Measurable, Achievable, Realistic, Timely) pueden ser una valiosa herramienta.
DIETA
No hay evidencia que indique que un tipo de dieta es superior a otra para los resultados antropométricos, metabólicos, hormonales, reproductivos y psicológicos de las pacientes con SOP.
Cualquier composición dietaria que siga los estándares de las guías para la población general para alimentación saludable tendrá beneficios en la salud global de las pacientes. Es por ello que los médicos tratantes deben advertir la importancia de la alimentación, trazando un plan a medida de la paciente, contemplando sus metas y sus posibilidades.
A la hora de indicar cambios en la alimentación, se recomienda discutir con la paciente acerca de las barreras y los facilitadores para optimizar el compromiso y la adherencia al tratamiento, incluyendo factores psicológicos, limitaciones físicas, factores socioeconómicos y socioculturales como así también motivaciones personales.
EJERCICIO FÍSICO
En la población general, el ejercicio físico (tanto la actividad física general como el ejercicio estructurado) tiene claros beneficios en la salud, mientras que el sedentarismo tiene un impacto negativo. Al igual que ocurre con la dieta, no hay evidencia científica que demuestre que un tipo ni intensidad de ejercicio es mejor que otro en pacientes con diagnóstico de SOP; se consideran las mismas recomendaciones que a la población general y se debería recomendar actividad física sostenible según preferencias y objetivos personales. Todos los adultos deberían realizar actividad física y limitar el tiempo que pasan sedentarios.
Se recomienda que para mantener el peso y estar saludables, los adultos (18-64 años) deberían realizar 150-300 minutos semanales de actividad física moderada o 75-150 minutos
semanales de actividad física intensa, combinando actividad aeróbica con ejercicios de fortalecimiento muscular (resistencia/flexibilidad) en dos días no consecutivos de la semana.
Para mayores beneficios y un descenso de peso modesto, en adultos se recomiendan 250 minutos semanales de actividad moderada o 150 minutos por semana de actividad intensa, combinando con ejercicios de fortalecimiento muscular (resistencia/flexibilidad) en dos días no consecutivos de la semana.
En adolescentes se recomienda 60 minutos diarios de actividad física moderada a intensa, incluyendo ejercicios de fortalecimiento muscular por lo menos tres veces por semana.
La actividad física (movimientos producidos por músculos esqueléticos que requieren energía) incluye la realizada para transporte, trabajo, actividades del hogar, deportes y ejercicio físico planificado. La actividad aeróbica debe realizarse como mínimo 10 minutos, intentando realizar por lo menos 30 minutos la mayoría de los días.
4. TRATAMIENTO EN PACIENTES SIN DESEO DE FERTILIDAD.
Anticonceptivos orales combinados/Progestágenos, metformina, fármacos antiobesidad, antiandrógenos, inositol, láser para tratamiento de hirsutismo, cirugía bariátrica
ANTICONCEPTIVOS ORALES COMBINADOS (ACO)
Los ACO pueden recomendarse en mujeres en edad fértil con diagnóstico de SOP para el manejo del hirsutismo y/o de las irregularidades menstruales; dicha recomendación se extiende a la población adolescente.
A la hora de elegir el ACO en pacientes con SOP se deben considerar las guías de anticoncepción general, siguiendo los criterios de elegibilidad médica para uso de los mismos. No existe una combinación de estrógenos y progestágenos que haya demostrado tener superioridad frente a otra en mujeres con SOP.
La combinación de etinilestradiol 35 mcg y acetato de ciproterona debe considerarse tratamiento de segunda línea con respecto a otras opciones, tomando en cuenta sus efectos adversos y beneficios, en especial el riesgo tromboembólico. Asimismo, estudios recientes advierten sobre el riesgo de meningioma asociado al uso de acetato de ciproterona.
No se ha descripto una ventaja clínica con el uso de dosis altas de etinilestradiol (>30 mcg) versus dosis bajas (<30 mcg) para el tratamiento del hirsutismo.
Los anticonceptivos orales con sólo progestágenos pueden considerarse para protección endometrial, siguiendo las recomendaciones de las guías de la población general, teniendo en cuenta que la evidencia en pacientes con SOP es limitada. En aquellas mujeres que no deseen contracepción hormonal, la administración de progestinas ante ciclos de más de 90 días podría ser un enfoque pragmático para prevenir la estimulación endometrial.
METFORMINA
En mujeres con SOP, la metformina mejora la sensibilidad a la insulina, disminuye la hiperinsulinemia y contribuye a reducir la hiperpulsatilidad del GnRH, con una caída en la producción de LH y andrógenos, además de aumentar la globulina transportadora de hormonas sexuales (SHBG). Esto se traduce en una mejor regulación de los ejes hipotálamo-hipófiso-ovárico e hipotálamo-hipófiso-adrenal, reducción de andrógenos libres e IGF-1 y normalización de la relación LH/FSH. Dichos beneficios se observan independientemente del índice de masa corporal, por lo que puede ser útil tanto en pacientes con obesidad como en normopeso. En mujeres con glucemia alterada en ayunas o diabetes tipo 2, la metformina representa la mejor opción terapéutica cuando fracasan las medidas higiénico-dietéticas (plan nutricional y actividad física).
La metformina debe ser considerada como tratamiento en mujeres SOP con IMC mayor o igual a 25 kg/m2, con el fin de mejorar factores antropométricos y metabólicos, como la IR y perfiles lipídico y glucídico. Podría ser indicada asimismo en adolescentes o adultas SOP con IMC menor a 25 kg/m2, considerando que existe evidencia limitada.
Se inicia el tratamiento con dosis bajas (500 mg/día) con incrementos en la misma cada 1-2 semanas. La dosis máxima efectiva es de 2500 mg/d en adultos y 2000 mg/d en población adolescente. La formulación de liberación prolongada se tolera mejor que la de liberación inmediata, siendo los efectos adversos gastrointestinales los más frecuentes, aunque suelen ceder con el uso continuado y con la titulación progresiva de la dosis.
Para el manejo del hirsutismo y la irregularidad menstrual, se prefiere el uso de ACO sobre el de metformina, mientras que se prefiere esta última para mejorar parámetros metabólicos. Su uso combinado ofrece muy poca ventaja adicional con respecto al uso individual de cada uno. En combinación con anticonceptivos orales combinados, la metformina podría alcanzar su máximo beneficio en grupos de alto riesgo metabólico como IMC >30 kg/m2, factores de riesgo para diabetes, glucemia alterada en ayunas o grupos étnicos de alto riesgo. En pacientes que presentan contraindicaciones para la toma de anticonceptivos orales, la metformina puede ser considerada para el manejo de las irregularidades menstruales, no así para el tratamiento del hirsutismo.
FÁRMACOS ANTIOBESIDAD
Mientras que los cambios de estilo de vida juegan un papel crucial en el tratamiento del SOP, los fármacos antiobesidad podrían contribuir en aquellas pacientes que tienen problemas con la adherencia y el mantenimiento a largo plazo de dichos cambios. Estos fármacos son agonistas del receptor GLP-1 (Liraglutida, Semaglutida, entre otros) y Orlistat, y se consideran en pacientes con SOP, sumado a cambios de estilos de vida, de acuerdo a las indicaciones para la población general. Su indicación debe evaluarse dentro de un enfoque integral, en personas con un índice de masa corporal (IMC) ≥30 kg/m², o ≥27 kg/m² en presencia de comorbilidades asociadas al exceso de peso, como alteraciones metabólicas, apnea del sueño o SOP.
Orlistat: Es un fármaco antiobesidad de acción periférica que inhibe las lipasas gástricas y pancreáticas, reduciendo hasta un 30% la absorción de grasas a nivel intestinal y aumentando su eliminación por vía fecal. La dosis recomendada es de 180 a 360 mg/día, administrada durante las comidas o hasta una hora después. Su uso suele limitarse por
efectos adversos gastrointestinales, como dolor abdominal, urgencia fecal y malabsorción de vitaminas liposolubles (A, D, E, K). Orlistat fue superior al placebo en cuanto al perfil lipídico y a los resultados antropométricos, pero no mostró beneficios metabólicos.
Agonistas del receptor GLP-1 (liraglutida, semaglutida, dulaglutida): Estos fármacos actúan a través de la estimulación del receptor de GLP-1, lo que produce estimulación de la liberación de insulina e inhibición del glucagón postprandial, disminución de la producción hepática de glucosa, enlentecimiento del vaciamiento gástrico y modulación del apetito a través de señales centrales de saciedad.
Liraglutida se administra por vía subcutánea una vez al día en dosis de 0.6 a 3 mg, independientemente de la ingesta de alimentos. Semaglutida y dulaglutida están aprobadas en Argentina para personas con diabetes tipo 2 y obesidad. Se administran una vez por semana por vía subcutánea, en dosis de 0.25 a 1 mg (semaglutida) y 0.75 a 3 mg (dulaglutida). Actualmente se encuentra disponible semaglutida oral, en dosis de 3 a 14 mg diarios. En un estudio aleatorizado contra placebo se evidenció que 3 mg/d de liraglutide mejoró los parámetros endócrinos y metabólicos de las mujeres con SOP en 32 semanas. Se recomienda su dosificación gradual para minimizar los efectos secundarios gastrointestinales.
Debe asegurarse un método anticonceptivo adecuado en mujeres bajo este tratamiento, ya que falta información sobre su seguridad durante el embarazo. Su uso debe decidirse en conjunto con la paciente, considerando sus efectos secundarios, su necesidad potencial de requerimiento a largo plazo (dado el riesgo de nueva ganancia de peso al discontinuar el tratamiento) y la falta de evidencia sobre su seguridad a largo plazo.
Todas estas recomendaciones se aplican únicamente a la población adulta ya que no existen estudios en adolescentes con SOP.
Liraglutide (vs placebo) mostró resultados superiores para manejo del ciclo menstrual y algunas -pero no todas- las complicaciones metabólicas y resultantes del hiperandrogenismo en pacientes con SOP; sin embargo, no tuvo beneficios en el perfil lipídico.
FÁRMACOS ANTIANDROGÉNICOS
Los antiandrógenos son un tratamiento farmacológico de segunda línea para los trastornos cutáneos relacionados con el SOP. Pueden añadirse a un anticonceptivo oral combinado (ACO) cuando tras un mínimo de 6 meses de tratamiento asociado a medidas cosméticas, no se ha alcanzado la respuesta deseada. En los casos de intolerancia o contraindicación para el uso de ACO se debe asegurar contracepción eficaz por el riesgo potencial de teratogenicidad. Los fármacos disponibles en Argentina son:
Acetato de Ciproterona: Es un progestágeno con efecto antiandrogénico que actúa principalmente bloqueando el receptor de andrógenos y, en menor medida, inhibiendo la enzima 5α-reductasa. Además, suprime la LH y favorece el aclaramiento hepático de andrógenos. Está disponible en combinación con etinilestradiol (2 mg/35 µg) y como monofármaco en dosis de 50 mg. Si bien fue usado ampliamente, en la actualidad no se recomienda su prescripción, debido a su asociación con un mayor riesgo de meningioma en dosis mayores a 10 mg/d y de tromboembolismo venoso cuando se asocia a etinilestradiol.
Espironolactona: Es un antagonista de la aldosterona con acción antiandrogénica por bloqueo competitivo del receptor de andrógenos e inhibición de la 5α-reductasa. Suele causar sangrados irregulares cuando se indica como monoterapia, por lo que se recomienda combinarla con un ACO. Los efectos adversos son dosis-dependiente, siendo la dosis recomendada de 25 a 100 mg/d.
Finasteride: Es un inhibidor selectivo de la 5α-reductasa tipo 2, con efecto parcial. Se utiliza en dosis de 2,5 a 7,5 mg diarios. Su indicación para el hirsutismo y alopecía es off label. Se debe controlar la función hepática por riesgo aumentado de toxicidad.
Flutamida: Es un antiandrógeno no esteroideo, inhibidor competitivo del receptor de andrógenos dosis-dependiente. Su uso también es off label. La principal preocupación es su potencial de hepatotoxicidad severa, por lo que se recomienda utilizar la menor dosis útil posible (62,5-250 mg/día).
La evidencia disponible hasta la fecha sobre la eficacia de las drogas antiandrogénicas en el tratamiento del SOP es limitada. En mujeres en edad reproductiva, se debe asegurar el uso de un método anticonceptivo eficaz, debido al potencial daño en el desarrollo genital del feto masculino si se utilizan durante el embarazo.
INOSITOL
El Inositol (en cualquier forma) podría ser considerado en mujeres SOP de acuerdo a sus preferencias individuales, considerando que existe evidencia limitada sobre sus beneficios clínicos sobre la ovulación, el peso y el hirsutismo. Debe aconsejarse el uso de metformina por sobre el uso de inositol para el tratamiento del hirsutismo y la adiposidad central, tomando en cuenta que la metformina presenta mayores efectos secundarios gastrointestinales.
No pueden recomendarse dosis ni combinaciones específicas dada la falta de evidencia; también debe tenerse en cuenta que el control regulador y de calidad de los productos puede variar según la región.
LÁSER Y TERAPIAS MECÁNICAS PARA EL MANEJO DE HIRSUTISMO
La terapia láser y de luz deberían ser consideradas para la reducción del hirsutismo y su impacto en la calidad de vida. Las pacientes con SOP pueden requerir mayor número de sesiones en comparación a mujeres con hirsutismo idiopático para alcanzar los mismos resultados.
Aunque la evidencia robusta es limitada, se ha observado que la adición de un ACO, con o sin antiandrógenos, al tratamiento con láser puede mejorar la reducción del vello.
En mujeres con vello rubio, gris o blanco, donde la ausencia de melanina impide la acción del láser, puede considerarse la depilación definitiva mediante electrólisis si se cuenta con personal idóneo para realizarla.
CIRUGÍA BARIÁTRICA / METABÓLICA
La cirugía bariátrica/metabólica puede considerarse en mujeres con síndrome de ovario poliquístico para mejorar la pérdida de peso, la hipertensión, la diabetes (tanto en su prevención como tratamiento), el hirsutismo, los ciclos menstruales irregulares, la ovulación y las tasas de embarazo. Las indicaciones deben basarse en las recomendaciones vigentes para la población general, aunque el SOP —como condición metabólica— podría justificar su indicación en umbrales de IMC más bajos, al igual que otras enfermedades como la diabetes tipo 2. Las técnicas más utilizadas son la gastrectomía vertical en manga y el bypass gástrico en Y de Roux, realizadas habitualmente por vía mínimamente invasiva, con baja morbilidad y mortalidad.
Es fundamental advertir a las pacientes que la fertilidad puede recuperarse rápidamente tras la cirugía. Por lo tanto, se recomienda utilizar anticoncepción eficaz antes y después del procedimiento, incluso cuando se desea un embarazo. La concepción debe diferirse hasta alcanzar un peso estable —habitualmente al cabo de un año— a fin de reducir los riesgos de restricción del crecimiento intrauterino, parto prematuro, complicaciones obstétricas y hospitalización neonatal prolongada.
5. TRATAMIENTO EN PACIENTES CON DESEO DE FERTILIDAD. Letrozole, clomifeno, gonadotrofinas, metformina, asesoramiento preconcepcional, resultados obstétricos
PERICONCEPCION
El período previo a la concepción brinda una “ventana de oportunidad” para corregir los factores de riesgo asociados e implementar cambios saludables de nutrición y en el estilo de vida. Existen factores de riesgo modificables que pueden potenciar el riesgo como la obesidad, el tabaquismo y el alcohol. Es importante evaluar en la consulta la medicación habitual, el estado nutricional, la salud dental, indicar la suplementación con ácido fólico y, si es necesario, vitamina D.
Tener en cuenta el estado de ánimo, ya que estas mujeres tienen con más frecuencia ansiedad, depresión, trastornos de la imagen corporal y de la conducta alimentaria. Es fundamental el bienestar en salud mental, emocional y sexual para mejorar los resultados reproductivos y del embarazo, así como la salud general.
La obesidad previa al embarazo, muy frecuente en las pacientes con SOP, está fuertemente asociada a resultados perinatales adversos y aumenta el riesgo de preeclampsia, diabetes mellitus gestacional (DMG), prematurez y bajo peso del recién nacido. Las intervenciones en el estilo de vida que incorporan nutrición de alta calidad, actividad física y cambios de comportamiento (evitar hábitos tóxicos y exposición a disruptores endocrinos) deben recomendarse antes del embarazo como enfoque principal para ayudar a perder peso y mejorar la salud.
Debido al mayor riesgo de DMG, se recomienda que las mujeres se sometan a pruebas de detección de diabetes y modifiquen factores de riesgo cardiovascular (es decir, obesidad, dislipidemia, hipertensión arterial) antes de la concepción.
TRATAMIENTO EN PACIENTES CON DESEO DE FERTILIDAD LETROZOLE
Actualmente el letrozole es la droga de primera elección en mujeres con SOP con deseo de
fertilidad. El letrozole es un inhibidor de la enzima aromatasa que actúa evitando la conversión de andrógenos a estrógenos. La falta de estrógenos genera un aumento en la FSH, lo que lleva al desarrollo folicular.
No se encontró una mayor incidencia de malformaciones fetales con el uso de esta droga.
Al no poseer efectos deletéreos ni en el moco cervical ni en el endometrio y luego de varios trabajos que muestran una mayor tasa de ovulación, de embarazo y de nacidos vivos con el uso de letrozole en comparación con la utilización de clomifeno, pasó a ser la droga de elección como inductor de la ovulación, reemplazando a esta última.
CITRATO DE CLOMIFENO
El citrato de clomifeno es un modulador selectivo del receptor de estrógenos con propiedades estrogénicas y antiestrogénicas. Esto lo convierte en una buena droga para estimular la ovulación, pero genera efectos antiestrogénicos en el endometrio y en el moco cervical. La tasa de embarazo múltiple reportada es del 5–7% y de síndrome de hiperestimulación ovárica es del 0.3%. El monitoreo ecográfico permite disminuir estos riesgos.
Si bien el citrato de clomifeno fue la droga de primera elección en mujeres con SOP con deseo de fertilidad durante mucho tiempo, aparecieron publicaciones a partir del 2015 que mostraron mayores tasas de ovulación, de embarazo y de nacidos vivos con letrozole versus clomifeno. Es por eso que hoy se considera al letrozole la droga de primera elección en mujeres con SOP con deseo de fertilidad. Sin embargo, dado que el clomifeno tiene un menor costo y es más accesible, suele utilizarse más que el letrozole en la actualidad.
El citrato de clomifeno combinado con metformina podría utilizarse en los casos de intolerancia oral a la glucosa ya que la metformina como única droga no ha reportado mayores tasas de embarazo.
GONADOTROFINAS
Las gonadotrofinas deben utilizarse en pacientes que no respondieron al letrozole o al clomifeno o que tuvieron una respuesta inadecuada como ser un endometrio no receptivo. Se deben utilizar dosis bajas para evitar la hiperestimulación ovárica y el embarazo múltiple.
Son drogas de segunda línea por su alto costo, la necesidad de hacer controles ecográficos más seguido y porque deben indicarse por vía subcutánea en vez de la oral.
La estimulación ovárica debe realizarse con monitoreo ecográfico para observar la respuesta a la medicación para de este modo aumentar las chances de éxito y minimizar los riesgos. Sería conveniente cancelar el ciclo en el caso de tener más de 2 folículos de más de 14 mm
de diámetro y evitar en esos casos las relaciones sexuales sin protección.
DRILLING OVÁRICO
La cirugía laparoscópica con drilling ovárico podría ser una terapia de segunda línea para mujeres que ya tienen otra indicación de cirugía o con resistencia al citrato de clomifeno o que no puedan acceder a controles ecográficos.
INOSITOL
El inositol es una alternativa en mujeres que deben recibir metformina pero presentan intolerancia a la misma. Todavía no hay evidencia que muestre mayores tasas de embarazo utilizando esta droga por lo que no está indicada como primera opción.
FIV/ICSI
La fertilización in vitro (FIV) es de tercera línea cuando los tratamientos anteriores no dieron resultado o de primera elección cuando hay otras indicaciones médicas que lo ameriten.
En estas pacientes el riesgo de síndrome de hiperestimulación ovárica es mayor por lo que es importante asesorarlas y tomar medidas para disminuir el riesgo. Se recomienda agregar metformina durante la estimulación ovárica, desencadenar la maduración final de los ovocitos con un agonista de GnRH y no con hCG y congelar los embriones evitando la transferencia en fresco.
EMBARAZO
El embarazo representa una prueba de estrés metabólico debido a los cambios fisiológicos que se experimentan durante la gestación para lograr el correcto aporte de nutrientes al feto. Dado que las embarazadas con SOP tienen alteraciones endocrino-metabólicas y epigenéticas preexistentes, y suelen presentar comorbilidades que, en sí mismas, son factores de riesgo independientes para patología materno-fetal (obesidad, hipertensión arterial), tienen más chances de tener resultados perinatales adversos; todo ello debe tomarse en consideración al momento del seguimiento obstétrico.
Estas complicaciones obstétricas incluyen: pérdida temprana del embarazo (menor de 20 semanas), DMG, trastorno del espectro hipertensivo (hipertensión gestacional y preeclampsia), bebés pequeños para la edad gestacional (PEG), mayor incidencia de cesáreas y riesgos del desarrollo fetal a largo plazo que condicionan la aparición de patologías en la vida adulta.
En cuanto al uso de la metformina durante el embarazo, la mayoría de los ensayos controlados aleatorizados no han demostrado que disminuya la tasa de aborto espontáneo,
de DMG, de macrosomía o de preeclampsia. Si bien la evidencia actual no respalda el uso de metformina en mujeres con SOP u obesidad para disminuir las complicaciones obstétricas, es importante tener en cuenta que en caso de utilizarse, no se ha reportado riesgo teratogénico asociado con su uso y es considerada una droga categoría B. Sin embargo, es importante tener en cuenta que su uso en el segundo y tercer trimestre puede condicionar niños con restricción de crecimiento intrauterino, y con desarrollo de patología en la vida adulta.
POSPARTO
Los beneficios de la lactancia materna no se han estudiado específicamente en las pacientes SOP, pero es sabido que las mujeres que desarrollan diabetes gestacional y amamantan durante al menos 6 meses, reducen su riesgo de diabetes mellitus tipo 2 (DM2) al igual que el riesgo a largo plazo de obesidad infantil para su descendencia.
Los esfuerzos dirigidos a facilitar la pérdida de peso posparto son fundamentales para la salud materna. Fomentar un estilo de vida saludable en el período posparto es importante para prevenir la progresión de la disfunción metabólica y la DM2.
ANEXOS
ANEXO 1:

ANEXO 2:

ANEXO 3:
BIBLIOGRAFÍA
- Teede H, Tay CH, Laven J, Dokras A, Moran LJ, Piltonen T, Costello MF, Boivin J, Redman LM, Boyle JA, Norman RJ, Mousa A. Recommendations From the 2023 International Evidence-based Guideline for the Assessment and Management of Polycystic Ovary Syndrome. J Clin Endocrinol Metab 2023;108(10):2447–2469.
- Teede H, Deeks A, Moran L. Polycystic ovary syndrome: a complex condition with psychological, reproductive and metabolic manifestations that impacts on health across the lifespan. BMC Medicine 2010;8:41.
- Unfer V, Kandaraki E, Pkhaladze L, Roseff S, Vazquez-Levin MH, Laganà AS, Shiao Yang C, Yap-Garcia MIM, Greene NDE, Soulage CO, Bevilacqua A, Benvenga S, Barbaro D, Pintaudi B, Wdowiak A, Aragona C, Kamenov Z, Appetecchia M, Porcaro G, Hernandez Marin I, Nestler When one size does not fit all: Reconsidering PCOS etiology, diagnosis, clinical subgroups, and subgroup-specific treatments. Endocr Metab Science 2024;doi.org/10.1016/j.endmts.2024.100159.
- Hoeger KM, Dokras A, Piltonen Update on PCOS: consequences, challenges, and guiding treatment. J Clin Endocrinol Metab 2021;106(3):e1071-e83.
- Di Michele S, Fulghesu AM, Pittui E, Cordella M, Sicilia G, Mandurino G, D’Alterio MN, Vitale SG, Angioni S. Ultrasound Assessment in Polycystic Ovary Syndrome Diagnosis: From Origins to Future Perspectives - A Comprehensive Review. Biomedicines 2025;13(2):453.
- Piltonen TT, Komsi E, Morin-Papunen LC, Korhonen E, Franks S, Järvelin M, Arffman RK, Ollila M. AMH as part of the diagnostic PCOS workup in large epidemiological studies. Eur J Endocrinol 2023;188(6):547–554.
- Peña AS, Feldman Witchel S, Boivin J, Burgert TS, Ee C, Hoeger KM , Lujan ME, Mousa A, Oberfield S, Tay CT, Teede H. International evidence-based recommendations for polycystic ovary syndrome in adolescents. BMC Med 2025;23(1):151.
- Millán-de-Meer M, Luque-Ramírez M, Nattero-Chávez L, Escobar-Morreale HF. PCOS during the menopausal transition and after menopause: a systematic review and meta analysis. Hum Reprod Update 2023;29(6):741-772.
- Ramezani Tehrani F, Amiri M, Behboudi-Gandevani S, Bidhendi-Yarandi R, Carmina
- Cardiovascular events among reproductive and menopausal age women with polycystic ovary syndrome: a systematic review and meta-analysis. Gynecol Endocrinol 2020;36(1):12-23.
- Profili NI, Castelli R, Gidaro A, Manetti R, Maioli M, Petrillo M, Capobianco G, Delitala AP. Possible Effect of Polycystic Ovary Syndrome (PCOS) on Cardiovascular Disease (CVD): An Update. J Clin Med 2024;13(3):698.
- Guan C, Zahid S, Minhas A, Ouyang P, Vaught A, Baker VL, Michos Polycystic ovary syndrome: a ‘‘risk-enhancing’’ factor for cardiovascular disease. Fertil Steril 2022;117(5):924-935.
- Cassar S, Misso ML, Hopkins WG, Shaw CS, Teede HJ, Stepto NK. Insulin resistance in polycystic ovary syndrome: a systematic review and meta-analysis of euglycaemic– hyperinsulinaemic clamp Hum Reprod 2016;31(11):2619-2631.
- Vollmer J, Christian WJ, Lacy ME. Diabetes screening among women with polycystic ovary syndrome: a descriptive study of commercial claims, 2011–2019. BMC Endocr Disord 2024;24(1):194.
- He J, Ruan X, Li Polycystic ovary syndrome in obstructive sleep apnea-hypopnea