Niveles de andrógenos séricos de acuerdo a los fenotipos del síndrome de ovario poliquístico
Autores: Lamas Majek, Eugenia*; Pérez Lana, Belén**; García, Jimena***; Curcio, Lucía***; Parisi, Sofía**** Leiderman, Susana¹
Resumen:
El Síndrome de Ovario Poliquístico (SOP) se caracteriza por Hiperandrogenismo (HA) clínico o bioquímico, oligoanovulación crónica y/o ovarios de aspecto poliquístico; de acuerdo al Consenso de Rotterdam (2003). Existen diferentes fenotipos de SOP (A, B, C y D) según la combinación de criterios en cada paciente. Objetivo: Evaluar los niveles de Testosterona total (Tot), Testosterona libre (Tol), y Androstenediona (D4A) en los distintos fenotipos SOP.
Materiales y Métodos: Estudio retrospectivo, transversal, observacional, que incluyó 136 mujeres con SOP que consultaron a la Sección entre 2015 y 2018, que fueron divididas en 4 grupos según el fenotipo. Se solicitó laboratorio hormonal con andrógenos séricos. Se compararon medias por T de Student.
Resultados: Fenotipo A: 82 pacientes, B: 23 pacientes, C: 16 pacientes, D: 15 pacientes. Se determinó el valor medio de Tot, Tol y D4A según cada subgrupo.
Conclusiones: A medida que el fenotipo SOP aumenta su severidad, los niveles de Tot, Tol y D4A son más elevados; siendo significativa la diferencia entre los valores de Tot y Tol en el Fenotipo A versus los otros fenotipos.
Abstract:
Polycystic Ovarian Syndrome (PCOS) is characterized by clinical or biochemical hyperandrogenism (HA), chronic oligoanovulation and/or polycystic ovaries; the latter incorporated into the Rotterdam Consensus (2003), which led to the creation of the different SOP phenotypes (A, B, C and D) according to the combination of criteria in each patient. Objectives: To evaluate the levels of Total Testosterone (Tt), Free Testosterone (Ft), and Androstenedione (D4A) in the different SOP phenotypes.
Materials and Methods: A retrospective, cross-sectional study was carried out. 136 women, who consulted between 2015 and 2018, were included. The diagnosis of PCOS and its phenotype was made according to the Rotterdam criteria. Hormone laboratory with serum androgens was requested. Student T means were compared.
Results: Phenotype A: 82 patients, B: 23 patients, C: 16 patients, D: 15 patients. The mean value of Tt, Ft and D4A was determined according to each subgroup.
Conclusions: According to the exposed results, it was observed that, as the SOP phenotype increases its severity, the levels of Ft, Tt and D4A were higher; the difference between the values of Tt and Ft in Phenotype A versus the other phenotypes being significant.
Introducción:
El Síndrome de Ovario Poliquístico (SOP) es la endocrinopatía más frecuente en mujeres en edad reproductiva, con una prevalencia entre el 5 y 15%, de acuerdo al criterio diagnóstico aplicado (1). Este síndrome fue inicialmente descripto por Stein y Leventhal en 1935, frente al hallazgo de mujeres con amenorrea, hirsutismo, obesidad y ovarios de aspecto poliquístico (2).
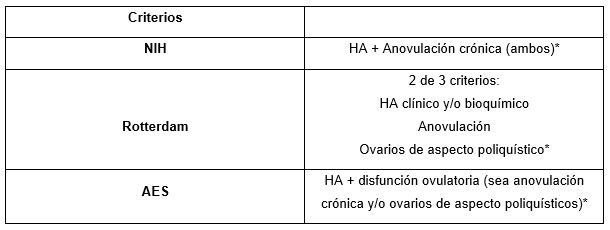
El SOP comprende un conjunto heterogéneo de signos y síntomas que aún continúan siendo motivo de controversia entre especialistas. Durante las últimas décadas han sucedido tres consensos diagnósticos. El primero fue en el año 1990, durante una conferencia de expertos del National Health Institute (NIH), donde se acordó como criterios diagnósticos del SOP: 1) Anovulación crónica y 2) Hiperandrogenismo (HA) clínico y/o bioquímico. Fue más adelante, durante el Consenso de Rotterdam en 2003, que se agregó a esta definición un tercer criterio: Ovarios con morfología ecográfica de SOP (12 o más folículos en cada ovario, de 2 a 9 mm de diámetro y/o un aumento del volumen ovárico mayor a 10 cm3), y se estableció como requisito diagnóstico la presencia de por lo menos 2 de los 3 criterios, excluyendo previamente otras patologías, como ser hiperplasia suprarrenal congénita, tumores secretores de andrógenos, hiperprolactinemia, síndrome de Cushing o disfunción tiroidea. Esta nueva definición llevó al diagnóstico de un mayor número de pacientes, aumentando así la prevalencia de esta patología (3); como así también, en base a las diferentes combinaciones de los tres criterios diagnósticos, a la clasificación de este síndrome en cuatro fenotipos.
En vista a la gran heterogeneidad clínica que comprendía esta clasificación, se sugirió que las pacientes SOP no hiperandrogénicas (es decir, las que presentaban oligoanovulación y ovarios poliquísticos) eran etiopatogénicamente distintas a las pacientes con HA (4). En el año 2006, un panel de expertos de la Sociedad de Exceso de Andrógenos (AES) concluyó que el diagnóstico de SOP debería basarse predominantemente en el HA (requisito obligatorio) junto con un marcador de disfunción ovulatoria (ya sea disfunción ovárica u ovarios ecográficamente de aspecto poliquísticos) (Tabla 1). De esta manera, se excluía el fenotipo no HA (Fenotipo D). Sin embargo, los criterios de AES no fueron universalmente adoptados (5), y la existencia de más de un consenso ocasionó problemas en la práctica clínica, en el diagnóstico y en las diferentes investigaciones alrededor del mundo; por lo que, en 2012, NIH organizó un panel de trabajo para reevaluar los criterios existentes (6, 7). Como resultado, se recomendó la utilización del criterio de Rotterdam, y se realizó una descripción detallada de las características de cada fenotipo:
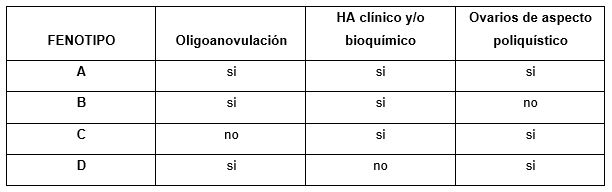
- Fenotipo A: Hiperandrogenismo clínico y/o bioquímico + Disfunción ovulatoria + Ovarios poliquísticos
- Fenotipo B: Hiperandrogenismo clínico y/o bioquímico + Disfunción ovulatoria
- Fenotipo C: Hiperandrogenismo clínico y/o bioquímico + Ovarios poliquísticos
- Fenotipo D: Disfunción ovulatoria + Ovarios poliquísticos (El más controversial, ya que, a diferencia de los otros tres, no se caracteriza por HA) (5) (Tabla 2).
Tabla 1. Criterios diagnósticos para SOP
* En cualquier caso se requiere exclusión de otras patologías: HSC, hiperprolactinemia, disfunción tiroidea, tumores secretores de andrógenos y síndrome de Cushing
Tabla 2. Fenotipos de Rotterdam
Actualmente, la clasificación según Rotterdam es la más utilizada, y la división en fenotipos puede considerarse como una ventaja de la misma, ya que resulta relevante desde el punto de vista clínico y epidemiológico, permitiendo reconocer aquéllas mujeres que tienen mayor riesgo cardiovascular (fenotipos "clásicos", como A y B), como así fenotipos moderados (que no presentan oligoanovulación o hiperandrogenismo). De acuerdo a los resultados de varios estudios, los fenotipos con HA y anovulación fueron asociados a insulinoresistencia y peor perfil metabólico; no así los fenotipos normoandrogénicos. Además, esta clasificación tiene en cuenta las variaciones étnicas en la expresión fenotípica del SOP. Sin embargo, presenta también desventajas: los criterios diagnósticos en forma aislada tienen baja sensibilidad y especificidad diagnóstica; en segundo lugar, el diagnóstico puede hacerse difícil en ciertas situaciones (por ejemplo, casos de anovulación hipotalámica y ovarios de aspecto poliquísticos) y finalmente, no son criterios diagnósticos para ser utilizados en las adolescentes (8). Por último, debe tenerse en cuenta que pacientes seguidas a lo largo de su vida reproductiva pueden cambiar de un fenotipo a otro, dependiendo de factores extrínsecos (tales como edad y peso) (9).
Objetivo:
Evaluar los niveles de Testosterona total (Tot), Testosterona libre (Tol), y Androstenediona (D4A) en los distintos fenotipos SOP.
Materiales y Métodos:
Estudio retrospectivo, transversal y observacional, que incluyó un total de 136 mujeres con diagnóstico de SOP (edad media = 25,3 años), que consultaron a la Sección de Endocrinología Ginecológica del Hospital entre Enero del 2015 y Marzo del 2018. Las pacientes fueron divididas en 4 grupos según el fenotipo SOP al que pertenecieran (por Rotterdam). Se solicitó laboratorio hormonal en fase folicular temprana o amenorrea que incluyó Andrógenos séricos (se determinó Tot mediante Electroquimiolimuniscencia o ECLIA, D4A mediante Radioinmunoensayo o RIA, y para el cálculo de Tol se utilizó la fórmula de Vermeulen). Se compararon medias por T de Student.
Resultados:
Se dividieron las pacientes en 4 grupos según fenotipo (A: 82 pacientes, B: 23 pacientes, C: 16 pacientes, D: 15 pacientes). Se determinó el valor medio de Testosterona Total (Tot), Testosterona libre (Tol) y Androstenediona (D4A) según cada subgrupo, y se volcaron los valores en la siguiente tabla:
Tabla 3. Relación de Fenotipos SOP con niveles de Andrógenos séricos
a: Los valores del Fenotipo A fueron significativamente más altos que los fenotipos B, C y D, es ese orden (p<0.05)
Conclusiones:
A medida que el fenotipo SOP aumenta su severidad (considerándose al fenotipo A como el más severo), los niveles de Tot, Tol y D4A fueron más elevados; siendo significativa la diferencia entre los valores de Tot y Tol en el Fenotipo A versus los otros fenotipos. Esto demostraría, en coincidencia con la bibliografía, la implicancia que tiene el perfil androgénico elevado, en especial la Testosterona, en la fisiopatología del desarrollo del SOP.
Bibliografía:
- Rotterdam ESHRE/ASRM-Sponsored PCOS consensus workshop group. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome (PCOS) Hum Reprod. 2004; 19: 41-47.
- Stein IF, Leventhal ML. Amenorrhea associated with bilateral polycystic ovaries. Am J Obstet Gynecol. 1935; 29: 181–191.
- Lizneva, D et al. The criteria, prevalence and phenotypes of PCOS. Fertil. Steril. 2006; 106: 6-15.
- Goodman NF, Cobin RH, Futterweit W, Glueck JS, Legro RS, Carmina E. American Association of Clinical Endocrinologists, American College or Endocrinology and Androgen Excess and PCOS Society Disease State Clinical Review: guide to the best practices in the evaluation and treatment of polycystic ovary syndrome. Endocr Pract 2015; 21:1291–1300.
- Clark NM, Podolski AJ, Brooks ED, et al. Prevalence of polycystic ovary syndrome phenotypes using updated criteria for polycystic ovarian morphology: an assessment of over 100 consecutive women self-reporting features of polycystic ovary syndrome. Reprod Sci. 2014; 21: 1034–1043.
- Johnson T, Kaplan L, Ouyang P, Rizza R. National Institutes of Health evidence-based methodology workshop on polycystic ovary syndrome (PCOS). NIH EbMW Report. 2013. Bethesda, MD: National Institutes of Health; 1–14.
- A. Dunaif, B.C. Fauser. Renaming PCOS, a two-state solution. J Clin Endocrinol Metab. 2013; 98: 4325-4328.
- Rosenfield RL & Ehrmann DA. The pathogenesis of polycystic ovary syndrome (PCOS): the hypothesis of pcos as functional ovarian hyperandrogenism revisited. Endocr. 2016; 37: 467–520.
- Dewailly D. Diagnostic criteria for PCOS: Is there a need fora rethink?, Best Pract Res Clin Obstet Gynaecol. 2016; 37: 5-11.
* Tocoginecóloga. Fellow de la Sección de Endocrinología Ginecológica y Climaterio. Hospital de Clínicas "José de San Martín" (CABA)
** Tocoginecóloga. Médica de la Sección de Endocrinología Ginecológica y Climaterio. Hospital de Clínicas "José de San Martín" (CABA)
*** Residentes de 4° año de Ginecología y Obstetricia del Hospital General de Agudos "José M. Penna" (CABA). Pasantes de la Sección de Endocrinología Ginecológica y Climaterio del Hospital de Clínicas "José de San Martín" (CABA)
**** Residente de 4° año de Ginecología y Obstetricia de Hospital "Profesor Doctor Luis Güemes" (Haedo). Pasante de la Sección de Endocrinología Ginecológica y Climaterio del Hospital de Clínicas "José de San Martín" (CABA)
¹ Especialista en Endocrinología. Consultora de la Sección de Endocrinología Ginecológica del Hospital de Clínicas "José de San Martín" (CABA)