Aspectos Básicos del Síndrome de Ovario Poliquístico, una revisión a la literatura.
Basic Aspects of Polycystic Ovary Syndrome, a Review of the literature.
Autores:
Angela Patricia Caicedo Goyeneche1, Eliana Patricia Cardona-Sanchez2 ,Paula Camila Godoy Villamil1, Dannia Rosas-Pabón3, Stephanie Patricia Paba-Rojas3
Resumen
Objetivo: El síndrome de ovario poliquístico se caracteriza por anomalías reproductivas, metabólicas y endocrinas que afectan la calidad de vida de las mujeres. Este escrito busca exponer aspectos fundamentales de su fisiopatología y abordaje.
Metodología: Se realizó una búsqueda sistemática de artículos en español e inglés en las PubMed, UpToDate, Medline, ProQuest, Cochrane y de sociedades científicas entre los años 2000 y 2019 utilizando los términos Mesh: polycystic ovary syndrome, hyperandrogenism, infertility, hirsutism, anovulation
Resultados: Se encontraron 855 artículos de los cuales se excluyeron 769 por duplicidad o no cumplir los objetivos de este artículo. Este escrito se basa en 86 artículos que cumplían los criterios de inclusión y estaban publicados en revistas indexadas.
Conclusiones: El impacto de esta enfermedad en la salud y su prevalencia en ascenso hace indispensable conocer las bases para su diagnóstico y abordaje terapéutico acorde a la clínica y características socioculturales de la mujer.
Condensación: Bases para entender la fisiopatología, manifestaciones clínicas, herramientas diagnósticas y abordaje terapéutico del síndrome de ovario poliquístico.
Palabras clave (DeCS): síndrome de ovario poliquístico, hiperandrogenismo, infertilidad, hirsutismo, anovulación. Con su correspondiente en inglés.
Abstract:
Objective: Polycystic ovary syndrome is characterized by reproductive, metabolic and endocrine abnormalities that affect the quality of life of women. This paper aims to expose fundamental aspects of its pathophysiology and approach.
Methodology: A systematic search of articles in Spanish and English in PubMed, UpToDate, Medline, ProQuest, Cochrane and scientific societies between 2000 and 2019 was carried out using the terms Mesh: polycystic ovary syndrome, hyperandrogenism, infertility, hirsutism, anovulation.
Results: 855 articles were found of which 769 were excluded for duplicity or not meeting the objectives of this article. This brief is based on 86 articles that met the inclusion criteria and were published in indexed journals.
Conclusions: The impact of this disease on health and its increasing prevalence makes it essential to know the basis for its diagnosis and therapeutic approach according to the clinical and sociocultural characteristics of women.
Key words (MeSH): polycystic ovary syndrome, hyperandrogenism, infertility, hirsutism, anovulation.
INTRODUCCIÓN
El Síndrome de Ovario poliquístico (SOP) se ha convertido en una de las patologías más estudiadas en ginecología y endocrinología debido a la complejidad de sus bases fisiopatológicas, los distintos fenotipos entre los cuales se presenta y el impacto en la calidad de vida de las pacientes que lo padecen. Este síndrome es considerado una enfermedad endocrino-metabólica común en la mujer en edad reproductiva que involucra hiperandrogenismo, anovulación crónica y ovarios de aspecto poliquístico. Se han detectado factores genéticos, medioambientales, nutricionales y conductuales asociados a esta patología. 〖^1,2〗
Debido a su heterogeneidad y con el advenimiento de avances en materia de investigación en torno a esta patología se han cuestionado diferentes aspectos del síndrome, teniendo en cuenta que aún no tenemos del todo clara su fisiopatología, ni las bases epigenéticas que se convirtieron en tema de investigación . 〖^3,4〗
En esta revisión se busca exponer aspectos básicos necesarios para comprender esta patología y su abordaje terapéutico más apropiado de acuerdo a los avances en materia para lograr un impacto positivo en la calidad de vida de estas pacientes.
METODOLOGÍA
Estudio retrospectivo de búsqueda bibliográfica de artículos de revisión y ensayos clínicos publicados entre el año 2000 y 2019 en las bases de datos PubMed, UpToDate, Medline, ProQuest, Cochrane y actualizaciones de sociedades científicas. La búsqueda se restringió a estudios en idioma inglés y español. Se encontraron 855 artículos de los cuales se excluyeron 769 por duplicidad o no cumplir los objetivos de este artículo. Este escrito se basa en 86 artículos que cumplían los criterios de inclusión y estaban publicados en revistas indexadas. Se utilizaron como términos MeSH: polycystic ovary syndrome, hyperandrogenism, infertility, hirsutism, anovulation
RESULTADOS
¿Cómo se define el síndrome de ovario poliquístico?
El síndrome de ovario poliquístico es una endocrinopatía descrita por primera vez por Stein y Leventhal en 1935. Tiene una prevalencia entre el 7-15% de mujeres en edad reproductiva,〖^5,6〗 y se caracteriza por anomalías reproductivas, endocrinas y metabólicas de origen aún por establecer, sin embargo, existen factores genéticos y medioambientales asociados a su desarrollo. Según los criterios Rotterdam (2003) para su diagnóstico se requiere la presencia de dos de los siguientes tres hallazgos: 1) hiperandrogenismo clínico o bioquímico, 2) disfunción ovulatoria crónica (oligomenorrea, ciclos anovulatorios o amenorrea), y 3) Ovarios de aspecto poliquísticos como principal hallazgo ecográfico, después de excluir causas secundarias. Otra manifestación clínica del SOP es la infertilidad asociada a la interrupción de la función normal del eje Hipotálamo-hipófisis-ovario.〖^7,2〗
Por otra parte, la Sociedad de Exceso de Andrógenos y SOP (AE-PCOs) concluyó en 2006, que para el diagnóstico de SOP se requiere de manera obligatoria la presencia de hiperandrogenismo acompañado de disfunción ovárica manifestada en forma de disfunción ovulatoria y/o morfología poliquística ovárica.〖^8,1〗
La primera definición de SOP dada por el Instituto de Salud Infantil y Desarrollo Humano (NIH) en 1990 incluía la presencia de hiperandrogenismo y disfunción ovulatoria, pero no consideraba la morfología ovárica.〖^9〗 Para el diagnóstico de SOP se requiere excluir trastornos específicos que pueden manifestarse con signos y síntomas similares como el síndrome de Cushing, la hiperprolactinemia, hipercortisolismo, disfunción tiroidea, hiperplasia adrenal congénita no clásica y tumores secretores de andrógenos.〖^10,11〗 Dependiendo del grado de afectación se generan distintos polimorfismos de la enfermedad que se discutirán más adelante.
Las mujeres con diagnóstico de SOP tienen mayor riesgo de síndrome metabólico, diabetes tipo 2, enfermedades cardiovasculares como hipertensión y dislipidemia, y patologías ginecológicas como infertilidad, hiperplasia endometrial o cáncer endometrial. También son más propensas a complicaciones durante la gestación como eclampsia y parto prematuro, y sus implicaciones como bajo peso al nacer. Los trastornos emocionales son comunes en esta población, siendo los cuadros depresivos asociados al desbalance hormonal y a la concepción física una de las patologías más frecuentes asociadas al desarrollo del síndrome. 〖^7,12〗
Orígenes evolutivos, medioambientales y genéticos asociados al síndrome de ovario poliquístico
El SOP antiguamente no era una enfermedad reconocida, pero en la actualidad ha aumentado su prevalencia debido a múltiples factores evolutivos y medioambientales que precipitan su desarrollo. Los ambientes sedentarios obesogénicos eran raros en tiempos ancestrales a diferencia de hoy en día y exacerban muchas de las vías fisiopatológicas relacionadas al SOP aumentando su prevalencia y severidad. Las diferencias entre las condiciones actuales y ancestrales, incluidas aquellas en dieta y actividad física, genera un impacto en la resistencia de insulina en entornos urbanos sedentarios que resulta en tasas más altas de enfermedad metabólica y por ende potencialmente más altas de SOP. Otro aspecto a tener en cuenta, es que las mujeres en entornos ancestrales pasaban gran parte de su vida fértil embarazadas o lactando, lo que implica un menor número de ciclos menstruales comparado con las mujeres en la actualidad que viven en poblaciones industriales y cuyos preceptos en cuanto a paridad cambiaron.〖^7,13〗
En cuanto a los factores genéticos asociados al desarrollo del SOP se han establecido mutaciones de diversos genes que afectan rutas bioquímicas, entre ellas la del gen DENND1A aumenta la biosíntesis de andrógenos por las células de la teca y se relaciona con el fenotipo hiperandrogénico del SOP. Alteraciones en los genes Cyp11A y CYP21 que influyen en la esteroidogénesis ovárica y suprarrenal se consideran las principales protagonistas. Alteraciones en genes que codifican las vías de señalización como ADIPOQ, INS, LHCGR, AMH, e incluso genes que predisponen a ciertos tipos de cáncer como INS, AR, MMP1 se han visto relacionados. 12, 15, 16 Entre los once polimorfismos de nucleótido único (SNP) más estudiados en el desarrollo de SOP, siete mostraron asociaciones significativas. (Ver Tabla I) Además, se han estudiado diversos genes candidatos. Se han identificado 241 variaciones genéticas con clara asociación en el desarrollo de esta patología.17,18
Respecto a su heredabilidad, estudios en gemelas reportan una correlación monocigótica del 71% y una correlación dicigótica del 38%. Los autores de dichos estudios estimaron que la influencia genética representa hasta el 70% de la variación en la patogénesis de SOP, lo que confirma que el componente familiar del SOP se debe a factores genéticos y justifica la búsqueda de genes de susceptibilidad involucrados en el desarrollo de esta entidad.〖^19〗
Recientemente se han encontrado anomalías en el ADN mitocondrial involucradas, lo que genera interrogantes alrededor de un aspecto de esta enfermedad que hasta hace algunos años era desconocido. Las mitocondrias son reguladas por genes duales, mutaciones en estos genes llevan a la disfunción de los procesos metabólicos celulares, principalmente a una producción disminuida de ATP y el subsecuente aumento de especies reactivas de oxígeno. En pacientes con SOP se han identificado alteraciones en genes como tRNA Gln, tRNA Cys, tRNA Asp, tRNA Lys, tRNA Arg y tRNA Glu, siete variantes en el gen 12S ribosomal RNA, tres variantes en 16S rRNA identificados en muestras de sangre periférica. Estas mutaciones han surgido en nucleótidos de ARNt que son cruciales para la estabilidad y la función bioquímica del ARNt.〖^20,21〗 Se ha encontrado relación entre estas mutaciones y diabetes mellitus tipo 2 e hipertensión, que son complicaciones a largo plazo de los pacientes con SOP.〖^22〗 (Ver figura 1)
Los avances en genética y epigenética han permitido establecer el concepto de programación fetal o “teoría de Barker", comprendida como el conjunto de modificaciones que ocurren durante la vida fetal que permiten la adaptación a la vida posnatal. Se ha evidenciado que el exceso de andrógenos materno se relaciona a diferentes fenotipos postnatales del SOP,〖^23〗 entre ellos, hipersecreción de hormona luteinizante, intolerancia a la glucosa, obesidad, resistencia a la insulina y aumento de las concentraciones de hormona antimulleriana. Estas modificaciones reforzadas en el ambiente fetal pueden perpetuarse durante el transcurso de la vida, es por ello que la epigenética ha cobrado importancia no solo en el estudio de las bases fisiopatológicas de esta enfermedad, sino como herramienta útil para identificar los diferentes fenotipos del síndrome y determinar su enfoque clínico y terapéutico.〖^24〗
Actualmente contamos con bases de datos como PCOSKB que integran la información genética disponible relacionada a esta patología.〖^25〗
Fisiopatología del SOP
Las alteraciones hormonales y su efecto en las vías metabólicas en torno a la disfunción ovárica, en relación con los factores medioambientales y genéticos previamente descritos se han identificado como los principales causales del SOP. A continuación, se mencionan los factores más importantes.
Disfunción neuroendocrina
Normalmente las neuronas hipotalámicas de factor liberador de gonadotrofinas (GnRH) secretan en pulsos discretos que viajan a través de la eminencia media hacia los gonadótrofos pituitarios e inducen la secreción pulsátil de hormona luteinizante (LH) y hormona folículo estimulante (FSH).〖^26〗
El SOP se caracteriza por una mayor secreción de LH debido al aumento en amplitud y frecuencia de los pulsos de liberación de la LH secundario a su vez, al incremento de los pulsos de GnRH. Los niveles de secreción de la FSH se encuentran dentro de rangos de normalidad o disminuidos, y como resultado se eleva el cociente LH/FSH, que es un criterio usado para el diagnóstico de SOP.〖^23〗
El aumento de la pulsatilidad de la GnRH se explica como efecto secundario del hiperestrogenismo, ya que el estradiol modula la liberación de GnRH en el sistema hipotálamo-hipofisario. En este fenómeno influyen factores como: la alteración de la sensibilidad hipotalámica al control esteroideo, en especial de la progesterona; anomalías en neurotransmisores (entre ellos dopamina, β-endorfinas, péptidos opiáceos, angiotensina II, serotonina, neuropéptido Y, neurotensina, somatostatina, factor liberador de corticotropina, melatonina, noradrenalina, oxitocina y sustancia P) asociados con mayor pulsatilidad de GnRh y anomalías en la retroalimentación hipotálamo-hipofisaria por moléculas no esteroideas, como la insulina, que explicaría la importancia de esta vía metabólica con el SOP.〖^27〗
El exceso de LH se puede explicar por el hiperandrogenismo, que altera la retroalimentación negativa de la hormona. En presencia del exceso de insulina, el aumento de las concentraciones séricas de LH agrava la disfunción ovárica. Algunos estudios sugieren que la exposición prenatal a andrógenos afecta la secreción de LH en la vida adulta. 〖^28,29,30〗 La asociación entre la exposición a andrógenos y el aumento de las concentraciones de LH fue comprobada en estudios en monos Rhesus realizados por Dumesic et al. en los que al administrar propionato de Testosterona a hembras gestantes sus crías hembras mostraron niveles significativamente elevados de LH durante las fases folicular y lútea, y una relación LH/FSH aumentada en relación con el grupo de control. 〖^27,31〗
Hiperandrogenismo ovárico funcional (FOH):
La evidencia demuestra que gran parte de las alteraciones secundarias al SOP corresponden a la disfunción intrínseca de los andrógenos producidos por el ovario. Al exceso de andrógenos producido por los ovarios se le denominó FOH. Debido a que la alteración esteroidogénica y subsecuente producción de andrógenos ováricos depende de gonadotropina, suprimir la producción de gonadotropina suprime la producción androgénica. 〖^32〗 Con esta hipótesis se logró demostrar que el exceso de andrógenos intra ováricos aumenta el reclutamiento de folículos primordiales e influye en el crecimiento de folículos antrales. Adicionalmente el aumento en las concentraciones de andrógenos genera una luteinización prematura, afectando la selección de un folículo dominante y alterando la ovulación. Finalmente dicho exceso de andrógenos contribuye a los cambios anatomo/histológicos ovaricos con su morfología poliquística. El aumento en la secreción de andrógenos depende de LH por lo tanto se considera de carácter funcional.〖^32,33,34〗
El FOH se caracteriza por un patrón alterado en la esteroidogénesis que implica hiperactividad de toda la cascada esteroidogénica ovárica implicada en la secreción de esteroides sexuales. La disfunción intrínseca de las células de la teca juega un papel importante en este proceso debido a que estas sobreexpresan enzimas esteroidogénicas, en particular los receptores de citocromo P450c17 y LH. 〖^35〗 Es así como se comprobó la existencia de una alteración de base en el citocromo P450c17 (CYP17A1) que controla la velocidad de formación de andrógenos en las gónadas y la corteza suprarrenal, y cuenta con actividad tanto de 17-hidroxilasa como de 17,20-liasa, necesarias para la formación de cortisol en la corteza suprarrenal y esteroides sexuales en las gónadas. La 17,20-liasa actúa de manera menos eficiente para formar 17-cetosteroides como dehidroepiandrosterona (DHEA) y androstenediona. Estos 17-cetosteroides son precursores de todos los esteroides sexuales potentes en las gónadas y la zona reticular suprarrenal.〖^27,36〗
Pero no solo las células tecales se ven involucradas, también las células de la granulosa cumplen un papel importante en la fisiopatología del SOP: Al estar prematuramente luteinizadas son hipersensibles a la FSH, generando una sobreproducción de estradiol como respuesta la secreción de la FSH provocando una mayor estimulación de las células de la granulosa e interviniendo en el crecimiento folicular. Es así como en el SOP el exceso de andrógenos estimula el crecimiento anormal de folículos pequeños y la luteinización prematura de las células de la granulosa en la fase folicular media, deteniendo la maduración de dichos folículos e impidiendo la selección de un folículo dominante, lo que lleva a anovulación. 〖^27,37,38,39〗
Sin embargo, aunque la mayor parte de esta alteración se debe a la producción de andrógenos ováricos la producción adrenal también juega un papel importante. Por esto surge el concepto de hiperandrogenismo funcional adrenal (FAH) que se define como una respuesta aumentada de producción de 17-cetosteroides al estímulo con ACTH en ausencia del bloqueo de la esteroidogénesis de la zona reticular suprarrenal. Esto lleva a una adrenarquia exagerada. La mayor respuesta a la ACTH se observa en la dehidroepiandrosterona, que ocurre en paralelo con la esteroidogénesis ovárica. En el SOP menos del 10% del FAH se debe a entidades bien definidas, como por ejemplo la hiperplasia adrenal congénita, la mayoría es idiopático.〖^40,41〗
Resistencia a la insulina
Las mujeres que padecen SOP comparten características similares a las pacientes con síndrome metabólico, entre ellas quizá la más importante es la resistencia a la insulina. 〖^42〗 Reportada en el 50-70% de pacientes con SOP〖^43〗 es una característica común del síndrome independiente del índice de masa corporal (ya que esta puede presentarse en pacientes delgadas) sin embargo, se agrava con la obesidad 〖^44〗 y está íntimamente relacionada con el hiperandrogenismo. Al encontrarse mayor cantidad de andrógenos biodisponibles se produce mayor resistencia a la insulina en tejidos periféricos, especialmente en músculo esquelético, y aumenta la acción de la insulina en tejidos como el ovario y la adipocitos. La resistencia a la insulina incrementa las concentraciones de insulina de forma compensatoria produciendo efectos directos a nivel del sistema hipotálamo hipofisiario, contribuyendo con niveles anormales de gonadotropina que estimulará la producción de LH y por ende el aumento se andrógenos ováricos en las células de la teca.〖^45〗
El exceso de insulina en combinación con el exceso de andrógenos interfiere en la acción de la FSH para inducir receptores de LH en las células de la granulosa, contribuyendo al proceso de luteinización prematura de las células de la granulosa y agravando su disfunción.〖^40,46〗
Los niveles elevados de insulina estimulan la producción de andrógenos mediados por la hormona adrenocorticotrópica a nivel de las glándulas suprarrenales que propicia el ambiente hiperandrogénico que caracteriza este síndrome. La insulina también disminuye la producción de Globulina fijadora de hormonas sexuales (SHBG) en el hígado y como consecuencia aumenta la cantidad de andrógenos libres biodisponibles, resultando en mayores concentraciones circulantes de testosterona. 〖^47〗
Disfunción adiposa
La hipertrofia e hiperplasia del tejido adiposo es otra característica del SOP. Se produce en respuesta al exceso de nutrientes y lleva a eventos hipóxicos locales promoviendo la secreción de citocinas pro inflamatorias, invasión de macrófagos, liberación de ácidos grasos libres y resistencia a la insulina. Esta última tiene un efecto directo en la lipólisis de adipocitos, aumentando las concentraciones séricas de ácidos grasos libres y triglicéridos y estimulando así la lipogénesis hepática y la hiperlipidemia. 〖^47〗
La resistencia a la insulina contribuye a una adipogénesis disfuncional. La alteración en la producción de adipocinas como la adiponectina, facilita el desarrollo de resistencia a la insulina. Otro tipo de adipocinas asociadas al desarrollo de esta patología son la leptina, la proteína de unión a retinol 4 y la visfatina. 〖^3〗
El tejido adiposo desempeña un papel importante en la síntesis de andrógenos ya que este posee enzimas que activan los precursores de andrógenos. El ejemplo más claro es la enzima aldo-ketoreductasa tipo 1C codificada por el gen AKR1C3 que se expresa en el tejido adiposo y convierte la androstenediona pre andrógena a testosterona. De esta forma es capaz de regular la proliferación y diferenciación de adipocitos, la sensibilidad a la insulina, la señalización de adipocinas y el metabolismo de los lípidos indicando una íntima relación entre la síntesis de andrógenos por parte de los adipocitos y la acumulación de lípidos generados por los mismos con hiperinsulinemia y resistencia a la insulina.〖^48〗
La Figura 2 Sintetiza la fisiopatología del SOP.
Hormona antimulleriana (AMH)
Esta hormona secretada en los folículos antrales pequeños de las células de la granulosa, se ha demostrado una correlación entre los niveles séricos de esta hormona y la severidad de los síntomas en especial de las alteraciones menstruales y la morfología poliquística ovárica. AMH bloquea actividad aromatasa y por ende disminuye los niveles de estradiol al inhibir la hormona FSH; además estimula las neuronas productoras de GnRH incrementando la pulsatilidad de LH, y actúa a nivel paracrino inhibiendo el desarrollo folicular generando anovulación, y perpetuando así el estado hiperandrogénico. Los niveles elevados de esta hormona están implicados en la programación ovárica prenatal: hijas de madres con SOP podrían desarrollar esta patología en su vida adulta tras la exposición androgénica presente desde la vida in útero.〖^49,50〗
Criterios de diagnóstico clínico:
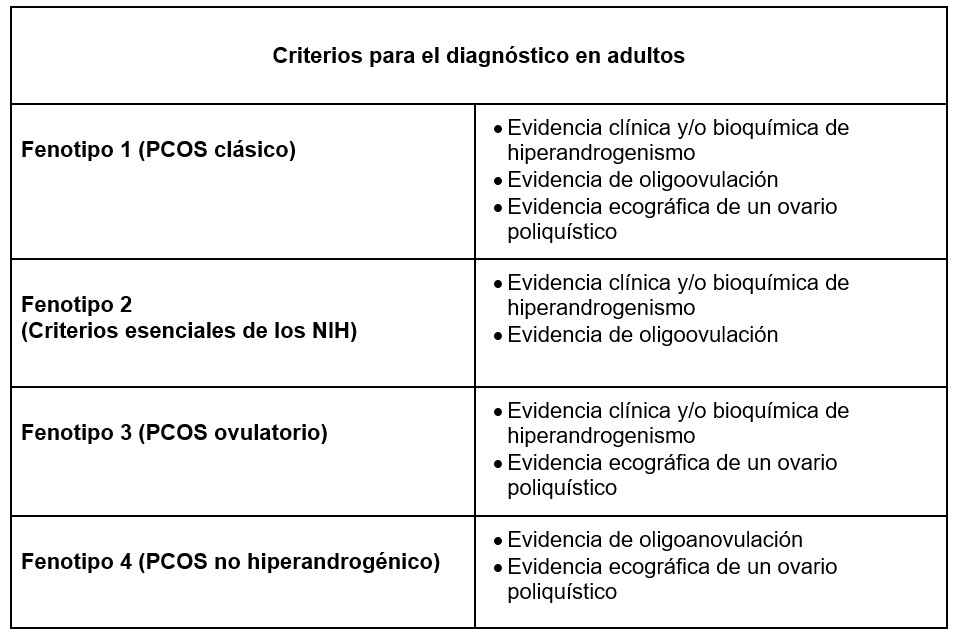
Aún existen divisiones entre la comunidad médica al respecto a los criterios para el diagnóstico clínico de SOP. Dentro de los criterios aceptados se encuentran los propuestos por el NIH, Los criterios de la Sociedad Europea para la Reproducción y Embriología Humana / Rotterdam a partir de 2003 (Criterios Rotterdam) y Los criterios de la AE-PCOs de 2009.(50) como se muestra en la Figura 3. Los más aplicados tanto en la clínica como en la investigación científica en la actualidad son los criterios de Rotterdam.〖^51〗 Al existir múltiples etiologías del SOP y tratarse de una enfermedad endocrino-metabólica compleja es imposible establecer una sintomatología única para describir el síndrome, por lo tanto se han descrito diferentes fenotipos que combinan los síntomas principales que pueden encontrarse en los individuos y que pueden variar en cuanto a causa y la gravedad. (52) De acuerdo con los criterios de Rotterdam se han descrito diferentes Fenotipos de SOP que se ilustran en la Tabla 2. 〖^27〗
Los cuatro fenotipos descritos varían de acuerdo con el grado de disfunción metabólica y ovárica y se agrupan desde el más severo, descrito como el fenotipo clásico, hasta el menos grave descrito que es el fenotipo normo androgénico. El SOP clásico (fenotipo I) se caracteriza por anovulación, hiperandrogenismo y ovarios de morfología poliquística; estas pacientes tienen un riesgo más alto de presentar comorbilidades como sobrepeso/obesidad, resistencia a la insulina y disfunciones metabólicas.〖^27,53〗 El fenotipo II se caracteriza por anovulación e hiperandrogenismo, y se ha descrito que puede ser tan grave como el fenotipo I dado el riesgo de resistencia a la insulina y disfunción metabólica. (54) El SOP ovulatorio (fenotipo III) se caracteriza por hiperandrogenismo y ovarios poliquísticos, se considera una forma más leve del síndrome y se manifiesta con un hiperandrogenismo menos grave que los anteriormente descritos, menores índices de resistencia a la insulina y disfunción metabólica, carece de reducción de la tasa ovulatoria, evitando subfertilidad.〖^5〗 El fenotipo IV también denominado normo androgénico se caracteriza por anovulación y la presencia de morfología ovárica poliquística, es la forma más leve del trastorno con índices más bajos de comorbilidades endocrino-metabólicas (obesidad, resistencia a insulina), sin embargo este grupo reporta niveles elevados de hormona luteinizante con la consecuencia de anovulación.〖^55〗
Manifestaciones clínicas principales
Las manifestaciones clínicas del SOP son variables y dependen de los factores anteriormente descritos. Muchas mujeres pueden ser incluso asintomáticas.
Las alteraciones menstruales en el SOP se caracterizan por ciclos menstruales infrecuentes (menos de nueve períodos menstruales en un año) o amenorrea (sin períodos menstruales durante tres o más meses consecutivos) como consecuencia de la ovulación poco frecuente o ausente. Dichas alteraciones menstruales inician típicamente en la etapa peripuberal. En mujeres con SOP es frecuente una menarquia normal o ligeramente retrasada seguida de ciclos irregulares, o ciclos regulares al inicio de la vida ginecológica y luego irregularidades menstruales que en muchos casos se relacionan con aumento de peso.〖^56,57〗 Los ciclos menstruales irregulares se definen:
De acuerdo a su duración se considera normal entre 4 y 8 días, y prolongado mayor a 8 días
De acuerdo con el volumen, se considera normal entre 5 y 80 mililitros (ml), abundante si es mayor a 80 ml y escaso si es menor a 5 ml;
En cuanto a la frecuencia, si es ausente se considera amenorrea, normal entre 24 a 38 días, frecuente menor a 24 días e infrecuente mayor a 38 días.
con respecto a la regularidad, es el término que más ha tenido discusión, sin embargo, actualmente se considera regular cuando existen variaciones entre el ciclo más corto y el más largo hasta de 9 días, e irregular si es mayor a 10 días.〖^58〗
Entre las manifestaciones de hiperandrogenismo se encuentra el hirsutismo, que es valorado con la escala de Ferriman-Gallwey que califica la presencia de vello terminal en 9 áreas corporales: supralabial, mentón, tórax, abdomen superior e inferior, dorso superior e inferior, muslos y brazos. Valores mayores o iguales a 6 se consideran hirsutismo en nuestra región.〖^59,60〗 También son manifestaciones de hiperandrogenismo la alopecia de patrón masculino, piel grasa con subsecuente desarrollo de acné por la acción de la testosterona, que por medio de la 5 alfa reductasa aumenta la producción sebácea, factores de crecimiento y proliferación folicular directamente en el queratinocito folicular, y lleva a hirsutismo.〖^61〗
El hiperandrogenismo bioquímico se diagnóstica al documentar concentraciones elevadas de andrógenos séricos. La testosterona libre calculada, la testosterona biodisponible calculada, el índice de andrógenos libres, la androstenediona y la medición de Dehidroepiandrosterona proporcionan información útil. Cabe resaltar que la medición de dichos andrógenos debe realizarse utilizando ensayos de alta calidad como inmunoensayos de extracción/cromatografía o cromatografía líquida-espectrometría de masas en tándem.〖^58,62〗
La morfología del ovario poliquístico (PCOM) incluye ovarios aumentados de tamaño, con aumento del estroma y componentes quísticos periféricos (“imagen de collar de perlas”) y se identificó inicialmente por la presencia de 12 o más folículos de 2 a 9 mm de diámetro (folículos antrales) y/o un volumen ovárico mayor a 10 ml en uno o ambos ovarios de acuerdo a los criterios diagnósticos establecidos por el consenso de Rotterdam. Sin embargo, el rol de los hallazgos ultrasonográficos en SOP ha sido cuestionado ya que entre el 20 y 30 % de las mujeres menores de 36 años pueden tener poliquistosis ovárica sin un diagnóstico de SOP, por lo que se han replanteado los hallazgos ecográficos en aquellas pacientes que lo padecen. Fue así como en 2014 la AEPS recomendó el uso de la cuantificación de más de ≥25 folículos por ovario al usar transductores de >8MHZ de frecuencia. Si dicha tecnología no se encuentra disponible se recomienda usar el volumen ovárico para diagnóstico. Estudios demuestran mayor fiabilidad de la morfología ovárica que el volumen ovárico en el diagnóstico pacientes con sospecha de SOP.〖^63,64〗 El estudio ecográfico no debe usarse para diagnóstico de SOP antes de que hayan pasado 8 años después de la menarquia, debido a la alta incidencia de folículos ováricos múltiples en esta etapa de la vida.〖^58〗
Para identificar ecográficamente el SOP deben tenerse en cuenta ciertos protocolos claros para informar el número de folículos en cada ovario, entre los cuales se incluyen:
- Fecha de último período menstrual
- Frecuencia de ancho de banda del transductor
- Enfoque / ruta evaluada
- Número total de folículos por ovario que mide 2-9 mm
- Tres dimensiones y volumen de cada ovario
- Informe del grosor y la apariencia del endometrio: endometrio de 3 capas además de que la evaluación puede ser útil para detectar patología endometrial
- Otras patologías ováricas y uterinas, así como quistes ováricos, cuerpo lúteo, folículos dominantes ≥ igual a 10 mm.〖^58〗
Un modelo de detección temprana es importante para optimizar el tratamiento y prevenir morbilidad asociada en estas pacientes teniendo en cuenta las complicaciones cardio-metabólicas y reproductivas asociadas al SOP, entre ellas alteraciones en la fertilidad, obesidad, síndrome metabólico, diabetes tipo 2 y cáncer de endometrio.〖^65〗
Subfertilidad
Un subgrupo de mujeres con SOP es infértil o tiene dificultades para lograr un embarazo viable debido a que presentan ovulaciones intermitentes o gran parte de sus ciclos anovulatorios. Dicho aspecto puede mejorar con la reducción de peso, ya que un índice de masa corporal más bajo se ha visto asociado con una mayor probabilidad de ovulación y concepción.〖^66〗
Obesidad y síndrome metabólico
La obesidad es una característica común en mujeres con SOP, con prevalencias de obesidad entre 30% y 75%〖^67〗. Disminuir el índice de masa corporal en estas pacientes se ha asociado con mejoría en diferentes comorbilidades asociadas, entre ellas la insulinoresistencia, hiperlipidemia, hipertensión y las irregularidades menstruales.〖^68〗 Las pacientes con SOP que también presentan sobrepeso u obesidad muestran peores resultados metabólicos y reproductivos medidos en comparación con mujeres con SOP de peso saludable. Las mujeres con sobrepeso presentan diferencias en niveles de testosterona total, hirsutismo, colesterol total y LDL en comparación con las mujeres de peso normal.〖^67〗
Muchas pacientes SOP tienen características de síndrome metabólico,〖^69〗 con mayor riesgo de trastornos cardiovasculares, enfermedad coronaria, accidente cerebrovascular, diabetes mellitus tipo 2 y mortalidad.〖^70〗 El síndrome metabólico se caracteriza por dislipidemia (nivel de triglicéridos> 150 mg / dl, nivel de colesterol de lipoproteínas de alta densidad [HDL-C] <50 mg / dl), obesidad abdominal (circunferencia de la cintura> 88 cm), presión arterial elevada, un estado protrombótico caracterizado con niveles elevados de inhibidor del activador de plasminógeno-1 (PAI-1), niveles de fibrinógeno y un estado proinflamatorio con aumento de proteína C reactiva.〖^71〗.
La prevalencia de síndrome metabólico en pacientes con SOP se estima en 30%, indicando una alta prevalencia, de aquí radica la importancia del diagnóstico y tratamiento apropiado de esta enfermedad para disminuir las comorbilidades asociadas.〖^72〗
Diabetes mellitus
Cerca del 10% de mujeres con SOP tienen diabetes mellitus tipo 2, y el 30-40% tienen intolerancia a la glucosa. Por ello se recomienda la detección de diabetes tipo 2 e intolerancia a la glucosa a en mujeres con SOP con estudios de glicemia ayunas y 2 horas después de administrar una carga de glucosa de 75 g. La acantosis nigricans es un signo clínico de insulinorresistencia. Se ha identificado en mujeres con SOP aumento de la mortalidad derivada de complicaciones de diabetes〖^73,74〗
Depresión e impacto psicológico
Las mujeres con SOP con síntomas depresivos duplican las prevalencias en comparación a la población general (36.6% en SOP frente a 14.2% en los controles). De igual manera se encuentran niveles de ansiedad más altos en estas pacientes siendo de etiología multifactorial, con la interacción de síntomas, estilo de vida y percepción física que cronifican esta afección. Se deben plantear estrategias para identificar tempranamente estas alteraciones mentales y realizar las intervenciones necesarias.〖^60〗
Estudios paraclínicos a solicitar
Además del estudio ecográfico como recurso imagenológico importante y parte de los criterios diagnósticos, se debe tener en cuenta la medición de LH, andrógenos totales, testosterona total, índice de andrógenos libres o índice de testosterona libre, DHEA, androstenediona, y la medición de 17-hidroxiprogesterona para diferenciación diagnóstica con deficiencia de 21-hidroxilasa y descartar hiperplasia suprarrenal congénita no clásica que pueden presentarse clínicamente como SOP (hiperandrogenismo, anovulación y PCOM).〖^58〗 En un estudio comparativo entre mujeres hirsutas que incluyó 156 mujeres entre los 14 a 45 años de edad, se encontró que la hiperplasia suprarrenal no clásica y el SOP se presentan con características clínicas similares y niveles elevados de andrógenos, sin embargo las mujeres con SOP son más propensas a la oligomenorrea o amenorrea, tienen una mayor prevalencia de ovarios poliquísticos y tienen relaciones LH / FSH>2.〖^75〗
La medición de AMH (> 4.5 ng / ml) pueden usarse como sustituto de la morfología ovárica cuando no se dispone de una ecografía ovárica precisa. Se deben incluir la globulina fijadora de hormonas sexuales (SHBG), hormona adrenocorticótropa (ACTH), insulina, hormona estimulante de la tiroides (TSH), triyodotironina libre (FT3), tiroxina libre (FT4) y prolactina entre los estudios de cualquier mujer con oligomenorrea/anovulación para descartar otras causas de menstruaciones irregulares. La glucosa sérica, concentraciones de colesterol total y triglicéridos hacen parte del screening completo de estas pacientes,〖^54,57〗 y en aquellas pacientes con clínica de apnea del sueño considerar la posibilidad de realizar una polisomnografía si el recurso se encuentra disponible.〖^58〗 El estudio inicial de estas pacientes se resume en la Figura 4.
Tratamiento
Cambios en el estilo de vida
La intervención sobre el estilo de vida en base a objetivos realistas y personalizados que incluyan cambios conductuales, control de peso y actividad física contribuyen a la mejoría de muchas de las manifestaciones del SOP. Dentro de los aspectos conductuales a intervenir se incluyen la resolución de problemas, el establecimiento de objetivos y la prevención de recaídas, que conllevan a un resultado más sostenido. Las guías del Centro de Investigación de Excelencia en Síndrome de Ovario Poliquístico en asociación con la Sociedad Europea de Reproducción Humana y Embriología (ESHRE) y Sociedad Americana de Medicina Reproductiva (ASRM) publicadas en 2018 proponen involucrar en este aspecto a amigos y familiares, y en cuanto a intervenciones dietarias reducir la ingesta calórica en 500 - 750 kcal/día valorando individualmente a cada paciente y teniendo en cuenta sus preferencias culturales y dietéticas. Además estipulan un objetivo de 150 minutos semanales de ejercicio de intensidad moderada a alta dados los beneficios a largo plazo en la salud mental, metabólica y reproductiva. En aquellas pacientes con exceso de peso se considera una reducción adecuada una pérdida del 5% al 10% del peso en seis meses.〖^58〗
Tratamiento farmacológico:
Aspectos a tener en cuenta en paciente sin deseos de fertilidad:
Anticonceptivos orales combinados (ACO)
Los ACO se consideran una pieza clave en el tratamiento de mujeres con SOP por su efectividad en el manejo del hiperandrogenismo clínico, irregularidades menstruales y supresión de la esteroidogénesis ovárica.〖^76〗 La combinación de estrógenos y progesterona disminuye la producción de gonadotrofinas y la secreción ovárica de andrógenos. El componente estrogénico incrementa los niveles de SHBG disminuyendo la testosterona libre, la síntesis adrenal de andrógenos y bloqueando los receptores androgénicos.〖^61〗
No hay evidencia suficiente para determinar el mejor ACO para manejo de SOP pero se prefieren las combinaciones de dosis bajas de etinilestradiol con un progestágeno antiandrogénico (clormadinona, acetato de ciproterona, dienogest y drospirenona), o androgénico y metabólicamente neutros (gestodeno, desogestrel, norgestimato). Se debe incluir a la mujer en la elección del medicamento, considerando la efectividad demostrada en combinación con las intervenciones en estilo de vida y el control de la insulinoresistencia〖^76,77〗
Los ACO también mejoran el acné y el hirsutismo, regularizan el sangrado menstrual y así contribuye a la prevención de la hiperplasia endometrial. En pacientes con hirsutismo moderado-grave o refractario tras 6-12 meses del inicio del tratamiento con ACO deben considerarse fármacos antiandrogénicos como el acetato de ciproterona, la espironolactona y los inhibidores de la 5-alfa reductasa.〖^78〗
En aquellas pacientes con SOP sin manifestaciones clínicas de hiperandrogenismo que no deseen o en quienes se contraindique el uso de ACO, se recomienda el uso cíclico de progestágenos buscando inducir menstruaciones por deprivación. Esta alternativa incluye los progestágenos de uso continuo o dispositivos intrauterinos preferiblemente liberadores de levonorgestrel.〖^76,78〗 Ver tabla 3.
Metformina
Es la estrategia más usada para el manejo de la insulino resistencia en SOP. Actúa aumentando la sensibilidad de la insulina en hígado y músculo, incrementando la concentración de la proteína transportadora de hormonas sexuales, reduciendo la insulina circulante y la proteína C reactiva, e incrementando las lipoproteínas de alta densidad. También mejora los efectos del hiperandrogenismo al disminuir las concentraciones séricas de andrógenos circulantes y mejora las características metabólicas y el IMC de manera significativa en los grupos con sobrepeso y de alto riesgo. Los cambios en estilo de vida más el uso de metformina se asocian a un IMC más bajo, menor cantidad de tejido adiposo subcutáneo y mejoría en las alteraciones del ciclo menstrual.〖^58〗 La dosis inicial es de 500 mg c/8h vía oral; hasta una dosis máxima de 850 mg tres veces al día. Se utiliza, principalmente, en pacientes obesas, sin embargo, en dosis superiores a los 1500 mg por día se cree que aumentaría la tasa de ovulación y embarazo versus placebo.〖^76,79〗
En un estudio que comparó cuatro ensayos clínicos aleatorizados incluyendo 170 pacientes se concluyó que el tratamiento con ACOS resultó en una mejora modesta en la frecuencia del ciclo menstrual (diferencia de medias ponderada [DMP] = 0.27, P <.01, intervalo de confianza [IC] del 95% −0.33 a −0.21) y una reducción leve de las puntuaciones de acné (DMP = 0.3 , P = 0,02; IC del 95%: 0,05 a 0,55), mientras que la metformina resultó en una mayor reducción del IMC (DMP = −4.02, P <.01, IC del 95% −5.23 a −2.81) y se asoció con una disminución de la prevalencia de disglucemia (razón de riesgo: 0.41, P = .02, IC del 95% 0.19 a 0.86) y niveles mejorados de colesterol total y lipoproteínas de baja densidad. Ambas fueron similares en términos de impacto en el hirsutismo. De tal modo que la elección del tratamiento farmacológico a emplear en pacientes con SOP debe guiarse de manera individualizada.〖^80〗
Medidas contra la obesidad.
Ningún fármaco ha sido aprobado para el manejo del sobrepeso u obesidad en SOP, sin embargo, la terapia médica junto a intervenciones en el estilo de vida y la actividad física contribuyen a controlar esta afección.〖^58〗 La cirugía bariátrica puede ser una opción en pacientes con SOP + obesidad mórbida (IMC 40 kg/m2 o más, o 35 kg/m2 y la presencia de cualquier comorbilidad severa que pueda mejorar con la pérdida de peso) si las medidas estándar de reducción de peso han fallado.〖^81〗 En 2017 se publicó un metaanálisis en el cual la pérdida de peso inducida quirúrgicamente en mujeres con SOP y obesidad severa derivó en disminuciones importantes en los niveles séricos de testosterona total y libre, disminución significativa del hirsutismo y la mejoría en las alteraciones menstrual en hasta 53% y 96% respectivamente, logrando tasas de resolución de SOP del 96% (IC 95%, 88-100%).〖^2〗
Agentes anti androgénicos.
Se ha sugerido el uso de medicamentos como flutamida, finasteride y espironolactona para el tratamiento del hiperandrogenismo clínico en SOP. Aunque no se ha esclarecido de forma clara sus indicaciones se recomiendan cuando los ACOS están contraindicados o son poco tolerados. Se debe considerar su riesgo de teratogenicidad.〖^58,60〗
Estudios con flutamida demuestran que el bloqueo de la acción de los andrógenos puede restaurar la sensibilidad del generador de pulsos de GnRH a estrógenos y progestágenos en mujeres adultas con SOP. También sugieren que el reducir el exceso de secreción de andrógenos o el bloquear la acción de estos pueden lograr la regulación de la secreción ovárica de GnRH y ser parte de los regímenes terapéuticos destinados a establecer la ovulación cíclica en estas pacientes.〖^82〗
La espironolactona (SPA) a dosis de 100 a 200 mg diarios, administrados en 2 dosis divididas ha demostrado ser efectiva para el manejo de hirsutismo. Actúa antagónizando la aldosterona y compite con la Dihidrotestosterona (DHT) por unirse al receptor de andrógenos ejerciendo un bloqueo local de la actividad 5α-reductasa, compitiendo con los andrógenos para unirse a SHBG, bloqueando además la conversión de testosterona a DHT en las células de la papila dérmica y antagonizando el efecto androgénico de DHT en el folículo piloso. La SPA también disminuye los niveles de hormona liberadora de gonadotropina y LH, atenuando el efecto de LH sobre la esteroidogénesis de andrógenos. Puede inducir hipercalcemia, molestias en los senos, piel seca y ser teratogénico por lo que se recomienda en uso conjunto con ACO.〖^42,58〗
La Finasteride es un inhibidor de 5α Reductasa capaz de disminuir hasta en 50%-60% los niveles de DHT a dosis diarias de 5 mg. Se debe considerar su uso si otras medidas han sido ineficaces.〖^83〗
Inositol
Es un suplemento nutricional que mejora el papel de la insulina en la fisiopatología del SOP regularizando los ciclos menstruales, sin embargo, aún se considera una terapia experimental.〖^60〗 En una revisión sistemática Cochrane no se pudieron establecer conclusiones con respecto a inositol como sensibilizadores a la insulina, ya que ningún estudio informó resultados primarios.〖^84〗
Abordaje terapéutico en pacientes con deseos reproductivos
El clomifeno se considera tratamiento de primera línea en pacientes en quienes se haya establecido a través de estudios paraclínicos infertilidad anovulatoria con medición de progesterona en la mitad de la fase lútea del ciclo menstrual. Se inicia a dosis bajas (50 mg diarios durante 5 días por ciclo) y se aumenta gradualmente hasta alcanzar la dosis efectiva más baja que logre la ovulación. Esto implica una vigilancia estrecha sobre todo de los efectos adversos, el riesgo de embarazo múltiple e hiperestimulación ovárica.〖^45,47〗
El manejo con metformina muestra beneficios sobre la anovulación y su combinación con clomifeno se asocia a mayor éxito en la inducción de la ovulación.〖^84〗
Otra alternativa terapéutica para inducir la ovulación es el uso de Gonadotropinas exógenas como la FSH recombinante, con tasas de ovulación reportadas de hasta el 72 % y de embarazo de hasta el 45%. Sin embargo, estas terapias deben asumirse con cuidado al ser regímenes terapéuticos costosos y el riesgo de embarazos múltiples o síndrome de hiperestimulación ovárica.〖^3,57〗
Los medicamentos inhibidores de la aromatasa aumentan la FSH hipofisaria, reducen los niveles de estrógenos circulantes y han demostrado ser superiores al clomifeno en lograr nacimientos vivos.〖^57〗 La probabilidad de nacimiento vivo aumenta entre un 40 y un 60% con el letrozol en comparación al clomifeno.〖^58〗
Por último, los procedimientos quirúrgicos como el Drilling ovárico por laparoscopia, y la fertilización in vitro deben considerarse en pacientes con SOP. El Drilling ovárico por laparoscopia aún no cuenta con una técnica estandarizada para su ejecución con respecto a la fuente de energía, el número de punciones, la dosis y la duración por punción, o si uno o ambos ovarios deben tratarse; sin embargo, se ha asociado a reducción en la secreción ovárica de andrógenos y proteínas que resulta en un aumento de la secreción de LH y FSH. Después del procedimiento, el ovario responde mejor al estímulo por gonadotropinas endógenas lo que favorece el crecimiento de un folículo ovárico dominante y la ovulación. Se ha visto que producen ciclos ovulatorios en aproximadamente el 80% de las pacientes intervenidas por lo que debe considerarse como una herramienta útil en el abordaje de esta patología.〖^45,57,58〗
CONCLUSIÓN
El SOP es una enfermedad endocrino metabólica con una fisiopatología compleja que aún no se comprende del todo. Gracias a los avances en materia de investigación en los últimos años se puede entender mejor el impacto de esta enfermedad en la salud de mujeres en edad reproductiva. Su incidencia y prevalencia en ascenso en este grupo poblacional hace que sea indispensable conocer los aspectos básicos para su diagnóstico oportuno y abordaje terapéutico acorde a la clínica y características socioculturales de la mujer, logrando un impacto positivo en la calidad de vida de estas pacientes.
Bibliografía:
1. Azziz R, Carmina E, Dewailly D y cols. Position statement: Criteria for defining polycystic ovary syndrome as a predominantly hyperandrogenic syndrome: An androgen excess society guideline. J Clin Endocrinol Metab. 2006;91(11):4237–45.
2. Escobar-Morreale HF. Polycystic ovary syndrome: Definition, aetiology, diagnosis and treatment. Nat Rev Endocrinol. 2018;14(5):270–84.
3. Yau TTL, Ng NYH, Cheung LP, Ma RCW. Polycystic ovary syndrome: A common reproductive syndrome with long-term metabolic consequences. Hong Kong Med J. 2017;23(6):622–34.
4. Azziz R. Polycystic ovary syndrome: What’s in a name? J Clin Endocrinol Metab. 2014;99(4):1142–5.
5. Lizneva D, Suturina L, Walker W, Brakta S, Gavrilova-Jordan L, Azziz R. Criteria, prevalence, and phenotypes of polycystic ovary syndrome. Fertil Steril. 2016;106(1):6–15.
6. Azziz R, Carmina E, Chen Z y cols. Polycystic ovary syndrome. Nat Rev Dis Primers. 2016;2:1–18.
7. Charifson MA, Trumble BC. Evolutionary origins of polycystic ovary syndrome: An environmental mismatch disorder. Evol Med Public Health. 2019 Jan 1;2019(1):50–63.
8. Azziz R, Carmina E, Dewailly D y cols. Position statement: Criteria for defining polycystic ovary syndrome as a predominantly hyperandrogenic syndrome: An androgen excess society guideline. J Clin Endocrinol Metab. 2006;91(11):4237–45.
9. March WA, Moore VM, Willson KJ, Phillips DIW, Norman RJ, Davies MJ. The prevalence of polycystic ovary syndrome in a community sample assessed under contrasting diagnostic criteria. Hum Reprod. 2010;25(2):544–51.
10. The Rotterdam ESHRE/ASRM‐sponsored PCOS consensus workshop group. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome (PCOS) The Rotterdam ESHRE/ASRM-sponsored PCOS consensus workshop group. Hum Reprod. 2004;19(1):41–7.
11. Builes CA, Diaz I, Castañeda J, Pérez LE. Caracterización clínica y bioquímica de la mujer con Síndrome de Ovario Poliquístico. Rev Colomb Obstet Ginecol. 2006; 57(1), 36-44.
12. Conway G, Dewailly D, Diamanti-Kandarakis y cols. The polycystic ovary syndrome: a position statement from the European Society of Endocrinology. Eur J Endocrinol. 2014; 171(4), P1-P29.
13. Gorrindo T, Lu Y, Pincus S y cols. Lifelong menstrual histories are typically erratic and trending: A taxonomy. Menopause. 2007;14(1):74–88.
14. Joseph S, Barai RS, Bhujbalrao R, Idicula-Thomas S. PCOSKB: A knowledgebase on genes, diseases, ontology terms and biochemical pathways associated with polycystic ovary syndrome. Nucleic Acids Res. 2016;44(D1):D1032–5.
15. Barthelmess EK, Naz RK. Polycystic ovary syndrome: Current status and future perspective. Front Biosci (Elite Ed). 2014;6(1):104–19.
16. Torres KJ y, Torra LO. La genética detrás del Síndrome de Ovario Poliquístico, la enfermedad de la actualidad. MED UIS. 2017;30(2):9–10.
17. Lee H, Oh JY, Sung YA, Chung HW. A genetic risk score is associated with polycystic ovary syndrome-related traits. Hum Reprod. 2016;31(1):209–15.
18. Ajmal N, Khan SZ, Shaikh R. Polycystic ovary syndrome (PCOS) and genetic predisposition: A review article. Eur J Obstet Gynecol Reprod Biol X. 2019;8 (3).
19. Vink JM, Sadrzadeh S, Lambalk CB, Boomsma DI. Heritability of polycystic ovary syndrome in a Dutch twin-family study. J Clin Endocrinol Metab. 2006;91(6):2100–4.
20. Zhuo G, Ding Y, Feng G, Yu L, Jiang Y. Analysis of mitochondrial DNA sequence variants in patients with polycystic ovary syndrome. Arch Gynecol Obstet. 2012 Sep;286(3):653–9.
21. Zhang J, Bao Y, Zhou X, Zheng L. Polycystic ovary syndrome and mitochondrial dysfunction. Reprod Biol Endocrinol. 2019;17(1):1–15.
22. Ilie IR. Advances in PCOS Pathogenesis and Progression—Mitochondrial Mutations and Dysfunction. Adv Clin Chem. 2018. 86 127–155 p.
23. Xita N, Tsatsoulis A. Review: Fetal programming of polycystic ovary syndrome by androgen excess: Evidence from experimental, clinical, and genetic association studies. J Clin Endocrinol Metab. 2006; 91(5): 1660–6.
24. Francisca Concha C, Teresa Sir P, Recabarren SE, Francisco Pérez B. Epigenética del síndrome de ovario poliquístico. Rev Med Chil. 2017;145(7):907–15.
25. Joseph S, Shankar Barai R, Bhujbalrao R, Idicula-Thomas S. PCOSKB: A KnowledgeBase on genes, diseases, ontology terms and biochemical pathways associated with PolyCystic Ovary Syndrome. Nucleic Acids Res. 2016 ;44.
26. Casoni F, Malone SA, Belle M y cols. Development of the neurons controlling fertility in humans: New insights from 3D imaging and transparent fetal brains. Development. 2016;143(21):3969–81.
27. Rosenfield RL, Ehrmann DA. The Pathogenesis of Polycystic Ovary Syndrome (PCOS): The hypothesis of PCOS as functional ovarian hyperandrogenism revisited. Vol. 37, Endocrine Reviews. Endocr Rev; 2016; 37(5): 467–520.
28. Barnes RB, Rosenfield RL, Ehrmann DA y cols. Ovarian hyperandrogynism as a result of congenital adrenal virilizing disorders: evidence for perinatal masculinization of neuroendocrine function in women. J Clin Endocrinol Metab. 2019;79(5):1328–33.
29. Taylor AE, McCourt B, Martin KA y cols. Determinants of Abnormal Gonadotropin Secretion in Clinically Defined Women with Polycystic Ovary Syndrome. J Clin Endocrinol Metab 1997;82(7):2248–56.
30. Eagleson CA, Gingrich MB, Pastor CL y cols. Polycystic Ovarian Syndrome: Evidence that Flutamide Restores Sensitivity of the Gonadotropin-Releasing Hormone Pulse Generator to Inhibition by Estradiol and Progesterone. J Clin Endocrinol Metab. 2000;85(11):4047–52.
31. Dumesic DA, Abbott DH, Eisner JR, Goy RW. Prenatal exposure of female rhesus monkeys to testosterone propionate increases serum luteinizing hormone levels in adulthood. Fertil Steril, 1997; 67(1): 155-163.
32. Walters KA, Allan CM, Handelsman DJ. Androgen Actions and the Ovary. Biol Reprod. 2008; 1;78(3):380–9.
33. Candia FA. Consenso venezolano del síndrome de ovario poliquístico. Fisiopatología del síndrome de ovario poliquístico. Capítulo 4. 2016: p 45- 64
34. Franks S, Stark J, Hardy K. Follicle dynamics and anovulation in polycystic ovary syndrome. Hum Reprod Update. 2008;14(4):367–78.
35. Nelson VL, Legro RS, Strauss JF, McAllister JM. Augmented androgen production is a stable steroidogenic phenotype of propagated theca cells from polycystic ovaries. Mol Endocrinol. 1999;13(6):946–57.
36. Nelson VL, Qin KN, Rosenfield RL y cols. The biochemical basis for increased Testosterone production in theca cells propagated from patients with polycystic ovary syndrome. J Clin Endocrinol Metab. 2001;86(12):5925–33.
37. Ruddenklau A, Campbell RE. Neuroendocrine Impairments of Polycystic Ovary Syndrome. Endocrinology. 2019;160(10):2230–42.
38. Willis DS, Watson H, Mason HD, Galea R, Brincat M, Franks S. Premature response to luteinizing hormone of granulosa cells from anovulatory women with polycystic ovary syndrome: Relevance to mechanism of anovulation. J Clin Endocrinol Metab. 1998;83(11):3984–91.
39. Gorsic LK, Kosova G, Werstein B y cols. Pathogenic anti-Müllerian hormone variants in polycystic ovary syndrome. J Clin Endocrinol Metab. 2017;102(8):2862–72.
40. Shaw N, Rosenfield RL. Etiology and pathophysiology of polycystic ovary syndrome in adolescents. UpToDate. 2022
41. Shaaban Z, Khoradmehr A, Jafarzadeh Shirazi MR, Tamadon A. Pathophysiological mechanisms of gonadotropins- and steroid hormones-related genes in etiology of polycystic ovary syndrome. Iran J Basic Med Sci. 2019; 22(1): 3-16.
42. Meier RK. Polycystic Ovary Syndrome. Nurs Clin North Am. 2018; 53(3):407–20.
43. Diamanti-Kandarakis E, Papavassiliou AG. Molecular mechanisms of insulin resistance in polycystic ovary syndrome. Trends Mol Med. 2006; Jul;12(7):324-32
44. Stepto NK, Cassar S, Joham AE y cols. Women with polycystic ovary syndrome have intrinsic insulin resistance on euglycaemic-hyperinsulaemic clamp. Hum Reprod. 2013;28(3):777–84.
45. Wang J, Wu D, Guo H, Li M. Hyperandrogenemia and insulin resistance: The chief culprit of polycystic ovary syndrome. Life Sci. 2019; 231(1).
46. Yau TTL, Ng NYH, Cheung LP, Ma RCW. Polycystic ovary syndrome: A common reproductive syndrome with long-term metabolic consequences. Hong Kong Med J. 2017;23(6):622-34.
47. Witchel SF, Oberfield SE, Peña AS. Polycystic Ovary Syndrome: Pathophysiology, Presentation, and Treatment With Emphasis on Adolescent Girls. J Endocr Soc. 2019;3(8):1545–73.
48. O’Reilly MW, House PJ, Tomlinson. JW. Understanding androgen action in adipose tissue. J Steroid Biochem Mol Biol; 2014;143: 277–84.
49. Raperport C, Homburg R. The Source of Polycystic Ovarian Syndrome. Clin Med Insights Reprod Health. 2019;13:117955811987146.
50. Winnykamien I, Dalibón A, Knoblovits P. Síndrome de ovario poliquístico. Rev Hosp Ital B Aires. 2017; 37: 10-20.
51. Franks S. Diagnosis of polycystic ovarian syndrome: In defense of the Rotterdam criteria. J Clin Endocrinol Metab. 2006; 91(3):786–9.
52. Orrego, A. Acercamiento actualizado a la fisiopatología, clasificación y genética del síndrome de ovarios poliquísticos. Revista Colombiana de Endocrinología, Diabetes & Metabolismo. 2019; 6(2), 101-106.
53. Fauser BCJM, Tarlatzis BC, Rebar RW y cols. Consensus on women’s health aspects of polycystic ovary syndrome (PCOS): The Amsterdam ESHRE/ASRM-Sponsored 3rd PCOS Consensus Workshop Group. In: Fertility and Sterility. Elsevier Inc.; 2012.
54. Villacis S, Aguirre R, Gonzabay M, Lee A, Cuenca B, Sylvana. Criterios diagnósticos y tratamiento integral terapéutico del síndrome de ovarios poliquísticos. Rev Cubana Obstet Ginecol, 2017; 43(3), 173-181.
55. Echiburú B, Ladrón de Guevara A, Pereira C y cols. Clasificación de los fenotipos del síndrome de ovario poliquístico de acuerdo a los criterios de Rotterdam:¿ una condición estática o variable?. Rev Med Chile. 2014; 142(8), 966-974.
56. Adams JM, Taylor AE, Crowley WF, Hall JE. Polycystic ovarian morphology with regular ovulatory cycles: Insights into the pathophysiology of polycystic ovarian syndrome. J Clin Endocrinol Metab. 2004 Sep;89(9):4343–50.
57. Barbieri MDAERL. Diagnosis of polycystic ovary syndrome in adults - UpToDate [Internet]. Available from: https://www-uptodate-com.aure.unab.edu.co/contents/diagnosis-of-polycystic-ovary-syndrome-in-adults?search=polycystic ovary syndrome&source=search_result&selectedTitle=3~150&usage_type=default&display_rank=3
58. Teede H, Misso M, Costello M y cols. International evidence-based guideline for the assessment and management of polycystic ovary syndrome 2018. National Health and Medical Research Council (NHMRC). 2018. 1–198 p.
59. Ríos X, Vergara JI, Wandurraga EA, Rey JJ. Evaluación clínica del pelo corporal en una población de mujeres colombianas: determinación del punto de corte para el diagnóstico de hirsutismo. Biomédica. 2013; 33(3), 370-374.
60. Jacob S, Balen AH. How Will the New Global Polycystic Ovary Syndrome Guideline Change Our Clinical Practice? Clin Med Insights Reprod Heal. 2019;13:117955811984960.
61. Nölting M, Gulluzzo L, Pérez M y cols. Consenso sobre síndrome de ovario poliquístico. Fed Argentina Soc Obstet Y Ginecol [Internet]. 2011;10:69–76. Available from: http://www.fasgo.org.ar/archivos/consensos/ovario_poliq.pdf
62. Rosner W, Vesper H. Toward excellence in testosterone testing: A consensus statement. In: Journal of Clinical Endocrinology and Metabolism. Endocrine Society; 2010. p. 4542–8.
63. Zhu RY, Wong YC, Yong EL. Sonographic evaluation of polycystic ovaries. Vol. 37, Best Practice and Research: Clinical Obstetrics and Gynaecology. Elsevier Ltd; 2016. 25–37 p.
64. Ali HI, Elsadawy ME, Khater NH. Ultrasound assessment of polycystic ovaries: Ovarian volume and morphology; Which is more accurate in making the diagnosis?! Egypt J Radiol Nucl Med [Internet]. 2016;47(1):347–50. Available from: http://dx.doi.org/10.1016/j.ejrnm.2015.10.002
65. Lee H, Oh JY, Sung YA, Chung HW. A genetic risk score is associated with polycystic ovary syndrome-related traits. Hum Reprod. 2016 Jan 1;31(1):209–15.
66. Análisis del síndrome de ovario poliquístico: consideraciones de aproximación, estudios de laboratorio de detección, niveles hormonales [Internet]. [cited 2021 Nov 4].
67. Lim SS, Norman RJ, Davies MJ, Moran LJ. The effect of obesity on polycystic ovary syndrome: A systematic review and meta-analysis. Obes Rev. 2013;14(2):95–109.
68. Kataoka J, Larsson I, Björkman S, Eliasson B, Schmidt J, Stener‐Victorin E. Prevalence of polycystic ovary syndrome in women with severe obesity – Effects of a structured weight loss programme. Clin Endocrinol (Oxf). 2019; 91(6):750-758.
69. Jamil AS, Alalaf SK, Al-Tawil NG, Al-Shawaf T. A case-control observational study of insulin resistance and metabolic syndrome among the four phenotypes of polycystic ovary syndrome based on Rotterdam criteria Female Fertility. Reprod Health. 2015 Jan 16;12(1).
70. Ford ES. The metabolic syndrome and mortality from cardiovascular disease and all-causes: Findings from the National Health and Nutrition Examination Survey II Mortality Study. Atherosclerosis. 2004;173(2):307–12.
71. Richard Scott Lucidi M. Polycystic Ovarian Syndrome: Practice Essentials, Background, Etiology [Internet]. [cited 2021 Nov 4].
72. Khorshidi A, Azami M, Tardeh S, Tardeh Z. The prevalence of metabolic syndrome in patients with polycystic ovary syndrome: A systematic review and meta-analysis. Diabetes Metab Syndr Clin Res Rev. 2019 Jul;13(4):2747–53.
73. Carmina E, Legro RS, Stamets K, Lowell J, Lobo RA. Difference in body weight between American and Italian women with polycystic ovary syndrome: influence of the diet. Hum Reprod. 2003 Nov [cited 2021 Nov 4];18(11):2289–93.
74. Nandi A, Chen Z, Patel R, Poretsky L. Polycystic Ovary Syndrome KEYWORDS Polycystic ovary syndrome Risk factors Long-term effects Insulin resistance: key points. Endocrinol Metab Clin N Am 2014;43:123–47.
75. Pall M, Azziz R, Beires J, Pignatelli D. The phenotype of hirsute women: a comparison of polycystic ovary syndrome and 21-hydroxylase-deficient nonclassic adrenal hyperplasia. Fertil Steril. 2010 Jul;94(2):684–9.
76. Salazar Robayo, M. F. Síndrome de ovario poliquístico: Importancia de la presentación clínica para el diagnóstico. 2015; 9-38
77. Jacob S, Balen AH. How Will the New Global Polycystic Ovary Syndrome Guideline Change Our Clinical Practice? Clin Med Insights Reprod Heal. 2019;13:117955811984960.
78. Ortiz-Flores AE, Luque-Ramírez M, Escobar-Morreale HF. Polycystic ovary syndrome in adult women. Med Clin (Barc) 2019;152(11):450–7.
79. Del Castillo Tirado FJ., Ortega AJM, Del Castillo Tirado RA. Guía de práctica clínica de síndrome de ovario poliquístico. Arch Med. 2014; 10(2), 1-14.
80. Al Khalifah RA, Florez ID, Dennis B, Thabane L, Bassilious E. Metformin or oral contraceptives for adolescents with polycystic ovarian syndrome: A meta-analysis. Pediatrics. 2016; 137(5)
81. Grigoryan OR, Zhemaite NS, Volevodz NN, Andreeva EN, Melnichenko GA, Dedov II. Long-term consequences of polycystic ovary syndrome. Ter Arkh. 2017;89(10):75–9.
82. Eagleson CA, Gingrich MB, Pastor CL y cols. Polycystic Ovarian Syndrome: Evidence that Flutamide Restores Sensitivity of the Gonadotropin-Releasing Hormone Pulse Generator to Inhibition by Estradiol and Progesterone. J Clin Endocrinol Metab. 2000; 85(11):4047–52.
83. Goodman NF, Cobin RH, Futterweit W, Glueck JS, Legro RS, Carmina E. American association of clinical endocrinologists, American college of endocrinology, and androgen excess and pcos society disease state clinical review: Guide to the best practices in the evaluation and treatment of polycystic ovary syndrome. Endocr Pract. 2015; 21(11):1291-300.
84. Morley LC, Tang T, Yasmin E, Norman RJ, Balen AH. Insulin-sensitising drugs (metformin, rosiglitazone, pioglitazone, D-chiro-inositol) for women with polycystic ovary syndrome, oligo amenorrhoea and subfertility. Cochrane Database Syst Rev. 2017; 29;11(11)
ANEXOS
LISTADO DE TABLAS
- Cuadro 1. Genes involucrados en el desarrollo de SOP.
- Cuadro 2. Criterios para el diagnóstico de adultos.
- Cuadro 3. Fármacos usados en el tratamiento de SOP.
LISTADO DE FIGURAS.
- Figura 1. Disfunción mitocondrial asociada a SOP.
- Figura 2. Fisiopatología del SOP.
- Figura 3. Criterios específicos para el diagnóstico de SOP.
- Figura 4. Abordaje de paciente con SOP
Cuadro 1. Genes involucrados en el desarrollo de SOP.
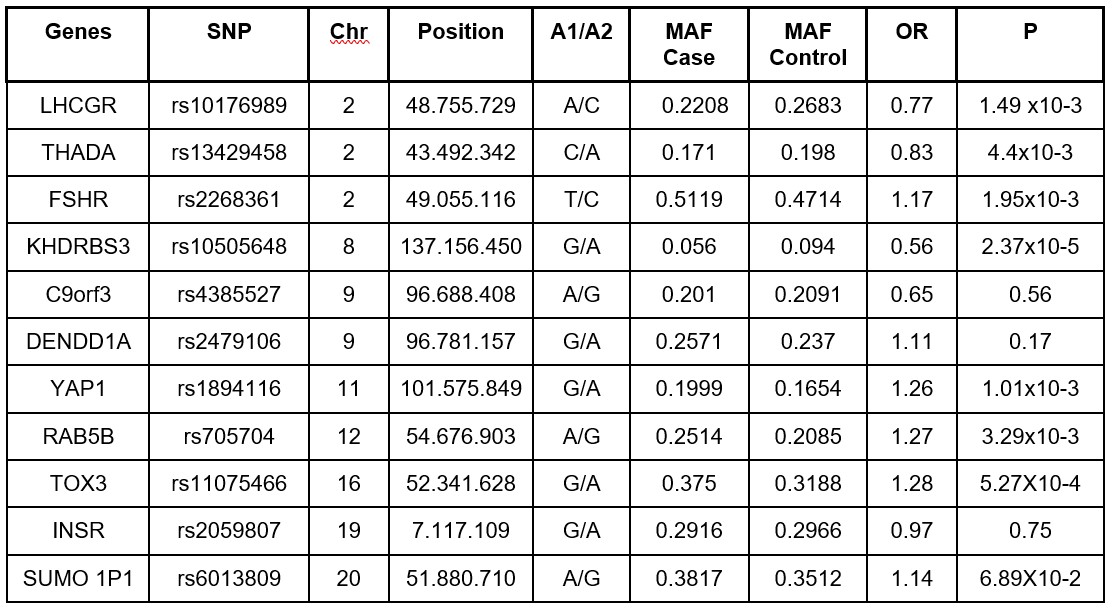
C9orf3, chromosome 9 open reading frame 3; DENDD1A, DENN/MADD domain containing A1; FSHR, FSH receptor; INSR, insulin receptor; KHDRBS3, KH domain containing, RNA binding, signal transduction-associated 3; LHCGR, LH/CG receptor, RAB5B, remember RAS oncogene family; SUMO1P, SUMO1 pseudogene 1; THADA, thyroid adenoma associated; TOX3, TOX high mobility group box family member 3; YA1, Yes-associated protein 1.
The association of the 11 SNPs with PCOS was estimated using a logistic regression model, and the Bonferroni correction was used to control for multiple testing (P<0.05/11= 0.0045).
MAF, minor allele frequency; OR, odds ratio, Chr, chromosome.
Tomado de: Lee H, Oh JY, Sung YA, Chung HW. A genetic risk score is associated with polycystic ovary syndrome-related traits. Hum Reprod. 2016;31(1):209–15
Cuadro 2. Criterios para el diagnóstico de adultos.
Cuadro 3. Fármacos usados en el tratamiento de SOP.
|
Grupo farmacológico |
Fármacos |
Dosis/Modo de administración |
|
Protección endometrial y control del hiperandrogenismo |
||
|
Anticonceptivos orales combinados |
||
|
Estrógenos sintéticos + progestágenos de perfil antiandrógeno |
Estrógeno sintético: etinilestradiol 0.02-0.035 mg Progestágeno: acetato de ciproterona, drospirenona, clormadinona |
Administración diaria de 1 comprimidos activos por 21 días y 7 días de descanso, o administración diaria de 1 comprimido por 28 días (21 activos y 7 con placebo) |
|
Estrógenos sintéticos + progestágenos de baja afinidad por el receptor androgénico |
Progestágeno: dienogest*, norgestimato*, desogestrel, levonorgestrel, gestodeno |
|
|
Estrógenos naturales + progestágenos |
Estrógeno natural: valerato de estradiol Progestágeno: acetato de ciproterona, dienogest, norgestrel |
Administración diaria de 28 comprimidos (21 activos + 7 con placebo)
|
|
Anillo vaginal** |
Estrógeno sintético: etinilestradiol: 0,015 mg Progestágeno: etonogestrel: 0,12 mg |
Mantener el anillo por 3 semanas, descansar una semana y colocar nuevo anillo vaginal |
|
Progestágenos cíclicos |
||
|
Progesterona |
Progesterona micronizada |
200 mg/día/ 10 día |
|
Acetato de medroxiprogesterona |
10 mg/día/ 10 días |
|
|
Progestágenos contínuos |
||
|
Vía oral |
Desogestrel, levonorgestrel |
|
|
Implante subcutáneo |
levonorgestrel 75 mg |
Duración hasta 5 años |
|
Dispositivo intrauterino |
levonorgestrel (0,02 mg de liberación continua) |
Durante hasta 5 años |
|
Antiandrógenos** |
||
|
Antagonistas del receptor de andrógenos |
Acetato de ciproterona |
50 -100 mg los 10 primeros días del ciclo |
|
Antagonistas del receptor de mineralocorticoides*** |
Espironolactona |
100 -200 mg/día |
|
Inhibidores de 5-alfa-reductasa*** |
Finasteride Dutasteride |
5 mg/día 0,15 -0,5 mg/día |
|
Otros fármacos para el abordaje del hirsutismo |
||
|
Inhibidores de la ornitinadecarboxilasa |
Eflornitina 0,15% crema de uso tópico |
Aplicar 2 veces al día en región facial |
* Se asocian con menor riesgo de trombosis venosa
** Debe utilizarse siempre un método anticonceptivo eficaz dado el riesgo de feminización de un feto masculino en caso de embarazo
*** Son utilizados fuera de ficha técnica
Tomado de Ortiz-Flores AE, Luque-Ramírez M, Escobar-Morreale HF. Polycystic ovary syndrome in adult women. Med Clin (Barc) [Internet]. 2019;152(11):450–7. Available from: https://doi.org/10.1016/j.medcli.2018.11.019
Figura 1. Disfunción mitocondrial asociada a SOP.
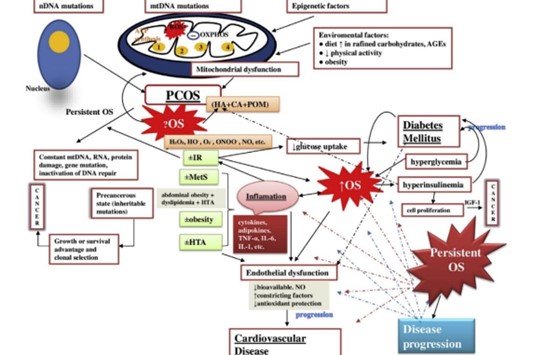
Tomado de Ilie IR. Advances in PCOS Pathogenesis and Progression—Mitochondrial Mutations and Dysfunction [Internet]. Vol. 86, Advances in Clinical Chemistry. Elsevier Ltd; 2018. 127–155 p.
Figura 2. Fisiopatología del SOP.
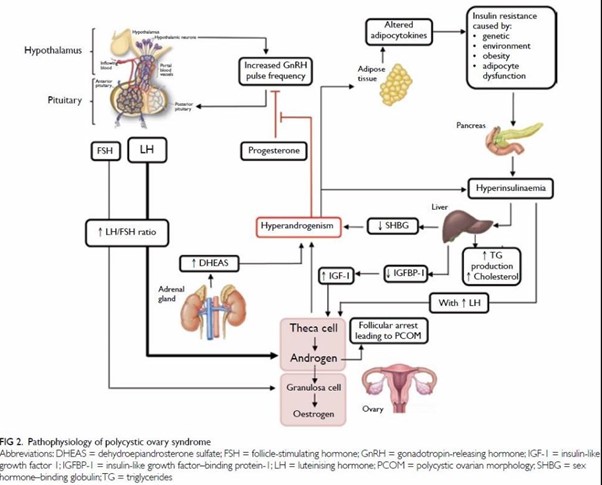
Tomado de: Yau TTL, Ng NYH, Cheung LP, Ma RCW. Polycystic ovary syndrome: A common reproductive syndrome with long-term metabolic consequences. Hong Kong Med J. 2017;23(6):622–34
Figura 3. Criterios específicos para el diagnóstico de SOP.
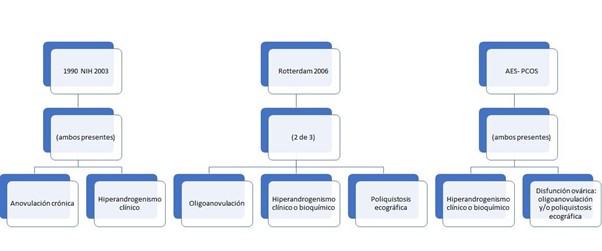
Figura 4. Abordaje de paciente con SOP.

Manejo inicial del paciente con síndrome de ovario poliquístico. Es importante realizar una historia clínica completa, que incluya una valoración del ritmo menstrual de cada paciente, del despistaje de signos y síntomas relacionados con hiperandrogenismo y la solicitud de pruebas complementarias orientadas al establecer el diagnóstico del SOP y al despistaje de otras enfermedades que puedan causar un cuadro clínico similar. Una vez realizado el diagnóstico debe establecer el riesgo metabólico del paciente, sobre todo en aquellos fenotipos que asocien hiperandrogenismo y disfunción ovulatoria.
4A: 4-Androstendiona; DHEAS: sulfato de dehidroepiandrosterona; ETV: enfermedad tromboembólica venosa; HSCNC: hiperplasia suprarrenal congénita no clásica; MAPA: monitorización ambulatoria de la presión arterial; SHBG: globulina transportadora de hormonas sexuales.
*En caso de disfunción ovulatoria e hiperandrogenismo clínico y/o bioquímico esta prueba puede omitirse.
** Valorar esta prueba, especialmente en pacientes con exceso de peso.
Tomado de (80) Ortiz-Flores AE, Luque-Ramírez M, Escobar-Morreale HF. Polycystic ovary syndrome in adult women. Med Clin (Barc) [Internet]. 2019;152(11):450–7. Available from: https://doi.org/10.1016/j.medcli.2018.11.019
1. Residente de Ginecología & Obstetricia de la Universidad Autónoma de Bucaramanga. Colombia.
2. Especialista en Ginecología & Obstetricia de la Universidad Industrial de Santander, Docente titular de la Universidad Autónoma de Bucaramanga. Colombia.
3. Estudiante V año de medicina, Facultad de Ciencias de la Salud, Universidad Autónoma de Bucaramanga.