Diagnóstico genético prenatal en restricción de crecimiento fetal temprano
Autores:
Sappa Cynthia Soledad1, González Gabelloni Veronica2, Rodríguez Analia2, Godoy Jesica Romina1, Lovagnini Frutos Guadalupe1, Petracchi Florencia2, Igarzábal Maria Laura2.
Introducción
La evaluación del crecimiento fetal es uno de los objetivos clave de la atención prenatal. El compromiso del crecimiento fetal se asocia con un mayor riesgo de mortalidad y morbilidad perinatal. Asimismo, se asocia a un mayor riesgo de enfermedades no transmisibles en la edad adulta, como hipertensión, síndrome metabólico, resistencia a la insulina, diabetes mellitus tipo 2 y enfermedad cardiovascular (1).
La Restricción del Crecimiento Fetal (RCF), también conocida como Restricción del Crecimiento Intrauterino (RCIU), es la imposibilidad por parte del feto de alcanzar un crecimiento acorde a su potencial biológico. Actualmente, se define como la presencia de un peso fetal estimado o una circunferencia abdominal por debajo del percentil 3, o velocidad de crecimiento alterada, o bien, un peso fetal estimado del percentil 10 asociado a Doppler fetal o uterino anormal (2).
Se ha sugerido que la RCF debe clasificarse, según la edad gestacional en el momento del diagnóstico, en RCF de inicio temprano (< 32 semanas) y RCF de inicio tardío (≥ 32 semanas). El fundamento de esta clasificación se basa en las diferencias entre estos dos fenotipos de RCF en términos de gravedad, historia natural, hallazgos Doppler, asociación con complicaciones hipertensivas, hallazgos placentarios y manejo. La RCF de inicio temprano tiene una prevalencia de 0.5%–1 %, suele ser más grave y es más probable que se asocie con un Doppler anormal de la arteria umbilical que con una RCF de inicio tardío. La patología placentaria subyacente es frecuentemente similar a la observada en los casos de preeclampsia de inicio temprano (3).
Además de alteraciones de la placentación, otras causas de RCF de inicio temprano incluyen exposición ambiental a agentes tóxicos, infecciones congénitas o anomalías genéticas. Dentro de este último grupo encontramos tanto aneuploidías como síndromes de microdeleción/microduplicación y patologías monogénicas. Es por este motivo que distintas sociedades, incluyendo el Colegio Americano de Obstetricia y Ginecólogia (ACOG) y el Royal College de Obstetricia y Ginecologia (RCOG) recomiendan ofrecer estudios de diagnóstico genético prenatal en casos de RCF de inicio temprano, sobre todo en presencia de anomalías estructurales (4,5).
El objetivo del siguiente trabajo es describir los resultados de diagnóstico genético prenatal en una serie de fetos con hallazgos ecográficos compatibles con restricción de crecimiento fetal temprano evaluados en un centro de derivación de tercer nivel.
Material y Métodos
Entre julio de 2013 y enero de 2022 se realizó un estudio retrospectivo observacional sobre pacientes derivadas a la Sección de Genética del CEMIC con diagnóstico de RCF temprana.
Se consideraron los criterios diagnósticos de RCF temprana establecidos por la Sociedad Internacional de Ultrasonido en Obstetricia y Ginecología (ISUOG) (2):
- Peso fetal estimado o circunferencia abdominal <p 3, o Ausencia de Flujo de Fin de diástole en la Arteria Umbilical (FFDA-AU)
- PFE o CA < p10 asociado a Doppler anormal (IP de Arterias Uterinas > p95 o IP de Arteria Umbilical > p95)
- EG < 32 semanas
Los casos incluidos en el trabajo se dividieron en tres grupos: aislados, asociados a otras malformaciones ecográficas y con sospecha de displasia esquelética.
Se realizó asesoramiento sobre diagnóstico y pronóstico en cada caso, y se ofreció la posibilidad de realizar un estudio invasivo para diagnóstico genético prenatal.
Según la edad gestacional y accesibilidad de cada caso, se tomó una muestra de vellosidades coriales o de líquido amniótico bajo guía ecográfica y se la procesó según el protocolo de rutina del laboratorio de CEMIC para cariotipo con bandeo G. Todas las muestras de cariotipo fueron procesadas en nuestra institución, salvo un caso en el que se realizó cariotipo postnatal en un laboratorio externo.
Asimismo, se ofreció la posibilidad de realizar estudios de microarray. En caso de que la paciente aceptara realizar dicho estudio, en parte de la muestra se realizó paralelamente PCR cuantitativa fluorescente (QF-PCR) para diagnóstico rápido de aneuploidías de los cromosomas 21, 18, 13, X e Y. Para la técnica de QFPCR se utilizó el reactivo ANEUFAST, equipo secuenciador ABI PRISM 310 Genetic Analayzer.
En aquellos casos en los que el resultado de QF-PCR fue normal, se envió muestra en fresco a fin de realizar microarray al laboratorio Baylor Miraca, Houston, Texas. Dicho laboratorio utilizó una plataforma de 400k que incluía sondas de SNP para la detección de disomía uniparental (UPD), consanguinidad y triploidía. En pacientes que accedieron a realizar paneles multigénicos o exoma se utilizó ADN extraído del cultivo y se envió al laboratorio Prevention Genetics para su análisis.
Se contactó individualmente al obstetra tratante en cada caso con el objetivo de obtener información sobre la evolución perinatal.
El objetivo primario fue evaluar la asociación de RCF temprana con alteraciones del cariotipo, CNVs y variantes patogénicas en genes únicos. Los objetivos secundarios fueron evaluar los hallazgos ecográficos asociados (anomalías estructurales y óseas) y la evolución del embarazo.
Resultados
La mediana de edad materna fue de 35 años (21-49 años) y la mediana de edad gestacional al momento de la derivación fue de 23,5 semanas (15-32 semanas).
- ESTUDIOS INVASIVOS
- CARIOTIPO FETAL
De un total de 38 casos de RCF tempranas evaluados, el 29% (11/38) fueron aislados, 50% (19/38) asociados a otras malformaciones y 21% (8/38) con sospecha de displasia esquelética ( Gráfico 1).
El 79% (30/38) de las pacientes realizaron cariotipo fetal, presentando el 63% (19/30) un resultado euploide y el 37% (11/30) aneuploide (Gráfico 1).
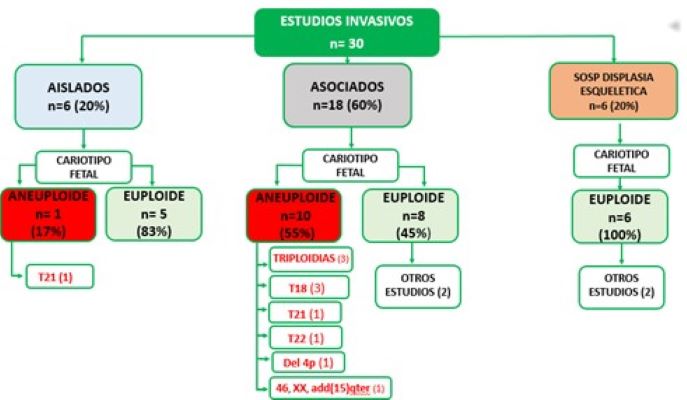
De las 30 pacientes que realizaron estudios invasivos, el 20% (6/30) fueron RCF aislados, presentando un caso de trisomía 21. Un 60% ( 18/30) estaban asociados a otros hallazgos ecográficos, de los cuales el 55% (10/18) presentaron un resultado aneuploide, observándose tres triploidias, una trisomía 21, tres trisomías 18, una trisomía 22, una deleción del brazo corto del cromosoma 4 y un material adicional de origen desconocido en el cromosoma 15. El 20% (6/30) presentaron sospecha de displasia esquelética, obteniéndose en todos los casos un cariotipo euploide ( Gráfico 1 y 2).
Gráfico 1: Resultados.
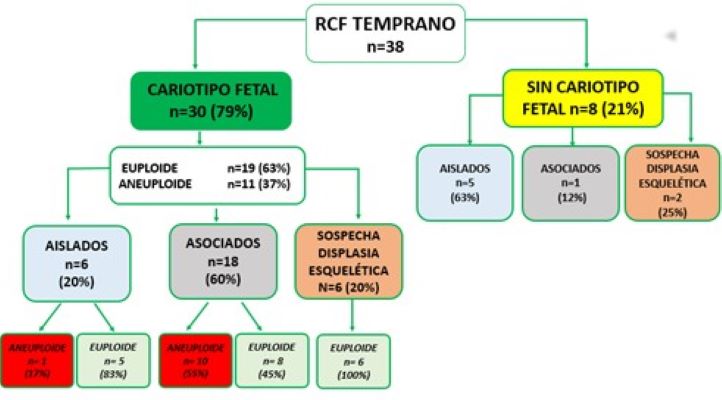
Gráfico 2: Resultados de cariotipo.
- ESTUDIOS MOLECULARES
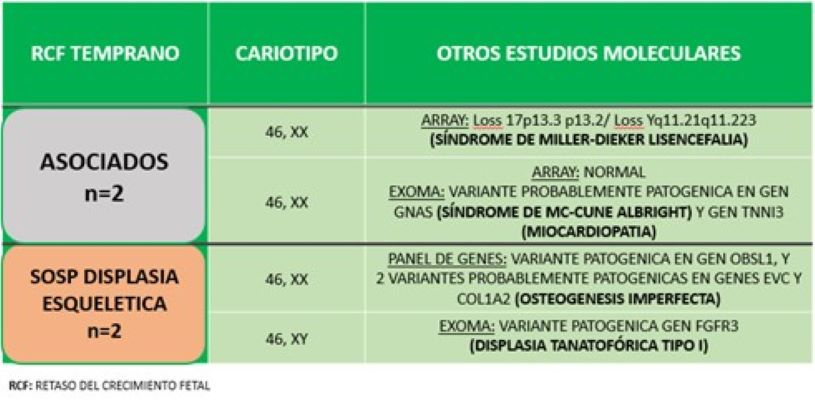
El 21% (4/19) de las pacientes con cariotipo fetal euploide decidió continuar con otro estudio genético, entre ellos un microarray, dos exomas y un panel multigénico. Como puede observarse en la Tabla 3, en los casos asociados se diagnosticó un Síndrome de Miller- Dieker Lisencefalia y un Síndrome MC-Cune Albright con una variante patogénica en el gen TNNI3 relacionado con miocardiopatía. En los dos casos con sospecha de displasia esquelética se diagnosticó una Osteogénesis imperfecta y una Displasia Tanatofórica tipo I, respectivamente (Tabla 3).
Tabla 3: RCF temprana con cariotipo normal y otros estudios moleculares.
2) EVOLUCIÓN
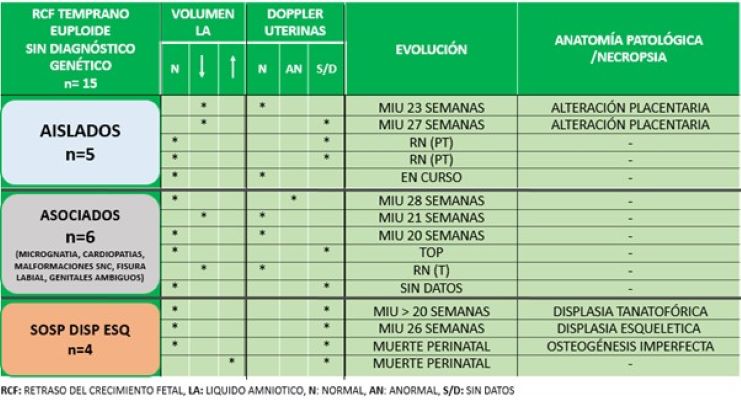
De las 15 pacientes con cariotipo fetal euploide que no continuaron con más estudios, se observó una evolución desfavorable en el 60% (9/15) de los casos. En la Tabla 4 puede observarse la información recabada sobre hallazgos ecográficos (líquido amniótico, Doppler de arterias uterinas), evolución y anatomía patológica/necropsia en cada grupo. En los 5 casos aislados, dos de ellos evolucionaron con muerte intrauterina (MIU), los cuales estaban asociados a oligoamnios y alteración placentaria en la anatomía patológica. De los 6 casos de RCF temprana con hallazgos asociados, 3 evolucionaron con MIU (uno de ellos con Doppler anormal de las arterias uterinas y otro con oligoamnios). Los cuatro casos de sospecha de displasia esquelética presentaron una evolución desfavorable (dos MIU y dos muertes perinatales), presentando uno de ellos polihidramnios. Tres pacientes realizaron necropsia cuyos resultados informaron una Displasia Tanatofórica, una Osteogénesis Imperfecta y una displasia esquelética que no se logró categorizar. (Tabla 4)
Tabla 4: RCF temprano euploide sin diagnóstico genético.
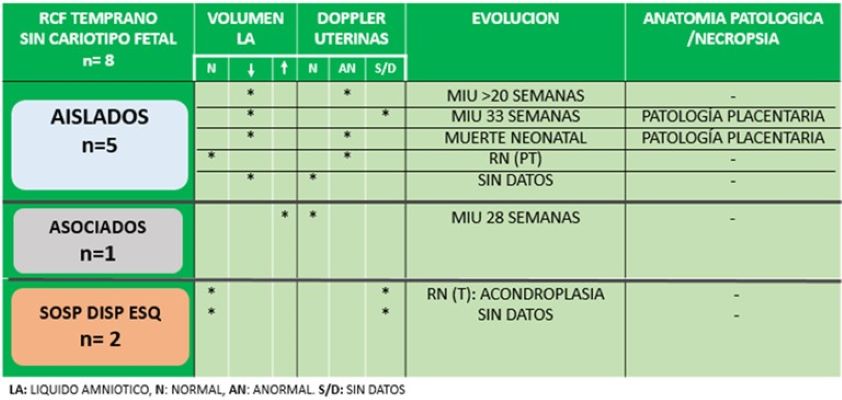
El 21% (8/38) de las pacientes no realizaron diagnóstico prenatal invasivo (cinco casos aislados, un caso asociado y dos casos con sospecha de displasia esquelética). El 50% (4/8) presentaron una evolución desfavorable. En la Tabla 5 se observa que de los cinco casos aislados sin cariotipo fetal, en tres de ellos se confirmó una evolución desfavorable ( dos MIU y una muerte neonatal). Los tres casos se asociaron con oligoamnios y dos de ellos además presentaron Doppler anormal de la arterias uterinas. En el caso de RCF asociada, se observó una MIU a las 28 semanas con polihidramnios y Doppler anormal de las arterias Uterinas. En relación con los dos casos de displasia esquelética, en uno de ellos se accedió a datos de la evolución postnatal, presentando una acondroplasia.
Tabla 5: RCF temprano sin cariotipo fetal.
Discusión
En este estudio retrospectivo que incluyó 38 fetos con diagnóstico de RCF de inicio temprana se observó una anomalía genética en aproximadamente la mitad de los casos, así como un alto porcentaje de casos con muerte intrauterina o perinatal.
Si bien esta serie de casos es demasiado pequeña como para sacar conclusiones definitivas sobre el diagnóstico genético en restricción de crecimiento fetal temprana, se pudieron obtener resultados concisos.
De acuerdo a lo reportado en la literatura, se estima que, globalmente, la RCF temprana se asocia a cariotipo fetal anormal en alrededor del 20% (6,7). A su vez, se observa aneuploidía fetal en aproximadamente 6% de los casos de RCF aislada (8) y en 30% de los casos en los que se observan otros hallazgos ecográficos asociados (9). En el presente trabajo se observó una mayor asociación con cariotipo fetal anormal, tanto en el grupo de RCF aislada como asociada. Posiblemente esto se deba al reducido número de casos incluidos en el estudio. Conforme a lo publicado por otros autores (11), las anomalías cromosómicas más frecuentemente detectadas fueron trisomía 18 y triploidía. En consonancia con lo esperado, en la totalidad de los casos con sospecha de displasia esquelética, el cariotipo fetal resultó normal.
Se estima que el microarray tiene un rédito diagnóstico adicional con respecto al cariotipo de hasta el 6% en RCF temprana aislada y en un 10% en las restricciones asociadas (12). En cuanto a la secuenciación exómica, se observó que aumenta el rédito diagnóstico por encima del microarray en un 4% (13). Desafortunadamente, el número de pacientes con cariotipo fetal normal que realizó estudios adicionales no fue suficiente para evaluar el rédito diagnóstico de estas técnicas moleculares en nuestro estudio. Sin embargo, cabe destacar que en los 4 casos con cariotipo fetal euploide en los que se realizaron estudios moleculares adicionales, fue factible arribar a un diagnóstico etiológico. De esta manera, se diagnosticó Síndrome de Miller-Dieker lisencefalia y Síndrome de Mc-Cune Albright en dos fetos con restricción de crecimiento asociada, respectivamente. Por otro lado, se detectó osteogénesis imperfecta y displasia tanatofórica tipo I en dos casos con sospecha de displasia esquelética.
En nuestra serie de casos se observó una evolución desfavorable, con muerte intrauterina o perinatal en una alta proporción de los fetos euploides con restricción de crecimiento sin diagnóstico genético, que alcanzó un 40% de los casos aislados, la mitad de los asociados y la totalidad de aquellos con sospecha de displasia esquelética. Asimismo, también se observó una evolución desfavorable tanto en los casos de RCF aislada como asociada que no realizaron estudios de diagnóstico prenatal. Estas cifras resultan superiores a las reportadas en la literatura, que oscilan entre el 5 y 14% (9, 10). En los 4 casos de RCF temprana aislada en los que se cuenta con anatomía patológica se observaron signos compatibles con patología placentaria.
Las limitaciones del presente trabajo incluyen el número reducido de casos incluidos, así como el pequeño porcentaje de pacientes con cariotipo fetal normal que accedieron a realizar otros estudios moleculares. Además, no se cuenta con información de la evolución en la totalidad de los casos.
En conclusión, se puede plantear que ante el hallazgo de restricción de crecimiento fetal temprana se justifica realizar estudio prenatal invasivo para cariotipo fetal, sobre todo en aquellos casos con malformaciones asociadas. De ser posible y dependiendo de cada situación clínica, considerar ofrecer microarray y almacenamiento de ADN para futuros estudios moleculares.
Referencias Bibliográficas
- Lees CC, Stampalija T, Baschat A, da Silva Costa F, et al. ISUOG Practice Guidelines: diagnosis and management of small-for-gestational-age fetus and fetal growth restriction. Ultrasound Obstet Gynecol. 2020 Aug;56(2):298-312.
- Salomon LJ, Alfirevic Z, Da Silva Costa F, Deter RL, et al. ISUOG Practice Guidelines: ultrasound assessment of fetal biometry and growth. Ultrasound Obstet Gynecol. 2019 Jun;53(6):715-723.
- Melamed N, Baschat A, Yinon Y, Athanasiadis A, et al. FIGO (international Federation of Gynecology and obstetrics) initiative on fetal growth: best practice advice for screening, diagnosis, and management of fetal growth restriction. Int J Gynecol Obstet. 2021 Mar;152 Suppl 1(Suppl 1):3-57.
- American College of O. Gynecologists. ACOG practice bulletin no.134: fetal growth restriction. Obstet Gynecol. 2013;121(5):1122- 1133.
- (RCOG) RCoOaG. The investigation and management of the small for gestational age fetus. London (UK): Royal College of Obstetricians and Gynaecologists (RCOG) (Green-Top guideline; no 31). 2013
- Meler, E., Sisterna, S., & Borrell, A. (2019). Genetic Syndromes Associated with Isolated Fetal Growth Restriction. Prenatal Diagnosis.
- Nowakowska BA, Pankiewicz K, Nowacka U, Niemiec M, Kozłowski S, Issat T. Genetic Background of Fetal Growth Restriction. Int J Mol Sci. 2021 Dec 21;23(1):36.
- Peng R, Yang J, Xie HN, Lin MF, Zheng J. Chromosomal and subchromosomal anomalies associated with small gestational age fetuses with no additional structural anomalies. Prenat Diagn. 2017 Dec;37(12):1219-1224.
- Dall'Asta A, Girardelli S, Usman S, Lawin-O'Brien A, et al. Etiology and perinatal outcome of periviable fetal growth restriction associated with structural or genetic anomaly. Ultrasound Obstet Gynecol. 2020 Mar;55(3):368-374.
- Lees C, Marlow N, Arabin B, Bilardo CM, et al. Perinatal morbidity and mortality in early-onset fetal growth restriction: cohort outcomes of the trial of randomized umbilical and fetal flow in Europe (TRUFFLE). Ultrasound Obstet Gynecol. 2013 Oct;42(4):400-8.
- Snijders RJ, Sherrod C, Gosden CM, Nicolaides KH. Fetal growth retardation: associated malformations and chromosomal abnormalities. Am J Obstet Gynecol. 1993 Feb;168(2):547-55
- Borrell A, Grande M, Pauta M, Rodriguez-Revenga L, Figueras F. Chromosomal Microarray Analysis in Fetuses with Growth Restriction and Normal Karyotype: A Systematic Review and Meta-Analysis. Fetal Diagn Ther. 2018;44(1):1-9.
- Mellis R, Oprych K, Scotchman E, Hill M, Chitty LS. Diagnostic yield of exome sequencing for prenatal diagnosis of fetal structural anomalies: A systematic review and meta-analysis. Prenat Diagn. 2022 May;42(6):662-685.
1. Residente Genética. CEMIC
2. Médica Genetista. CEMIC