Rol de la ecocardiografía materna y fetal en pacientes con diabetes gestacional
Autores:
Jesica Aguilera1, José Ochoa2, Héctor Lucchini3, Marietta Charakida4, Kypros Nicolaides5, Carolina Fux-Otta6.
Resumen
Objetivo: Evaluar la función cardiovascular materno-fetal del tercer trimestre en mujeres con diagnóstico de diabetes gestacional (DG).
Material y Método: Diseño: estudio prospectivo de cohorte. Población: embarazadas entre 18 y 40 años, cursando 35-37 semanas de gestación de embarazos únicos y espontáneos con diagnóstico de DG (Criterio ALAD-SAD) y grupo control (embarazos sin complicaciones). Fueron excluidas aquellas con antecedentes de enfermedad cardiovascular previa, desórdenes hipertensivos del embarazo actual o previos, enfermedad tiroidea no tratada y embarazos con anomalías fetales estructurales o diagnóstico de aneuploidías.
Luego de firmar el consentimiento informado y realizar la ultrasonografía fetal de rutina de tercer trimestre se realizaron las mediciones cardíacas maternas y fetales siguiendo las directrices de las guías de la Sociedad Americana de Ecocardiografìa.
Resultados: se incluyeron 161 mujeres con diagnóstico de DG y 483 mujeres con embarazos sin complicaciones. Las mujeres con DG, en comparación con los controles, eran mayores (34 ±5,5, SD 5,3 vs. 32,5 SD 4,8 años, p<0,001), tenían mayor índice de masa corporal (31,3 SD 5,8 vs 28,6 SD 4,4 kg/m2, p<0,001), presentaron menor aumento de peso durante el embarazo (8,3 IQR 4,8,11 vs 10,8 IQR 8,2,13,5 kg, p<0,001) y recién nacidos con menor peso al nacer (p<0,001). Realizando un análisis multivariable, teniendo en cuenta las diferencias en las características maternas y el peso fetal, las madres con DG tenían índices funcionales diastólicos y sistólicos del ventrículo izquierdo (onda Doppler tisular sistólica (s)) más bajos en comparación con los controles (9,5 -8,4/10,6- vs 9,9 -8,8/11- p<0,01 para ambos). Estos cambios cardíacos observados no cumplían con los criterios para la disfunción cardíaca clínica. No se observaron diferencias en los índices hemodinámicos (gasto cardíaco y resistencia vascular periférica) y la masa ventricular izquierda entre los grupos.
Los fetos de madres con DG presentaron corazones más globulares con un aumento en el índice de esfericidad del ventrículo derecho e izquierdo (derecho 0,62 VS. 0,58; izquierdo 0,53 vs. 0,51 p<0,001 para ambos) y reducción de los índices funcionales sistólicos longitudinales globales del ventrículo derecho e izquierdo ( derecho -16,6 vs -19,1; izquierdo -19,7 vs. -20,7 p<0,001 para ambos).
En el grupo DMG, 54 (33,5%) mujeres fueron tratadas solo con dieta, 52 (33,3%) recibieron metformina, 17 (10,6%) insulina y 38 (23,6%) ambos metformina e insulina. Solo 16 (9,1%) mujeres presentaron hemoglobina glicosilada con mediciones superiores al 6% durante el embarazo.
Conclusiones: La ecocardiografía del tercer trimestre en mujeres con diagnóstico de DG demuestra cambios cardíacos subclínicos en el binomio madre-feto. Futuros estudios con el seguimiento de los hijos de madres con diabetes gestacional serán necesarios para confirmar si estos hallazgos se correlacionan con mayor riesgo cardiovascular y persisten en el período postparto.
El efecto de la DG en el corazón materno y fetal fue diferente y no hubo una asociación clara entre las alteraciones observadas en ambos.
Introducción
La diabetes mellitus gestacional (DMG) es la complicación metabólica más común del embarazo entre todos los grupos étnicos1 y se asocia con riesgos a corto y largo plazo para la salud de la madre y el feto2-4. Las mujeres con DMG, en comparación con las mujeres con embarazos sin complicaciones, tienen un mayor riesgo de desarrollar diabetes mellitus tipo 2 y eventos cardiovasculares (CV) dentro de la primera década después del parto5,6. Del mismo modo, los hijos de madres con DMG tienen una mayor incidencia de enfermedad CV de aparición temprana, desde la infancia hasta la edad adulta, en comparación con aquellos que no han estado expuestos prenatalmente a un ambiente hiperglucémico 7,8.
A pesar de estas observaciones, el vínculo entre DMG y enfermedad CV permanece en gran parte inexplorado. Pocos estudios en un pequeño número de mujeres documentaron que la DMG se encuentra asociada con cambios cardíacos subclínicos tanto en la madre9,10 como en el feto11-13 ,tales como evidencia de anomalías funcionales biventriculares diastólicas y sistólicas y cambios morfológicos cardíacos.
Para comprender mejor el impacto de la DMG en el sistema CV materno y fetal, analizamos los datos cardíacos que se recopilaron como parte de un extenso estudio prospectivo de fenotipo cardiovascular a las 35-36 semanas de gestación en mujeres que desarrollaron DMG y las comparamos con mujeres embarazadas sanas de la misma edad gestacional.
El objetivo de nuestro estudio fue evaluar la función cardiovascular materno-fetal del tercer trimestre entre aquellos embarazos expuestos a DMG y aquellos sin complicaciones.
Materiales y Métodos
Diseño del estudio y participantes
Nuestra población de estudio incluyó mujeres que asistieron a Harris Birthright Research Center, Kings’ College Hospital, Londres, Reino Unido, para la ecografía de crecimiento de rutina a las 35-36 semanas de gestación14. En este estudio prospectivo de cohorte, se analizaron mujeres con embarazo único que fueron diagnosticadas con DMG y por cada caso incluimos como controles a tres mujeres embarazadas que tenían embarazo sin complicaciones; y se evaluaron ambos grupos simultáneamente.
Se excluyeron a las mujeres con enfermedad CV previa conocida, trastorno hipertensivo gestacional o preexistente, enfermedad tiroidea sin tratamiento, defectos estructurales fetales o anomalías cromosómicas. Todas las mujeres dieron su consentimiento informado por escrito para participar en el estudio.
Los datos sobre el resultado del embarazo se recopilaron a partir de la historia clínica digital del hospital.
El diagnóstico de DMG se realizó mediante los puntos de corte establecidos en las guías de la Asociación Latinoamericana de Diabetes (ALAD) y la Sociedad Argentina de Diabetes (SAD)15. Estos son los mismos que utilizan las guías NICE16 (Instituto para la Excelencia Médica, UK). El test de tamizaje se llevó a cabo entre las 24 y 28 semanas mediante una prueba de tolerancia oral a la glucosa de 75g. Se diagnostico DMG si la glucemia en ayunas fue mayor o igual a 100 mg/dL o si fue mayor o igual a 140 mg/dL a las dos horas post 75g de glucosa. El manejo de la DMG se basó en alcanzar los rangos objetivos de glucosa plasmática. Se utilizó insulina o metformina cuando falló el manejo con medidas higiénico-dietéticas. Postnatalmente, a todas las pacientes con DMG se les ofreció una prueba de glucemia plasmática en ayunas después del nacimiento para la reclasificación post-parto.
Características maternas y valoración cardiovascular
Registramos información sobre edad materna, origen racial (blanco, negro, asiático y mixta), tabaquismo, historial médico, medicamentos, paridad (nulípara si no hubo embarazo previo con parto ≥24 semanas). Peso y altura se midieron en todas las mujeres. La presión arterial media se midió durante el embarazo y el puerperio mediante dispositivos validados según protocolo17.
La ecocardiografía materna se realizó con un Canon Escáner Aplio i900 (Canon Medical Systems Europe). El protocolo incluyó vistas paraesternal y apical estándar según Directrices de la Sociedad Americana de Ecocardiografía18.
Se realizó una evaluación funcional sistólica y diastólica detallada del ventrículo izquierdo19. El gasto cardíaco se calculó a partir del volumen sistólico multiplicado por la frecuencia cardíaca. El área auricular izquierda se midió al final de la sístole en la vista de cuatro cámaras. La masa ventricular izquierda se calculó con la fórmula de Devereux utilizando medidas a partir del Modo M en el eje largo paraesternal19. La excursión sistólica del anillo tricuspídeo (TAPSE) se midió utilizando el modo M. Las velocidades del flujo diastólico temprano (E) y tardío (A) de la válvula mitral se midieron con Doppler espectral y se calculó la relación E/A.
La relación E/e’ obtenida mediante Doppler tisular fue calculada utilizando el valor medio entre las ondas e’ de la pared ventricular septal y lateral. Los intervalos (contracción isovolumétrica (TCIV) y relajación isovolumétrica (TRIV)) fueron calculados a partir de mediciones Doppler tisulares. Se empleó el seguimiento de “Speckles (marcas)” para evaluar la contracción miocárdica longitudinal global (GLS) del ventrículo izquierdo.
Ultrasonido fetal y ecocardiografía
El examen ultrasonográfico prenatal se realizó con un Canon Aplio i900 escáner (Canon Medical Systems Europe) para evaluar el crecimiento fetal y estimar el peso fetal20. Los valores fueron convertidos a z-score basados en la tabla de peso fetal de la Fetal Medicine Foundation20. El corazón fetal se evaluó en todos los casos y controles utilizando un transductor convexo (10C3 e i8CX1).
Los índices de esfericidad ventricular izquierdo y derecho se midieron dividiendo el diámetro ventricular transversal por el longitudinal en imágenes 2D de un corte apical de 4-cámaras al final de la diástole. La función cardíaca se evaluó mediante métodos convencionales y ecocardiografía Doppler tisular y mediante el seguimiento de “Speckles (marcas)” para la contracción miocárdica21. El índice de rendimiento miocárdico se obtuvo usando Doppler espectral en la vista de 5 cámaras con el volumen de muestra incluyendo los flujos aórtico y mitral. La evaluación funcional sistólica incluyo TAPSE usando Modo-M. La función diastólica se evaluó mediante llenado transmitral (onda E y A) utilizando Doppler espectral y se calculó la relación E/A. Se aplicó Doppler tisular en los anillos lateral y septal mitral para calcular las velocidades Doppler miocárdicas y se calculó la relación E/e’21. La deformación del miocardio ventricular se midió en la vista apical de 4 cámaras. Todas las imágenes fueron adquiridas en 100-160 frame rate por segundo según las directrices recientes22. Los clips se exportaron desde el equipo para el análisis off-line utilizando el seguimiento de “Spleckles (marcas)” y un software especial (Vitrea, Canon). Cada clip tenía una duración de 3,5 segundos para poder seleccionar un ciclo para el análisis donde se visualizara el endocardio claramente y con los mínimos movimientos fetales. Los resultados del Speckle Tracking incluyeron la deformación sistólica longitudinal global (GLS) endocárdica de ambos ventrículos. Al comparar dos valores de deformación en este análisis, nos referimos al valor más negativo como tensión más alta, ya que representa una mayor deformación y al valor menos negativo como deformación más baja. El análisis fue realizado por dos operadores capacitados.
Análisis estadístico
Las variables categóricas se describieron como proporciones y números absolutos. Las variables continuas se describieron como media y desvío estándar o mediana y rango intercuartilo (RIC) de acuerdo con la distribución de los datos. Para determinar la distribución se utilizó la prueba Shapiro-Wilk, histogramas y gráficos de distribución normal.
Las diferencias entre los subgrupos de tratamiento de DMG fueron evaluadas mediante prueba de varianza o de Kruskal Wallis para parámetros continuos y prueba de chi-cuadrado para variables nominales.
Empleamos la prueba no paramétrica de Mann Whitney para comparar mediciones cardíacas maternas y fetales entre DMG y controles. Se utilizaron modelos de regresión lineal para evaluar la asociación entre DMG y una variedad de parámetros ecocardiográficos. El efecto de cada uno de los parámetros ecocardiográficos medidos fue evaluado con un modelo de regresión lineal múltiple ajustado por características maternas (edad, peso, altura, tensión arterial, frecuencia cardíaca, raza, paridad) y peso fetal estimado. Se presentan los coeficientes de regresión con sus IC95%.
El análisis estadístico se realizó con el paquete STATA, versión 13.1 (StataCorp, College Station, Texas, EE. UU.). Consideramos significancia estadística a p <0,05.
Resultados
Población de estudio
Estudiamos 161 mujeres con DMG y 483 mujeres con embarazos sin complicaciones. Las características demográficas se muestran en la Tabla 1. En general las mujeres con DMG, en comparación con los controles, eran mayores, tenían un IMC más alto, una ganancia de peso menor durante el embarazo y menor cantidad de partos con bajo peso al nacer. Las presiones arteriales medias fueron mayores en pacientes con DMG en comparación con controles.
Índices funcionales cardíacos maternos
Las mujeres con DMG, en comparación con los controles, tenían una masa ventricular izquierda más alta (122, IQR 103-143 vs 114, IQR 100-131 g/m2, p<0,001), Doppler tisular (onda sistólica s’) y deformación longitudinal global (GLS) inferior. Además, un mayor E/e’, área auricular izquierda y tiempo de relajación isovolumétrica prolongado (75, IQR 58-89 vs 68, IQR 56-83 mseg) fue observado en mujeres con DMG en comparación con los controles (p<0,009) (Tabla 2a). Siguiendo un análisis multivariable, teniendo en cuenta las características maternas y el peso fetal, solo índices funcionales diastólicos del ventrículo izquierdo se mantuvieron significativos (Tabla 2). No hubo diferencia significativa entre los grupos en gasto cardíaco y resistencia vascular periférica.
En el grupo DMG, 54 (33,5%) mujeres fueron tratadas solo con dieta, 52 (33,3%) recibieron metformina, 17 (10,6%) insulina y 38 (23,6%) ambos metformina e insulina. Solo 16 (9,1%) mujeres tuvieron valores de hemoglobina glicosilada superiores al 6% durante el embarazo.
Las características y los índices funcionales cardíacos entre los grupos de tratamiento se muestran en la Tabla complementaria 1 y 2.
Tabla 1. Características demográficas de la población de estudio.
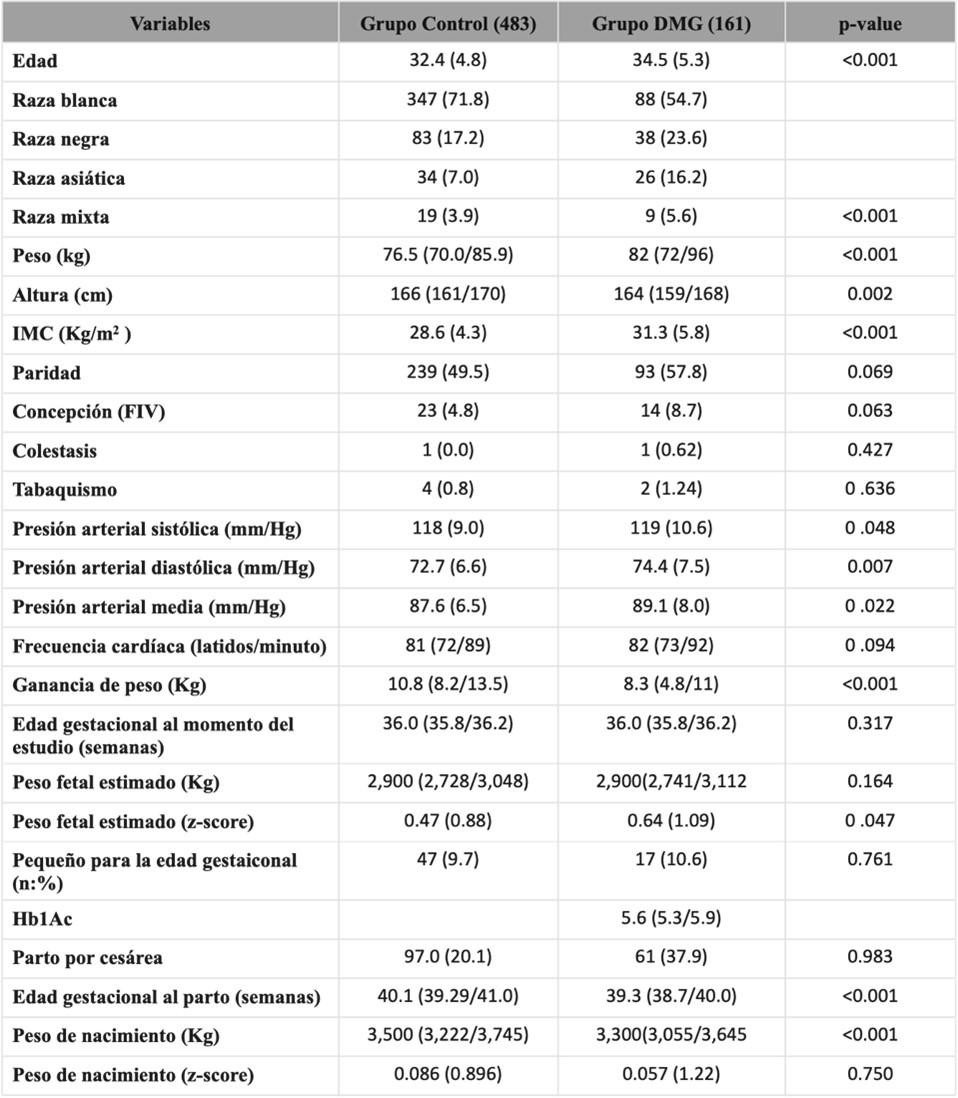
Tabla 2. Comparación de los parámetros CV maternos en ambos grupos.
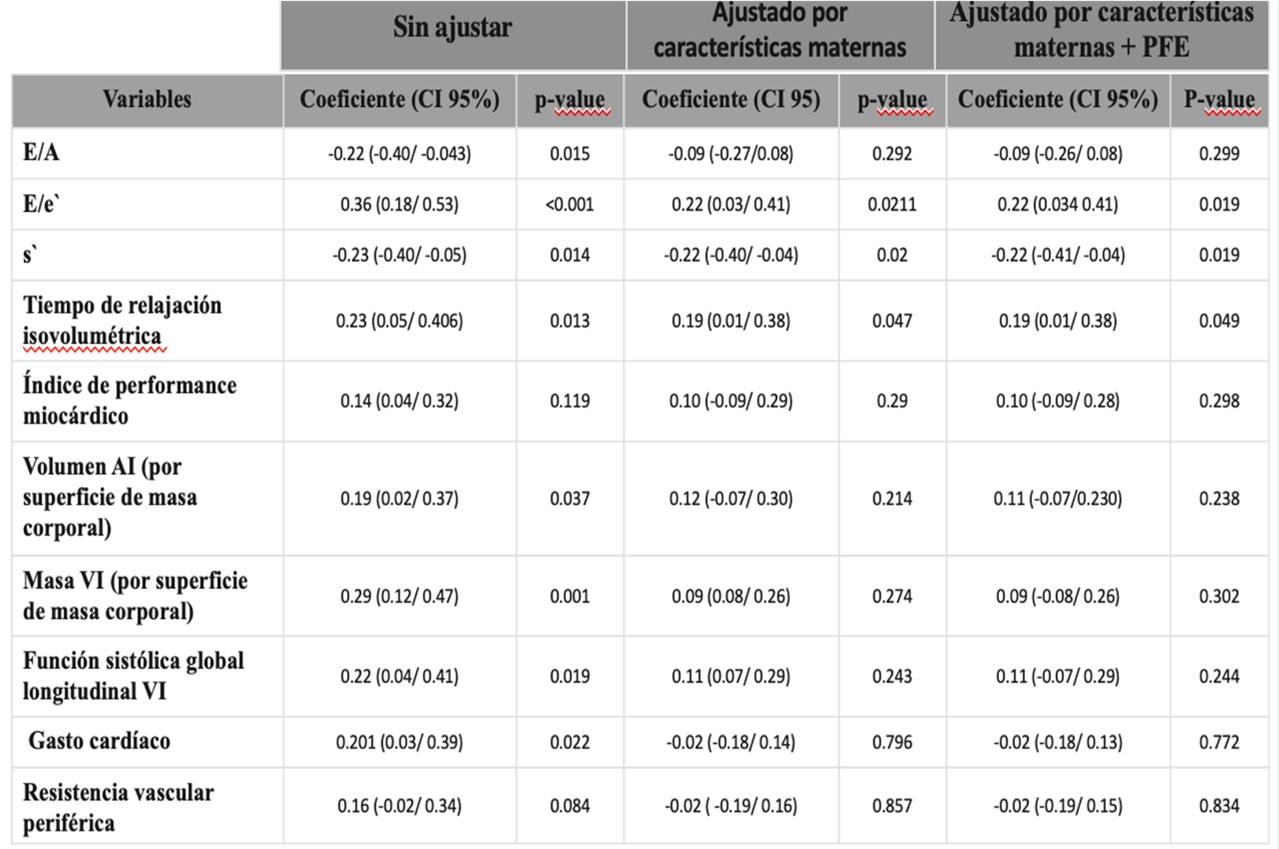
Índices funcionales cardíacos fetales
Los fetos de madres con DMG tenían corazones más globulares con mayor índice de esfericidad tanto derecho como izquierdo (p<0,001 para ambos) en comparación con los controles. Strain sistólico longitudinal global ventricular (-16,6%, IQR -18,8 a -15,2 vs -19%, IQR -20,9 a -17,4, p<0,001) y pico de tensión sistólica longitudinal global del ventrículo izquierdo inferior (19,7%, IQR -21,9 a -17,1 vs -20,7%, IQR -22,8 a -18,3, p=0,001) se observaron en DMG en comparación con controles. Después de un análisis multivariable, ajustando por características maternas, peso fetal estimado y frecuencia cardíaca fetal las asociaciones observadas siguió siendo significativa (Tabla 3).
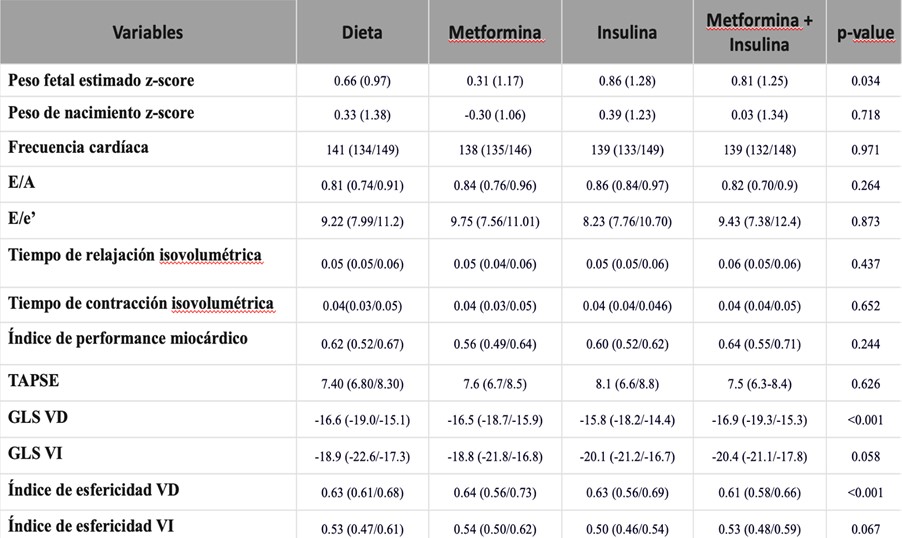
Los fetos cuyas madres fueron tratadas con insulina tenían menor función sistólica longitudinal global de ventrículo derecho en comparación con los controles, mientras que no se observaron diferencias en otros índices cardíacos entre los grupos de tratamiento (Tabla complementaria 3).
Tabla 3. Comparación de parámetros CV fetales en ambos grupos.
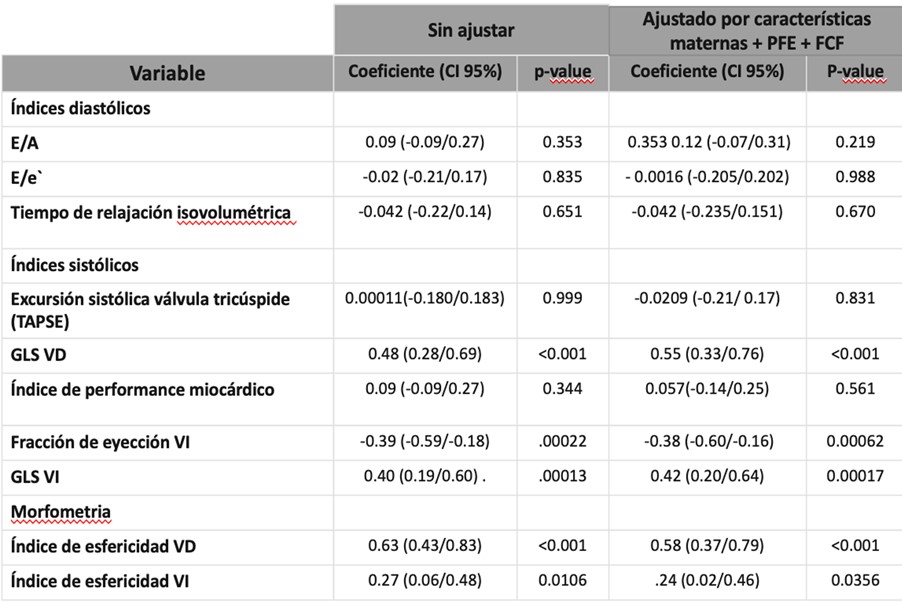
Análisis apareado de las respuestas cardiovasculares maternas y fetales
Considerando las diferencias significativas ajustadas entre embarazos con DMG y controles, dividimos a las mujeres con DMG en dos subgrupos de la siguiente manera: mujeres con un perfil cardíaco desfavorable (Grupo 1) caracterizado por al menos dos parámetros (incluyendo uno sistólico y otro diastólico) con distribución anormal versus mujeres con un perfil cardíaco normal (ninguno o máximo un parámetro sistólico o diastólico con distribución anormal, Grupo 2). No hubo diferencia significativa entre los grupos 1 y 2 en cualquiera de los parámetros cardíacos fetales (Tabla 4).
Tabla 4. Comparación de parámetros CV fetales de acuerdo a perfil CV materno.

Discusión
Principales hallazgos del estudio
Este estudio de evaluación funcional cardíaca materna y fetal detallada del tercer trimestre ha demostrado que, en primer lugar, las mujeres con DMG, en comparación con los controles, presentan una peor función cardíaca con índices funcionales diastólicos y sistólicos del ventrículo izquierdo más bajos; segundo, los fetos de madres con DMG, en comparación con los controles, presentaron corazones más globulares con índices de esfericidad ventricular derecho e izquierdo más altos y deformación miocárdica reducida, lo que indica disfunción cardíaca sistólica biventricular subclínica; y tercero, en el grupo de DMG no hubo una diferencia significativa en los parámetros cardíacos fetales entre mujeres con y sin perfil cardíaco desfavorable, lo que sugiere que la afectación materna y fetal fue diferente, sin una asociación entre las alteraciones observadas en ambos.
Interpretación de los resultados y comparación con la literatura existente
La diabetes gestacional es, por definición, una condición transitoria; sin embargo, hay datos que sugieren que las mujeres con DMG continúan teniendo un mayor riesgo de resultados adversos para su salud en el período posparto y mucho después. Por ejemplo, se ha informado un mayor riesgo de diabetes tipo 2 y enfermedad CV dentro de la primera década posterior al embarazo.
Aunque se pensaba que la asociación entre DMG y riesgo CV estaba mediada por el desarrollo de diabetes tipo 223, varios estudios de investigación y un metanálisis reciente sugieren que esta asociación está presente incluso en ausencia de diabetes tipo 224. Sin embargo, la mayoría de los datos notificados proceden de estudios de cohortes con información incompleta sobre factores de riesgo y perfil CV25-26. Por lo tanto, es difícil evaluar si la asociación descripta entre DMG y riesgo CV es el resultado de una lesión aguda y posiblemente sostenida en el sistema CV debido a la exposición transitoria a DMG o si es el resultado de una exposición prolongada a un perfil CV de riesgo, presente desde antes del embarazo.
Encontramos que las mujeres con DMG, en comparación con las mujeres con embarazo sin complicaciones, tenían una relajación miocárdica reducida. De los diferentes índices cardíacos, los parámetros del Doppler tisular fueron más sensibles para identificar alteraciones funcionales cardíacas subclínicas. Nuestros hallazgos complementan los resultados de dos estudios previamente publicados en 13 y 18 mujeres con DMG, donde se informó un grado leve de alteración funcional diastólica tanto durante el embarazo como en el posparto9,10; los cambios diastólicos eran sutiles y no cumplían los criterios de disfunción diastólica clínica del adulto según las guías europeas o americanas18. Por el contrario, otro estudio en 40 mujeres con DMG informó un aumento del grosor de la pared del ventrículo izquierdo y una disminución de la tensión global del ventrículo izquierdo, pero en ese estudio no se realizaron ajustes por las características maternas a pesar de que en el grupo de DMG el IMC y la presión arterial eran más altos que en los controles10. En nuestro estudio, los cambios funcionales longitudinales globales del ventrículo izquierdo y la masa del ventrículo izquierdo en mujeres con DMG no fueron significativamente diferentes de los controles después del ajuste por características maternas.
En el presente trabajo la diabetes gestacional no solo impactó en el sistema cardiovascular materno sino también en el corazón fetal. En consonancia con publicaciones anteriores, mostramos la presencia de deterioro funcional sistólico subclínico temprano evaluado mediante Speckle Tracking en fetos de madres con DMG12. Los cambios funcionales fueron más pronunciados en el ventrículo derecho que en el izquierdo y esto es esperable considerando que hay predominio del ventrículo derecho en el tercer trimestre. Los cambios funcionales cardíacos en los fetos de mujeres diabéticas pueden ser una respuesta a los efectos de la hipoxemia fetal27 y pueden presentarse inicialmente con un período compensatorio de aumento de la contractilidad del ventrícular que luego es seguido por un aumento del estrés de la pared ventricular que resulta en daño de las células miocárdicas, muerte de miocitos y deterioro de la función ventricular. Estas diferencias funcionales sistólicas tempranas entre los fetos expuestos a DMG y los controles se mantuvieron después de ajustar los parámetros teniendo en cuenta las características maternas, peso fetal estimado y la frecuencia cardíaca fetal. Los fetos de madres con DMG tenían corazones más esféricos en comparación con los controles, lo que concuerda con los datos de Patey et al, en 21 fetos de un grupo combinado de madres con diabetes pregestacional y gestacional12. En nuestro estudio, las mediciones funcionales cardíacas fetales diastólicas convencionales y Doppler tisular fueron comparable entre grupos y este hallazgo está de acuerdo con un estudio realizado por Miranda et al, en 76 fetos de madres con DMG a las 31 semanas de gestación11; pero contradice los resultados de Balli et al. en 67 fetos donde las mediciones se realizaron a las 24-36 semanas13 y un estudio realizado por Mohsin28 et al. en 50 fetos de madres con DMG alrededor de los 23 semanas de gestación. En los últimos dos estudios, la mayoría de las anomalías se observaron en fetos cuya madre tenía un control glucémico deficiente y esto, junto con las diferencias en la edad gestacional, puede explicar la discrepancia con los resultados de nuestro estudio.
La evaluación simultánea de la madre y su feto en este estudio nos brindó la oportunidad de explorar si existe un "emparejamiento" en el grado de las respuestas funcionales cardíacas maternas y fetales. Para responder a esta pregunta, considerando que ninguna de las mujeres con DMG cumplió con los criterios de disfunción cardíaca clínica, optamos por dividir la población en dos grupos (pacientes con perfil CV “normal” y perfil CV “anormal”). Curiosamente, no se pudo identificar ninguna relación en las respuestas CV. Estos hallazgos posiblemente sugerirían que diferentes vías contribuyen a los cambios funcionales cardíacos maternos y fetales en la DMG.
En el manejo de la DMG, la terapia con insulina a menudo se agrega cuando las alteraciones en el estilo de vida no logran establecer un buen control glucémico. Aunque la insulina puede tener efectos estimulantes del crecimiento en el miocardio que pueden afectar la remodelación del ventrículo izquierdo29, en nuestro estudio no hubo diferencias significativas en los índices cardíacos maternos entre los grupos de tratamiento. Los índices funcionales cardíacos fetales no se vieron afectados en su mayoría por el tratamiento.
Los mecanismos por los cuales la DMG aumenta el riesgo CV de la mujer no están bien explorados. Si bien algunas vías pueden estar mediadas por el desarrollo posterior de diabetes mellitus tipo 2 o una mayor exposición a factores de riesgo CV, también pueden contribuir otros mecanismos26. De acuerdo con estudios anteriores, las mujeres con DMG en este estudio tenían factores de riesgo CV en comparación con los controles: eran mayores, tenían mayor peso y presión arterial y eran más de origen africano, pero a diferencia de los estudios anteriores, el aumento de peso durante la gestación y el peso fetal fueron inferiores. Mientras los mecanismos que vinculan la hiperglucemia aguda con la disfunción cardíaca materna no están bien documentados, hay más información disponible sobre el efecto de la hiperglucemia en el corazón fetal. Varios estudios experimentales han demostrado que la exposición a un ambiente hiperglucémico durante el embarazo puede estar asociada con la remodelación del miocardio; el aumento de glucosa puede inducir hiperplasia de cardiomiocitos, alteraciones en la arquitectura y el metabolismo del miocardio30. Estos hallazgos serían consistentes con los cambios en la forma y función del miocardio observados en nuestro estudio.
Conclusiones
La ecocardiografía del tercer trimestre en mujeres con diagnóstico de DMG demuestra cambios cardíacos subclínicos en el binomio madre-feto. Futuros estudios serán necesarios para establecer si este patrón de cambios cardíacos persiste y posiblemente se deteriora después del parto y hace que las mujeres con DMG y sus hijos tengan un mayor riesgo cardiovascular.
El efecto de la DMG en el corazón materno y fetal fue diferente y no hubo una asociación clara entre las alteraciones observadas en ambos.
Bibliografía
- ADA: Classification and diagnosis of diabetes: standards of medical care in diabetes—2019. Diabetes Care. 2019;42(Supplement 1):S13- S28.
- Group HSCR. Hyperglycemia and adverse pregnancy outcomes. NEJM 2008;358:1991-2002.
- Kim C. Maternal outcomes and follow‐up after gestational diabetes mellitus. Diabet Med 2014;31:292-301.
- Malcolm J. Through the looking glass: gestational diabetes as a predictor of maternal and offspring long‐term health. Diabetes Metab 2012;28:307-311.
- Goueslard K, Cottenet J, Mariet A-S. Early cardiovascular events in women with a history of gestational diabetes mellitus. Cardiovasc Diabetol 2016;15:15.
- Kim C, Newton KM, Knopp RH. Gestational diabetes and the incidence of type 2 diabetes: a systematic review. Diabetes Care 2002;25:1862-1868.
- Yu Y, Arah OA, Liew Z. Maternal diabetes during pregnancy and early onset of cardiovascular disease in offspring: population based cohort study with 40 years of follow-up. BMJ 2019;367.
- Lee H, Jang HC, Park HK, Cho NH. Early manifestation of cardiovascular disease risk factors in offspring of mothers with previous history of gestational diabetes mellitus. Diabetes Res Clin Pract 2007;78:238-245.
- Freire CMV, Nunes MdCP, Barbosa MM. Gestational diabetes: a condition of early diastolic abnormalities in young women. J Am Soc Echocardiogr 2006;19:1251-1256.
- Meera SJ, Ando T, Pu D, Manjappa S, Taub CC. Dynamic left ventricular changes in patients with gestational diabetes: a speckle tracking echocardiography study. J Clin Ultrasound 2017;45:20-27.
- Miranda JO, Cerqueira RJ, Ramalho C, Areias JC, Henriques-Coelho T. Fetal cardiac function in maternal diabetes: a conventional and speckle-tracking echocardiographic study. J Am Soc Echocardiogr 2018;31:333-341.
- Patey O, Carvalho JS, Thilaganathan B. Perinatal changes in fetal cardiac geometry and function in diabetic pregnancy at term. Ultrasound Obstet Gynecol 2019;54:634-642.
- Balli S, Pac FA, Ece İ, Oflaz MB, Kibar AE, Kandemir Ö. Assessment of cardiac functions in fetuses of gestational diabetic mothers. Pediatr Cardiol 2014;35:30- 37.
- Ciobanu A, Rouvali A, Syngelaki A, Akolekar R, Nicolaides KH. Prediction of small for gestational age neonates: screening by maternal factors, fetal biometry, and biomarkers at 35–37 weeks’ gestation. Am J Obstet Gynecol 2019;220:486.e481-486. e411.
- SAD
- Walker J. NICE guidance on diabetes in pregnancy: management of diabetes and its complications from preconception to the postnatal period. NICE clinical guideline, 2008. Diabet Med 2008;25:1025-1027.
- Poon L, Zymeri N, Zamprakou A, Syngelaki A, Nicolaides K. Protocol for measurement of mean arterial pressure at 11-13 weeks' gestation. Fetal Diagn Ther 2012;31:42-48.
- Lang RM, Badano LP, Mor-Avi V, et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging 2015;16:233-271.
- Garcia-Gonzalez C, Abdel-Azim S, Galeva S, Georgiopoulos G, Nicolaides KH, Charakida M. Placental function and fetal weight are associated with maternal hemodynamic indices in uncomplicated pregnancies at 35-37 weeks gestation. Am J Obstet Gynecol 2020, doi: 10.1016/j.ajog.2020.01.011.
- Nicolaides K, Wright D, Syngelaki A, Wright A, Akolekar R. Fetal Medicine Foundation fetal and neonatal population weight charts. Ultrasound Obstet Gynecol 2018;52:44-51.
- Crispi F, Gratacós E. Fetal cardiac function: technical considerations and potential research and clinical applications. Fetal Diagn Ther 2012;32:47-64.
- DeVore GR, Polanco B, Satou G, Sklansky M. Two-Dimensional Speckle Tracking of the Fetal Heart: A Practical Step-by-Step Approach for the Fetal Sonologist. J Ultrasound Med 2016;35:1765-1781.
- Shah BR, Retnakaran R, Booth GL. Increased risk of cardiovascular disease in young women following gestational diabetes mellitus. Diabetes Care 2008;31:1668-1669.
- Kramer CK, Campbell S, Retnakaran R. Gestational diabetes and the risk of cardiovascular disease in women: a systematic review and meta-analysis. Diabetologia 2019;62:905-914.
- Carr DB, Utzschneider KM, Hull RL, et al. Gestational diabetes mellitus increases the risk of cardiovascular disease in women with a family history of type 2 diabetes. Diabetes Care 2006;29:2078-2083.
- McKenzie-Sampson S, Paradis G, Healy-Profitós J, St-Pierre F, Auger N. Gestational diabetes and risk of cardiovascular disease up to 25 years after pregnancy: a retrospective cohort study. Acta Diabetol 2018;55:315-322.
- Escobar J, Teramo K, Stefanovic V, et al. Amniotic fluid oxidative and nitrosamine stress biomarkers correlate with fetal chronic hypoxia in diabetic pregnancies. Neonatology 2013;103:193-198.
- Mohsin M, Sadqani S, Younus K, Hoodbhoy Z, Ashiqali S, Atiq M. Evaluation of cardiac function in fetuses of mothers with gestational diabetes. Cardiol Young 2019;29:1264-1267.
- Riehle C, Abel ED. Insulin signaling and heart failure. Circ Res 2016;118:1151- 1169.
- Buchanan J, Mazumder PK, Hu P, et al. Reduced cardiac efficiency and altered substrate metabolism precedes the onset of hyperglycemia and contractile dysfunction in two mouse models of insulin resistance and obesity. Endocrinology 2005;146:5341-5349.
Tabla complementaria 1. Diferencias en características y parámetros hemodinámicos maternos de acuerdo al tratamiento en el grupo de DMG.
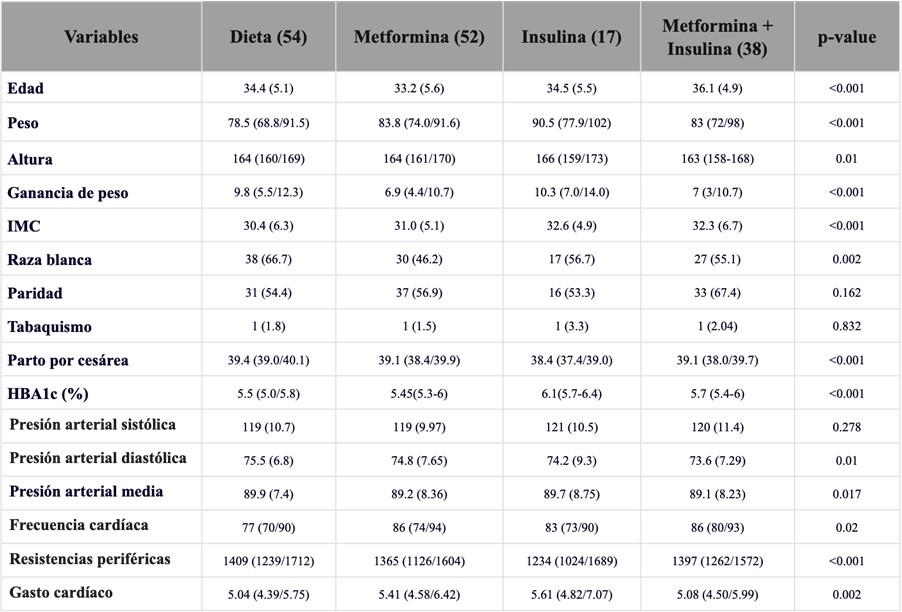
Tabla complementaria 2. Diferencias en parámetros CV maternos de acuerdo al tratamiento en el grupo de DMG.
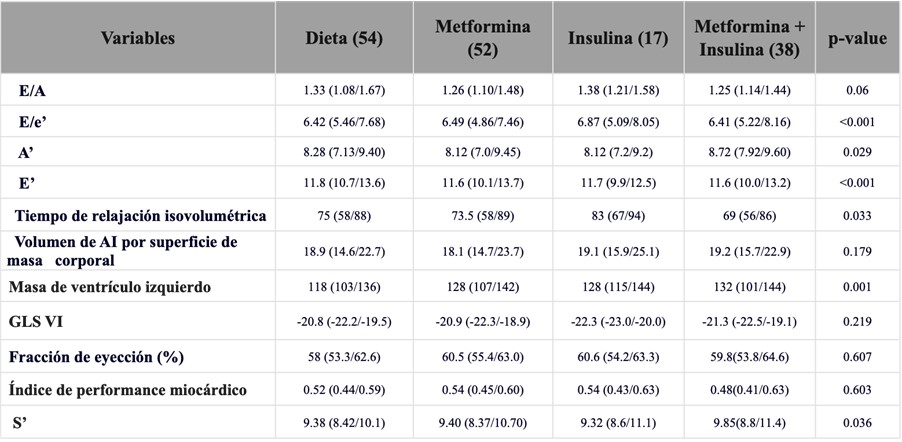
Tabla complementaria 3. Diferencias en el peso fetal y parámetros CV fetales de acuerdo al tratamiento en el grupo de DMG.
1. Profesora asistente en Hospital Universitario de Maternidad y Neonatología. Unidad de Conocimiento Traslacional Hospitalaria UCTH- Facultad de Ciencias Médicas. UNC. Córdoba Capital, Argentina.
Research Fellow en Harris Birthright Research Centre, The Fetal Medicine Foundation, King’s College Hospital, Londres, UK.
2. Profesor consulto en Hospital Universitario de Maternidad y Neonatología. Unidad de Conocimiento Traslacional Hospitalaria UCTH – Facultad de Ciencias Médicas. UNC. Córdoba Capital, Argentina.
3. Profesor Titular I Cátedra de Obstetricia en Hospital Universitario de Maternidad y Neonatología. Unidad de Conocimiento Traslacional Hospitalaria UCTH – Facultad de Ciencias Médicas. UNC. Córdoba Capital, Argentina.
4. Médica Staff del Departamento de Cardiología Fetal en Harris Birthright Research Centre, The Fetal Medicine Foundation, King’s College Hospital, Londres, UK.
5. Jefe de Medicina Fetal de Harris Birthright Research Centre, The Fetal Medicine Foundation, King’s College Hospital, Londres, UK.
6. Jefa del Departamento de Endocrinología y Diabetes en Hospital Universitario de Maternidad y Neonatología. Unidad de Conocimiento Traslacional Hospitalaria UCTH – Facultad de Ciencias Médicas. UNC. Córdoba Capital, Argentina.