Pérdida de oportunidades en la demora del diagnóstico y tratamiento, con estimación de eventos evitables, en el Síndrome Antifosfolípidico Obstétrico Primario (SAFOP). De la teoría a la realidad.
Autores:
Sebastián Udry1,2,3; Gabriela de Larrañaga2; Silvia Perés Wingeyer2; Diego Santiago Fernández Romero1; Federico Aranda2, Voto Liliana4 y José Omar Latino1.
Objetivo
Identificar y cuantificar el impacto en la demora del diagnóstico y tratamiento en pacientes con Síndrome Antifosfolípidico Obstétrico Primario (SAFOP), en términos de tiempo y eventos asociados.
Materiales y métodos
Estudio retrospectivo observacional de cohorte. Pacientes: 99 mujeres asistidas desde 2008 hasta 2020 en nuestros centros, que presentaron diagnóstico de SAFOP (acorde a guías internacionales), y que fueron estratificadas considerando dos etapas de status diagnóstico:
Etapa 1: Pacientes solo con criterio clínico de SAFOP (aún no diagnosticadas). Es decir, aquellas pacientes que presentaron: a) Al menos 3 abortos de menos de 10 semanas, b) Al menos un aborto mayor de 10 semanas y/o c) Un nacimiento de <34 semanas debido a preeclampsia, eclampsia y/o insuficiencia placentaria.
Etapa 2: mismas pacientes ahora con criterio de laboratorio positivo que confirma el diagnóstico.
Se registró el número de eventos obstétricos/trombóticos en Etapa 1 y se lo comparó con el número de eventos obstétricos/trombóticos en Etapa 2.
Las pacientes con diagnóstico de SAFOP (Etapa 2) fueron tratadas con aspirina 100 mg/día + heparina de bajo peso molecular (HBPM) 40 mg/ día. Se utilizó una prueba no paramétrica para comparar datos cuantitativos y la prueba de chi-cuadrado o Fisher para comparar proporciones. Se realizaron análisis de regresión logística binaria para evaluar la asociación entre los resultados perinatales entre ambos grupos. Se calcularon las razones de probabilidad (OR) y los intervalos de confianza (IC) del 95 % para evaluar la fuerza de la asociación. Se consideró que P<0,05 indicaba significación estadística.
Resultados:
En la Etapa 1 (solo criterio clínico positivo) se registraron 134 embarazos: 41,8% (56/134) nacidos vivos y 58,2% (78/134) pérdidas de embarazo. En la Etapa 2 se identificaron 99 embarazos: 82,9% (82/99) nacidos vivos y 17,2% (17/99) perdidas de embarazo. Sin registro de eventos trombóticos ni de otras complicaciones obstétricas. [ODDS= 6,71 (IC 95%: 3,59 – 12,55), p<0,0001].
Se identificaron un total de 87 eventos prevenibles asociados a SAFOP: 46 abortos, 32 fetos muertos, 9 prematuros y 1 evento trombótico.
El tiempo transcurrido entre la Etapa 1 y la Etapa 2 fue de 4,27 años ± 3,58 (rango: 0- 21 años). Se estimó una cifra de 20,37 eventos evitables por año/100 pacientes en Etapa 1.
Conclusiones:
La demora en el diagnóstico de pacientes con SAFOP lleva a la ocurrencia de eventos obstétricos y trombóticos. Esta pérdida de tiempo resulta en pérdida de vidas prevenibles. Es importante remarcar que tanto el sub-diagnostico, como el sobrediagnóstico generan impacto sobre el sistema de salud pública.
Numero de Citas: 32
Palabras Claves: Aborto Recurrente, Síndrome Antifosfolípido, Trombosis, Perdida de Embarazo.
Introducción
El Síndrome Antifosfolípido (SAF) es una enfermedad autoinmune, que se caracteriza por la presencia persistente de anticuerpos antifosfolípidos (aPL), tales como anticoagulante lúpico (AL) y/o anticuerpos anticardiolipinas (aCL) y/o anticuerpos antiβ2Glicoproteína I (aβ2GPI), y clínica trombótica y/o morbilidad obstétrica. Los últimos criterios revisados para SAF incluyen la trombosis vascular (SAF trombótico) y la morbilidad durante el embarazo (SAF Obstétrico) (criterios del consenso de Sapporo revisados en Sídney en el año 2006).
Durante el embarazo los eventos clínicos descriptos en el criterio de Sídney son: Pérdidas de embarazo después de la semana 10 , preeclampsia precoz, insuficiencia placentaria y 3 pérdidas de embarazo recurrentes de menos de 10 semanas de gestación. La pérdida fetal no recurrente antes de la 10ma semanas se atribuye más comúnmente a otras causas, como la portación de aberraciones cromosómicas a nivel del embrión (factores genéticos), ciertas alteraciones anatómicas del útero, algunas disfunciones endocrinológicas, etc.
Existe un sub-diagnóstico en SAF debido a diversas razones, que incluyen desconocimiento, falta de formación profesional, falta de técnicas diagnósticas acordes, falta de articulación sistema de emergencia-sistema asistencial, fallas en las historias clínicas unificadas, etc. Conocer este Síndrome, resulta fundamental en la formación académica de todos los obstetras, ya que como vimos, se asocia con morbilidad obstétrica.
Recientemente Randin y colaboradores publicaron en “Journal of rare Diseases” un análisis en el cual se demuestran que el retraso en el diagnóstico de este síndrome que impacta directamente sobre la salud física y psíquica de la mujer y la familia, estaría directamente ligado al desconocimiento por parte del personal médico de esta patología, su diagnóstico y tratamiento. Cabe destacar que en nuestro país no existen datos sobre el sub-diagnóstico de esta patología y cuáles podrían ser las posibles causas de este subdiagnostico.
Significado y originalidad de la propuesta
El SAF obstétrico afecta a una porción de la sociedad en edad reproductiva impactando, por lo tanto, sobre el sistema de salud pública, comprometiendo de forma directa la calidad de vida de cientos de mujeres y teniendo un elevado costo en la salud física y psíquica de los individuos que la padecen.
Objetivos, Materiales y Métodos
Objetivo: Identificar y cuantificar el impacto en la demora del diagnóstico y tratamiento en pacientes con Síndrome Antifosfolípidico Obstétrico Primario (SAFOP), en términos de tiempo y eventos asociados.
Materiales y Métodos:
DISEÑO
Estudio retrospectivo observacional de cohorte.
POBLACIÓN
99 mujeres asistidas desde 2008 hasta 2020 en nuestros centros (estudio Multicentrico), que presentaron diagnóstico de SAFOP (acorde a guías internacionales), y que fueron estratificadas considerando dos etapas de status diagnóstico:
Etapa 1/ Grupo 1: Pacientes solo con criterio clínico de SAFOP (aún no diagnosticadas). Es decir, aquellas pacientes que presentaron: a) Al menos 3 abortos de menos de 10 semanas, b) Al menos un aborto mayor de 10 semanas y/o c) Un nacimiento de <34 semanas debido a preeclampsia, eclampsia y/o insuficiencia placentaria. Todas las pacientes pertenecientes a este grupo, presentaron diagnostico de SAFOP en el futuro.
Etapa 2 / Grupo 2: las mismas pacientes ahora con criterio de laboratorio positivo que confirma el diagnóstico. Ver Figura N°1.
Se registró el número de eventos obstétricos/trombóticos en Etapa 1 y se lo comparó con el número de eventos obstétricos/trombóticos en Etapa 2. A los eventos sucedidos durante la etapa 1, se los clasifico como EVENTOS PREVENIBLES (Figura N°1)

Figura N°1: línea temporal de las pacientes, donde se grafica las 2 etapas descriptas en el texto. Etapa N°1: pacientes con criterio clínico, pero que no presentan resultados de laboratorio para SAF. Etapa N°2: Pacientes con criterio clínico, a las cuales se las estudio y como resultado presentaron diagnostico de SAFOP.
Para evaluar el impacto del tratamiento en el embarazo y de esta forma evaluar el impacto de la pérdida de oportunidades, comparamos los resultados perinatales de las pacientes del grupo 1 vs. grupo 2. Las pacientes del grupo 2 que quedaron embarazadas fueron tratadas solo con el tratamiento estándar para el SAF obstétrico, que incluye dosis bajas de aspirina (LDA) 100 mg/día + una dosis profiláctica de heparina de bajo peso molecular (HBPM) 40 mg/ día desde el diagnóstico de embarazo. Los pacientes del grupo 1 no utilizaban tratamiento para el SAF.
CRITERIOS DE INCLUSION
- Pacientes que fueron diagnosticadas con Síndrome antifosfolipídico obstétrico Primario
- Pacientes mayores de 18 años
CRITERIOS DE EXCLUSIÓN
- Falta de datos para evaluar variables y/o falta de temporalidad de los datos
MUESTREO
Secuencial: se ingresaron a todas las pacientes con SAFOP que fueron atendidas en los centros de estudio y cumplieron con los criterios de inclusión.
MÉTODOLOGIA DEL ESTUDIO
Se buscaron los datos de pacientes con SAFOP en historias clínicas de las instituciones. Se estableció una base de datos de Excel, con todos los datos y variables de las pacientes. Se realizo una evaluación estadística a través del programa SPSS 15.0 comparando las diferentes etapas.
ANÁLISIS ESTADÍSTICO
Para el análisis estadístico se realizó utilizando el programa SPSS 15.0 para Windows (SPSS, Chicago, IL, USA). Se utilizó una prueba no paramétrica para comparar datos cuantitativos y la prueba de chi-cuadrado o Fisher para comparar proporciones. Se realizaron análisis de regresión logística binaria para evaluar la asociación entre los resultados perinatales entre ambos grupos. Se calcularon las razones de probabilidad (OR) y los intervalos de confianza (IC) del 95 % para evaluar la fuerza de la asociación. Se consideró que P<0,05 indicaba significación estadística.
PROCEDIMIENTOS PARA GARANTIZAR LOS ASPECTOS ÉTICOS DE LA INVESTIGACIÓN
Los datos sensibles relacionados al paciente estarán al resguardo de la confidencialidad y privacidad como así también de los datos surgidos de la investigación, mediante codificación de los mismos. Solamente tendrán acceso a estas informaciones los investigadores directamente relacionados al ensayo, los integrantes del Comité de Docencia y del Comité de Ética y autoridades competentes. Todos estos aspectos son tenidos en cuenta según las normativas de la Declaración Universal sobre el Genoma Humano y los Derechos Humanos UNESCO 1997, Declaración Internacional sobre los datos genéticos humanos UNESCO 2003, la Declaración Universal sobre Bioética, Derechos Humanos UNESCO 2005 y de la Declaración de Helsinski, versión 2008 y guía para Investigaciones en Salud Humana (GISH), resolución 1480/2011 MSN.
LABORATORIO
Los criterios de laboratorio para SAF incluyen títulos moderados/altos de anticuerpos anticardiolipinas (aCL) IgG o IgM (> 40 GPL o MPL o > percentil 99) y/o anticuerpos anti Beta-2-Glicoproteina-1 (aβ2GPI) IgG o IgM (> percentil 99) y/o anticoagulante lúpico (LA), al menos dos veces con 12 semanas de diferencia. Se utilizaron ensayos de cribado para detectar LA de acuerdo con las directrices internacionales actuales (1). Los títulos ≥ 80 GPL o MPL para aCL o ≥ 80 AU para aβ2GPI se definieron arbitrariamente como títulos altos de anticuerpos antifosfolipídicos (aPL) según publicaciones anteriores.
Las mujeres se clasificaron según la positividad de aPL en las categorías de laboratorio de la siguiente manera: triple positivo para aPL (LA+, aCL+ y aβ2GPI+), doble positivo para aPL (LA+ y aCL+ o LA+ y aβ2GPI+, o aCL+ y aβ2GPI+) y positivo simple para aPL (LA+ o aCL+, o aβ2GPI+).
Resultados
ANALISIS GENERAL
Este estudio incluyó a 99 mujeres diagnosticadas con SAFOP [mediana de edad: 32 años; (28-37 años)]. Las características demográficas, de laboratorio y clínicas al momento del diagnóstico se describen en la Tabla 1 y la Tabla 2.
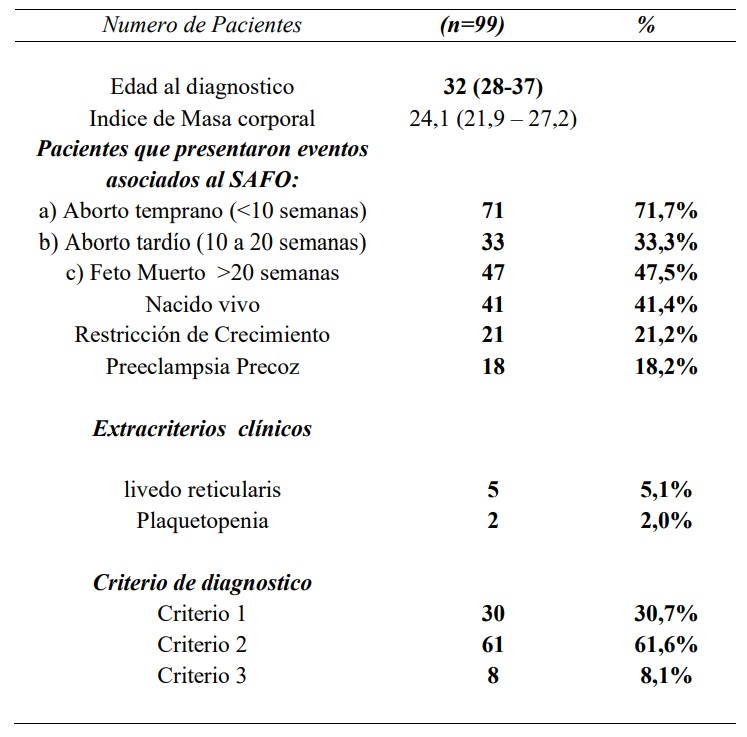
Criterio 1: tres o más abortos espontáneos consecutivos inexplicables antes de la semana 10 de gestación, Criterio 2: Una o más muertes inexplicables de un feto morfológicamente normal a partir de la décima semana de gestación, Criterio 3: Uno o más nacimientos prematuros de un recién nacido morfológicamente normal antes de la semana 34 de gestación debido a: (i) eclampsia o preeclampsia severa definida según las definiciones estándar, o (ii) características reconocidas de insuficiencia placentaria
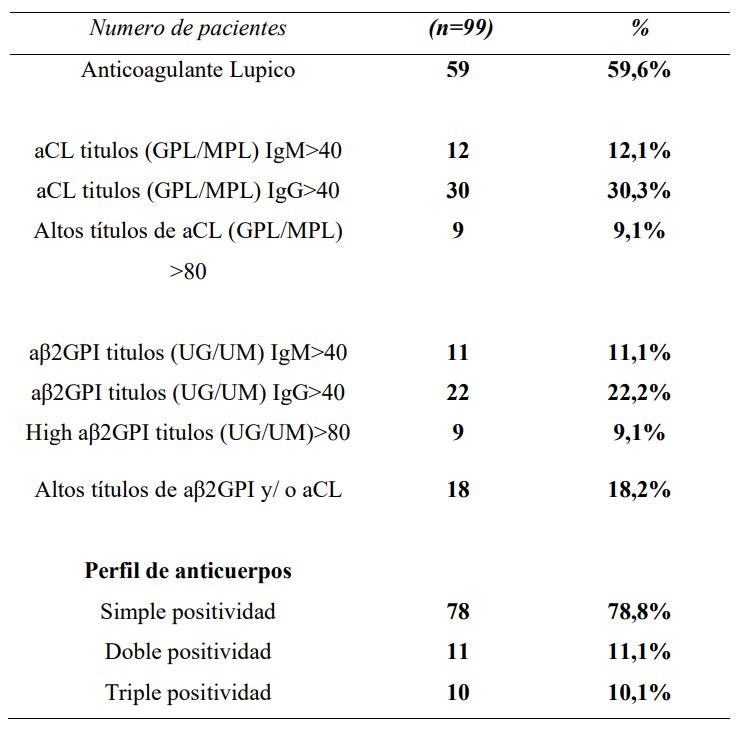
aCL: anticuerpos anticardiolipina; aβ2GPI: anticuerpos anti-beta-2-glicoproteina-1
Tabla 2: Características de laboratorio de los pacientes con SAFOP al momento del diagnóstico
Estas pacientes fueron evaluadas durante el tiempo en que aún pertenecían al Grupo 1. Durante este período: se registraron 134 embarazos; Entre estos, 41,8% (56/134) fueron nacidos vivos y 58,2% (78/134) fueron pérdidas de embarazo. Se registraron un total de 87 eventos relacionados con SAF: 46 abortos espontáneos, 32 pérdidas fetales y 9 partos prematuros antes de la semana 34 por preeclampsia o insuficiencia placentaria y una trombosis.
El tiempo medio de retraso diagnóstico (± DE) fue de 4,27 años ± 3,58 y osciló entre 0 y 21 años). Se estimó una cifra de 20,37 eventos evitables por año/100 pacientes. En los centros de referencia se observó un menor tiempo de demora diagnóstica (tabla 3).

Tabla 3. Comparación del tiempo de demora diagnóstica entre pacientes atendidos en un Hospital General y en un Centro de referencia
Para evaluar el impacto del tratamiento en el embarazo y de esta manera evaluar el impacto de la pérdida de oportunidades, comparamos los resultados del embarazo entre el Grupo 1 y el Grupo 2 (Tabla 4). Encontramos que las pacientes del grupo 1 (sin tratamiento) se asociaron a Pérdidas Embarazo [ODDS= 6,71 (IC 95%: 3,59 – 12,55), p<0,0001]. Las pacientes con perfil de aPL de alto riesgo presentaron peores resultados de embarazo en el grupo 1 (52,4% vs 79,3%) p=0,01.

Tabla 4. Comparación de los resultados del embarazo entre el Grupo 1 y el Grupo 2
Discusión
El retraso en el diagnóstico representa uno de los principales retos en el campo de las enfermedades raras. Las pacientes afectadas por estas condiciones muchas veces deben esperar meses o años antes de tener el diagnóstico correcto. Las consecuencias sobre el estado de los pacientes son graves. Un diagnóstico precoz permite un tratamiento rápido y la reducción de eventos trombóticos y obstétricos, en pacientes que potencialmente son muy jóvenes, impactando tanto sobre la calidad de vida y la salud pública.
En este estudio, pudimos observar que las pacientes mientras se encontraban en el grupo 1 presentaban una incidencia de 20,37 eventos evitables por año/100 pacientes. Luego realizamos una evaluación de estas pacientes antes y después de su diagnóstico (Grupo 1 vs Grupo 2), en donde observamos que el tratamiento convencional, es muy efectivo en la prevención de eventos asociados a SAFO, y de esta manera se refuerza la importancia de realizar un diagnóstico, lo antes posible. Otro dato de suma importancia y no publicado anteriormente en nuestro país, es que nuestras pacientes tardan 4,27 años hasta tener diagnóstico, desde el momento en que cumplen con el criterio de Sydney. Es de suma importancia modificar esto, teniendo en cuenta que en otras regiones del mundo el retraso diagnostico es menor a un año. Por otro lado, es importante remarcar que en nuestro análisis, cuando las pacientes fueron atendidas en hospitales que se especializan en esta patología, este tiempo se reduce a un año (como es en otras regiones del mundo); esto nos hace pensar que este retraso podría estar ligado a el desconocimiento por parte del personal médico. En un estudio realizado por Randin, en donde se analizo las causas de este retraso diagnóstico, se concluyó que esta demora se debe principalmente a la falta de conocimiento de la mayoría de los médicos, que son incapaces de reconocer estas patologías [7]
Conclusiones
La demora en el diagnóstico de pacientes con SAFOP lleva a la ocurrencia de eventos obstétricos y trombóticos. Esta pérdida de tiempo resulta en eventos prevenibles. Esta demora en el diagnostico se podría deber principalmente a la falta de conocimiento de la mayoría de los médicos, que son incapaces de reconocer estas patologías. Es importante remarcar que tanto el sub-diagnostico, como el sobrediagnóstico generan impacto sobre el sistema de salud pública.
Bibliografía
- Miyakis S, Lockshin MD, Atsumi T, Branch DW, Brey RL, Cervera R, et al. International consensus statement on an update of the classification criteria for definite antiphospholipid syndrome (APS). J Thromb Haemost. 2006;4:295–306.
- Massimo Radin , Silvia Grazietta Foddai, Alice Barinotti, Irene Cecchi , Elena Rubini , Savino Sciascia and Dario Roccatello. Reducing the diagnostic delay in Antiphospholipid Syndrome over time: a real world observation. J Rare Dis (2021) 16:280 https://doi.org/10.1186/s13023-021-01906-1
- Rai R, Cohen H, Dave M, Regan L. Randomised controlled trial of aspirin and aspirin plus heparin in pregnant women with recurrent miscarriage associated with phospholipid antibodies (or antiphospholipid antibodies). Bmj. 1997;314(7076):253-7.
- Franklin RD, Kutteh WH. Antiphospholipid antibodies (APA) and recurrent pregnancy loss: treating a unique APA positive population. Hum Reprod. 2002;17(11):2981-5.
- Mak A, Cheung MW, Cheak AA, Ho RC. Combination of heparin and aspirin is superior to aspirin alone in enhancing live births in patients with recurrent pregnancy loss and positive anti-phospholipid antibodies: a meta-analysis of randomized controlled trials and meta-regression. Rheumatology. 2010;49(2):281-8. doi:10.1093/rheumatology/kep373.
- Ruffatti A, Tonello M, Visentin MS, Bontadi A, Hoxha A, De Carolis S et al. Risk factors for pregnancy failure in patients with anti-phospholipid syndrome treated with conventional therapies: a multicentre, case-control study. Rheumatology. 2011;50(9):1684-9. doi:10.1093/rheumatology/ker139.
- Bramham K, Thomas M, Nelson-Piercy C, Khamashta M, Hunt BJ. First-trimester lowdose prednisolone in refractory antiphospholipid antibody-related pregnancy loss. Blood. 2011;117(25):6948-51. doi:10.1182/blood-2011-02-339234.
- Danowski A, de Azevedo MN, de Souza Papi JA, Petri M. Determinants of risk for venous and arterial thrombosis in primary antiphospholipid syndrome and in antiphospholipid syndrome with systemic lupus erythematosus. The Journal of rheumatology. 2009;36(6):1195-9. doi:10.3899/jrheum.081194.
- Simchen MJ, Dulitzki M, Rofe G, Shani H, Langevitz P, Schiff E et al. High positive antibody titers and adverse pregnancy outcome in women with antiphospholipid syndrome. Acta obstetricia et gynecologica Scandinavica. 2011;90(12):1428-33. doi:10.1111/j.1600-0412.2011.01236.x.
- De Carolis S, Botta A, Santucci S, Garofalo S, Martino C, Perrelli A et al. Predictors of pregnancy outcome in antiphospholipid syndrome: a review. Clinical reviews in allergy & immunology. 2010;38(2-3):116-24. doi:10.1007/s12016-009-8144-z.
- Ruffatti A, Tonello M, Cavazzana A, Bagatella P, Pengo V. Laboratory classification categories and pregnancy outcome in patients with primary antiphospholipid syndrome prescribed antithrombotic therapy. Thrombosis research. 2009;123(3):482-7. doi:10.1016/j.thromres.2008.03.012.
- Ruffatti A, Calligaro A, Hoxha A, Trevisanuto D, Ruffatti AT, Gervasi MT et al. Laboratory and clinical features of pregnant women with antiphospholipid syndrome and neonatal outcome. Arthritis care & research. 2010;62(3):302-7. doi:10.1002/acr.20098.
- Ruffatti A, Calligaro A, Del Ross T, Favaro M, Tonello M, Banzato A et al. Riskbased secondary prevention of obstetric antiphospholipid syndrome. Lupus. 2012;21(7):741-3. doi:10.1177/0961203312446388.
- Ruffatti A, Salvan E, Del Ross T, Gerosa M, Andreoli L, Maina A et al. Treatment strategies and pregnancy outcomes in antiphospholipid syndrome patients with thrombosis and triple antiphospholipid positivity. A European multicentre retrospective study. Thrombosis and haemostasis. 2014;112(4):727-35. doi:10.1160/TH14-03-0191.
- Saccone G, Berghella V, Maruotti GM, Ghi T, Rizzo G, Simonazzi G et al. Antiphospholipid antibody profile based obstetric outcomes of primary antiphospholipid syndrome: the PREGNANTS study. American journal of obstetrics and gynecology. 2017;216(5):525 e1- e12. doi:10.1016/j.ajog.2017.01.026.
- Latino JO, Udry S, Aranda FM, Peres Wingeyer SDA, Fernandez Romero DS, de Larranaga GF. Pregnancy failure in patients with obstetric antiphospholipid syndrome with conventional treatment: the influence of a triple positive antibody profile. Lupus. 2017;26(9):983-8. doi:10.1177/0961203317692432.
- Miyakis S, Lockshin MD, Atsumi T, Branch DW, Brey RL, Cervera R et al. International consensus statement on an update of the classification criteria for definite antiphospholipid syndrome (APS). Journal of thrombosis and haemostasis : JTH. 2006;4(2):295-306. doi:10.1111/j.1538-7836.2006.01753.x.
- Yelnik CM, Porter TF, Branch DW, Laskin CA, Merrill JT, Guerra MM et al. Brief Report: Changes in Antiphospholipid Antibody Titers During Pregnancy: Effects on Pregnancy Outcomes. Arthritis & rheumatology. 2016;68(8):1964-9. doi:10.1002/art.39668.
- Topping J, Quenby S, Farquharson R, Malia R, Greaves M. Marked variation in antiphospholipid antibodies during pregnancy: relationships to pregnancy outcome. Human reproduction. 1999;14(1):224-8.
- Carmona F, Font J, Azulay M, Creus M, Fabregues F, Cervera R et al. Risk factors associated with fetal losses in treated antiphospholipid syndrome pregnancies: a multivariate analysis. American journal of reproductive immunology. 2001;46(4):274-9.
- De Carolis S, Santucci S, Botta A, Salvi S, Degennaro VA, Garufi C et al. The relationship between TORCH complex false positivity and obstetric outcome in patients with antiphospholipid syndrome. Lupus. 2012;21(7):773-5. doi:10.1177/0961203312447866.
- Ruffatti A, Tonello M, Hoxha A, Sciascia S, Cuadrado MJ, Latino JO et al. Effect of Additional Treatments Combined with Conventional Therapies in Pregnant Patients with High-Risk Antiphospholipid Syndrome: A Multicentre Study. Thrombosis and haemostasis. 2018. doi:10.1055/s-0038-1632388.
- Del Papa N, Vaso N. Management of antiphospholipid syndrome. Therapeutic advances in musculoskeletal disease. 2010;2(4):221-7. doi:10.1177/1759720X10365969.
- de Larranaga GF, Forastiero RR, Carreras LO, Alonso BS. Different types of antiphospholipid antibodies in AIDS: a comparison with syphilis and the antiphospholipid syndrome. Thrombosis research. 1999;96(1):19-25.
- De Carolis S, Botta A, Salvi S, di Pasquo E, Del Sordo G, Garufi C et al. Is there any role for the hydroxychloroquine (HCQ) in refractory obstetrical antiphospholipid syndrome (APS) treatment? Autoimmunity reviews. 2015;14(9):760-2. doi:10.1016/j.autrev.2015.04.010.
- Viall CA, Chamley LW. Histopathology in the placentae of women with antiphospholipid antibodies: A systematic review of the literature. Autoimmunity reviews. 2015;14(5):446-71. doi:10.1016/j.autrev.2015.01.008.
- Devreese KM. Antiphospholipid antibodies: evaluation of the thrombotic risk. Thrombosis research. 2012;130 Suppl 1:S37-40. doi:10.1016/j.thromres.2012.08.270.
- Knight CL, Nelson-Piercy C. Management of systemic lupus erythematosus during pregnancy: challenges and solutions. Open access rheumatology : research and reviews. 2017;9:37-53. doi:10.2147/OARRR.S87828.
- Song Y, Wang HY, Qiao J, Liu P, Chi HB. Antiphospholipid Antibody Titers and Clinical Outcomes in Patients with Recurrent Miscarriage and Antiphospholipid Antibody Syndrome: A Prospective Study. Chinese medical journal. 2017;130(3):267- 72. doi:10.4103/0366-6999.198934.
- Mekinian A, Loire-Berson P, Nicaise-Roland P, Lachassinne E, Stirnemann J, Boffa MC et al. Outcomes and treatment of obstetrical antiphospholipid syndrome in women with low antiphospholipid antibody levels. Journal of reproductive immunology. 2012;94(2):222-6. doi:10.1016/j.jri.2012.02.004.
- Riancho-Zarrabeitia L, Daroca G, Munoz P, Lopez-Hoyos M, Haya A, MartinezTaboada VM. Serological evolution in women with positive antiphospholipid antibodies. Seminars in arthritis and rheumatism. 2017;47(3):397-402. doi:10.1016/j.semarthrit.2017.05.001.
- Broder A, Putterman C. Hydroxychloroquine use is associated with lower odds of persistently positive antiphospholipid antibodies and/or lupus anticoagulant in systemic lupus erythematosus. The Journal of rheumatology. 2013;40(1):30-3. doi:10.3899/jrheum.120157.
1. Consultorio de Enfermedades Autoinmunes, Trombofílicas y Embarazo, Hospital de Agudos "Dr. Carlos G. Durand", Av. Díaz Vélez 5044, Ciudad de Buenos Aires, Argentina.
2. Laboratorio de Hemostasia y Trombosis, Hospital de Enfermedades Infecciosas "Dr. Francisco J. Muñiz", Uspallata 2272, Ciudad de Buenos Aires, Argentina.
3. Sección de Enfermedades Raras, Centro de investigación “Fundación Respirar”, Av. Cabildo 1548, Ciudad de Buenos Aires, Argentina.
4. Departamento Materno Infantil, Hospital de Agudos “Hospital Fernandez”, Av Cerviño 3356, Ciudad de Buenos Aires, Argentina.