Factores de riesgo y pronósticos en pacientes con cáncer de mama y embarazo
Autores:
Medeot V1, Clavijo J1, Luchini H2, Lopez C1, Rosato O1.
Introducción
El cáncer de mama (CM) es una de las neoplasias malignas más comunes que se presentan durante el embarazo. Afecta entre el 0,2% y el 3,8% de todas las mujeres embarazadas. Esta nefasta asociación generalmente se presenta con tumores en etapas avanzadas por lo que sería necesario conocer qué factores podrían estar asociados a esta especial forma de asociación.
Objetivo
Reconocer factores de riesgo y pronósticos en pacientes con cáncer de mama asociado a embarazo (CMAE) en nuestra población hospitalaria.
Pacientes y método
Estudio retrospectivo y prospectivo de casos controles en pacientes menores de 45 años con diagnóstico de CM (testigo) y pacientes con diagnóstico CMAE (problema) desde el año 2000 al 2019 en el HUMN, FCM, UNC.
Resultados
Se analizaron 124 pacientes con CM menores de 45 años, 24 pacientes con (CMAE) grupo problema y 100 pacientes con (CM) sin embarazo asociado (grupo Testigo). Las pacientes con CMAE resultaron más jóvenes. La menarca se presentó a los 12 años promedio en ambos grupos. Antecedente de gestaciones previas en el 80,6% de todas pacientes (Testigo 80% vs CMAE 83,3%). El 31,5% tuvieron antecedentes familiares de 1° grado de CM, y de 2°grado, la cifra alcanzó el 41,9%; sin diferencia entre series. Tendencia a mayor tamaño tumoral y metástasis en pacientes CMAE respecto a Testigo.
El 50% de CMAE se presentaron con tumores avanzados y el 25% con metástasis de inicio. El Carcinoma Ductal Invasor fue el tipo histológico más frecuente en ambos grupos (88,7%). Mayor frecuencia de tumores indiferenciados en CMAE respecto a Testigo (p<0,05). No se observaron diferencias en cuanto al estado de receptores hormonales y HER2-Neu.
Conclusiones
El CMAE es una asociación compleja tanto para la paciente, su familia y el equipo médico actuante. Debemos agudizar su detección, estar atentos a cualquier modificación en la glándula mamaria durante la gestación o lactancia y tener en cuenta los antecedentes familiares de las pacientes.
Numero citas bibliográficas: 22
Palabras claves: cáncer de mama y embarazo – cáncer de mama en mujeres jóvenes
Introducción
El cáncer de mama (CM) es una de las neoplasias malignas más comunes que se presentan durante el embarazo. Por definición, el cáncer de mama asociado a el embarazo (CME) ocurre durante el embarazo o un año después del parto o durante la lactancia. (1)
El cáncer de mama afecta entre el 0,2% y el 3,8% de todas las mujeres embarazadas. (2)
Debido a que las mujeres actualmente retrasan cada día más su maternidad (más de 30 años) (3) y a la mayor frecuencia de detección en mujeres jóvenes, se puede suponer que la incidencia de los mismos , continuará aumentando en el futuro.(3, 4, 5)
Estos carcinomas con frecuencia se detectan en un estadio avanzado de la enfermedad consecuencia de los cambios inducidos durante el embarazo. (5)
El CM no sigue las relaciones lineales más comúnmente observadas entre la incidencia y la edad, lo que sugiere un papel complejo de varios factores de riesgo en el desarrollo temprano. Los factores de riesgo para desarrollar cáncer a una edad más temprana se asocian a: edad de la menarca, edad en la menopausia, edad del primer embarazo, antecedentes familiares ,etc. (6)
El CM en mujeres jóvenes se diagnostica habitualmente en etapas avanzadas posiblemente debido a diagnóstico tardío, características tumorales desfavorables ( tumores de mayor tamaño, mayor frecuencia de axilas positivas y presencia de metástasis al momento del diagnóstico), así como a mutaciones genéticas y/o antecedentes familiares de CM. (7) Además, en estas pacientes se observan carcinomas más indiferenciados, mayor incidencia de carcinomas invasores y de carcinomas triple negativos. (8)
Objetivo
Reconocer factores de riesgo y pronósticos en pacientes con cáncer de mama y embarazo presentes en nuestra población.
Establecer si existen diferencias entre ambos grupos con respecto a edad de presentación, menarca, gestas previas, antecedentes familiares, tamaño tumoral estadio de presentación, demora diagnostica, tipo histológico, grado histológico e inmunohistoquimica.
Material y método
Para el presente estudio se recurrió a registros y pacientes actuales del Servicio de la 2ª Cátedra de Ginecología del Hospital Universitario de Maternidad y Neonatología de la Universidad Nacional de Córdoba.
De la población completa de pacientes con diagnóstico de CM, tratadas durante el periodo 2000-2019, limitamos nuestra investigación a la cohorte de aquellas que tienen hasta 45 años de edad (jóvenes) al momento de su diagnóstico. De dicha cohorte se seleccionan nuestra serie de casos y controles como se explica a continuación.
La serie de casos se configuró incluyendo todas las pacientes de la cohorte mencionada (CM hasta 45 años) que cumplieran con el criterio diagnóstico de CME. Los datos se obtienen tanto de forma retrospectiva (periodo 2000-2015) como prospectiva (2016 en adelante).
El grupo control (Testigo), configurado por controles concurrentes emparejados en edad, es una muestra no probabilística de pacientes de la misma cohorte de donde se obtuvo la serie de casos, pero sin la condición / exposición a embarazo asociado.
Resultados
Se analizaron 124 pacientes consecutivas con cáncer de mama (CM) con un máximo de 45 años de edad al diagnóstico, atendidas y controladas en el Servicio de Ginecología del Hospital Universitario de Maternidad y Neonatología, entre el 1º enero de 2000 y el 31 de diciembre de 2017; se distinguieron dos series de interés: a) Serie problema (CMAE): 24 pacientes de CM y embarazo asociado y b) Serie Testigo: 100 pacientes con CM sin embarazo asociado.
Se observó que las pacientes con embarazo asociado resultan significativamente más jóvenes que sus pares sin embarazo (tabla 1).Siendo la mediana de 33 años para CMAE vs 39.5 años ´para la serie Testigo con una p < 0.001.
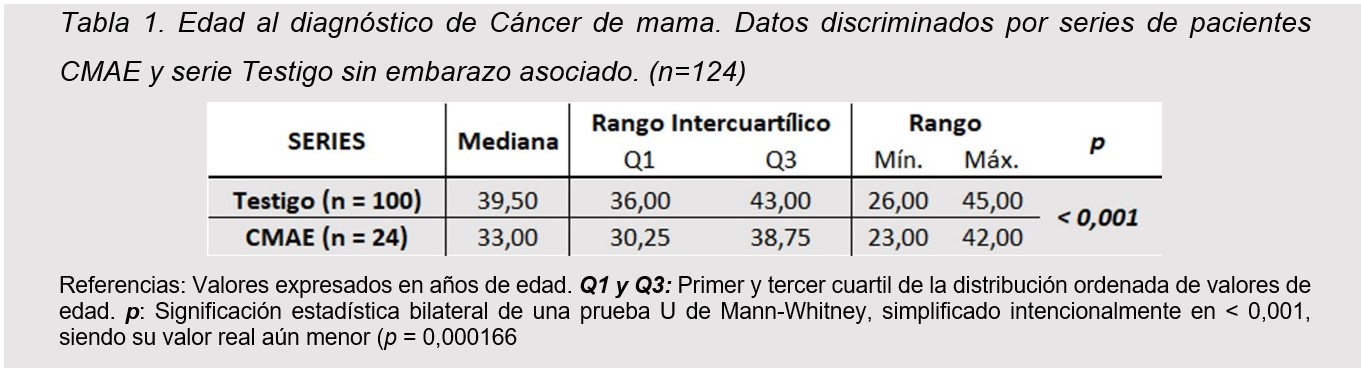
La mediana para menarca de la muestra se ubicó en los 12 años de edad (RIC 12-13 años), dentro de un rango comprendido entre los 8 y 16 años, sin diferencia entre pacientes con y sin embarazo asociado (tabla 2).

El antecedente de gestaciones previas estuvo presente en 80,6% de todas pacientes analizadas, sin diferencias significativas (Testigo 80% vs 83,3% CMAE). El 31,5% de la cohorte (n=39) tuvieron antecedentes familiares en primer grado de CM, al considerar filiación de segundo grado la cifra alcanza 52 casos (41,9%); sin diferencia de consideración entre series de interés. (tabla 3)
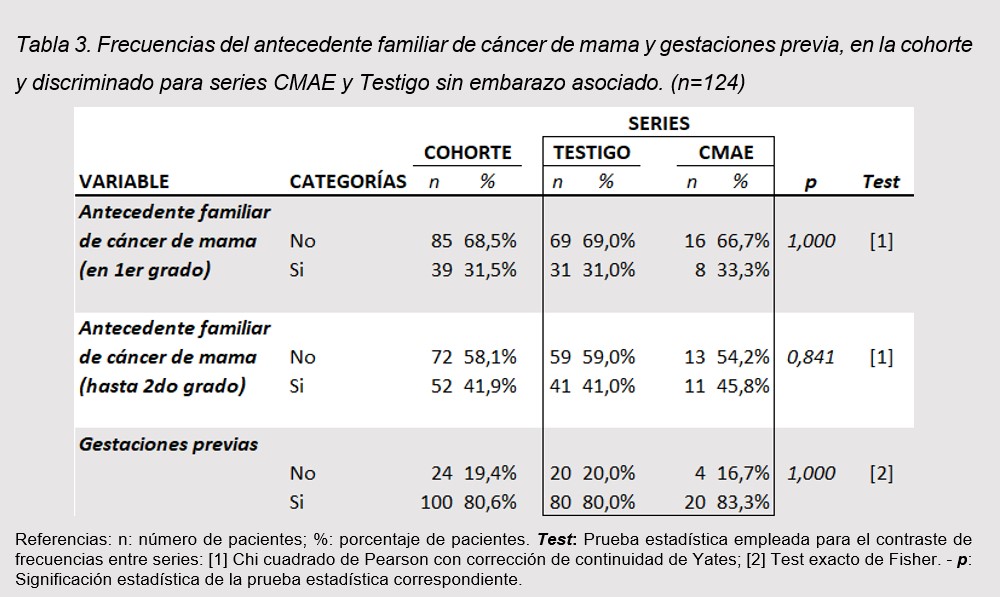
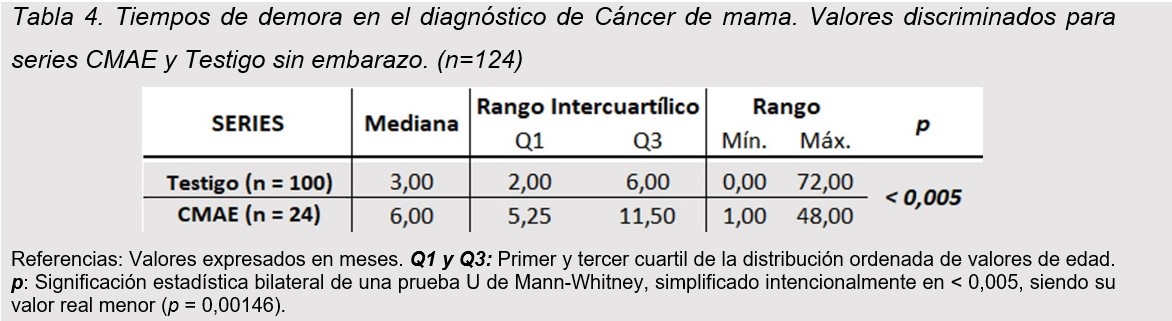
El tiempo de demora en el diagnóstico resultó significativamente mayor en pacientes de la serie CMAE (6 meses; RIC 5,25-11,5 meses) respecto a la serie Testigo (3 meses; RIC 2-6 meses) (p < 0,005). (tabla 4)
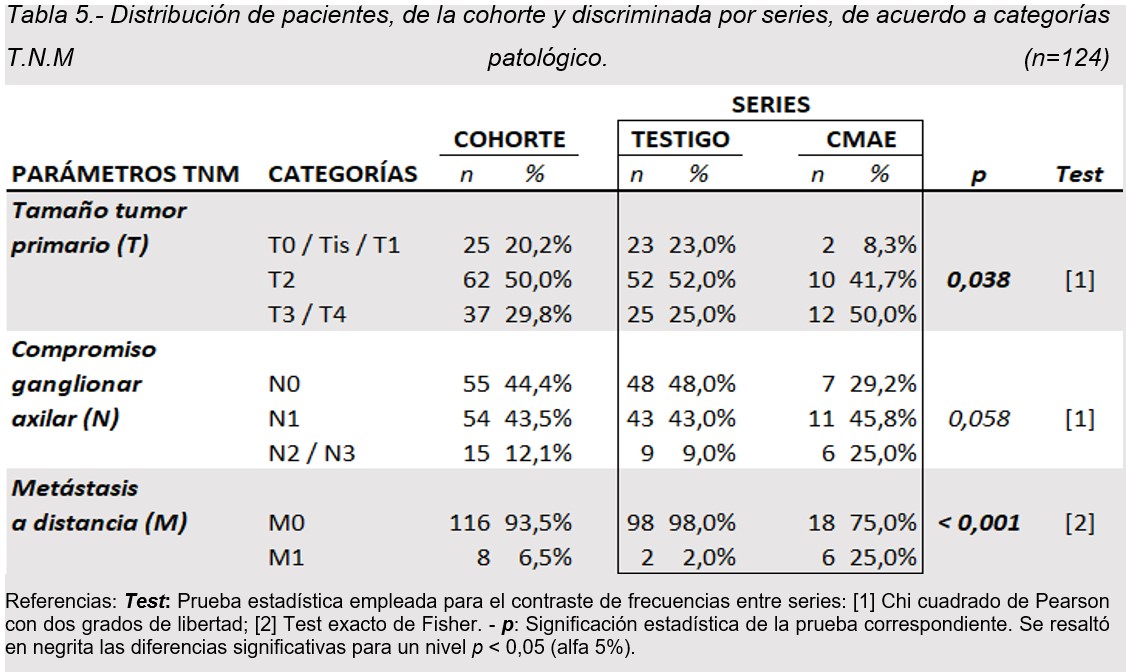
En tabla 5 se muestra la distribución de las pacientes (global, testigo y CMAE), entre las distintas categorías de cada parámetro TNM patológico. Se observó una tendencia significativa a peor clasificación en tamaño tumoral y mayor frecuencia de metástasis en pacientes CMAE respecto a serie Testigo. El 50% de CMAE vs 25% de Testigo fueron clasificadas T3/T4, y el 8,3% vs el 23% presentaron tumores menores a 2 cm (p <0,05). Por otro lado, el 25% de los CMAE presentaron metástasis de inicio en relación al 2% de las Testigo p<0,001.
La tabla 6 y figura 1 muestran la distribución de pacientes analizadas de acuerdo a estadios del cáncer por criterios AJCC, donde se pueden apreciar las diferencias entre ambas series.
Se destaca la elevada frecuencia relativa de estadios IV entre pacientes CMAE, la cual sería hasta 4 veces superior a la frecuencia esperada por simple azar. Además, también se observó mayor frecuencia relativa de estadios III. Se decidió reagrupar los estadios en dos estratos: a) “Estadios avanzados” (estadios III y IV), y b) “Estadios no avanzados” (estadios más tempranos a III). Se halló “estadio avanzado” en 54,2% CMAE vs 24% de las pacientes Testigo (Chi cuadrado con corrección de Yates, p=0,008).

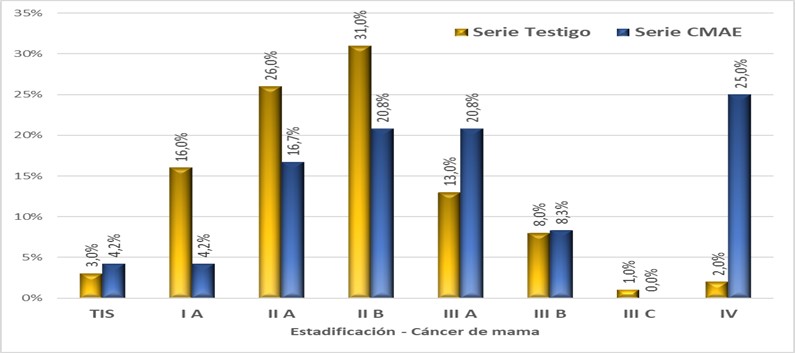
Figura 1.- Distribución de pacientes de acuerdo a estadios de la American Joint Committee on Cancer para Cáncer de mama, discriminado para serie CMAE (n=24) y serie Testigo de CM sin embarazo asociado (n=100). Los valores se representan en porcentaje de casos. (n=124)
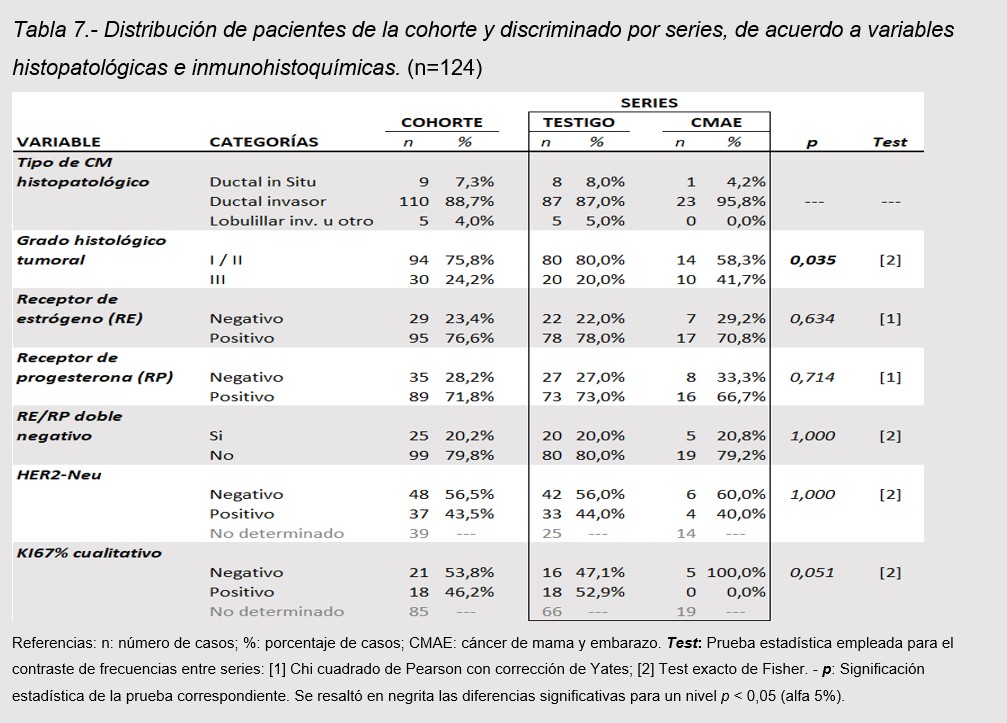
El Carcinoma Ductal Invasor (CDI) fue el tipo histológico más frecuente, presente en 88,7%; (95,8% CMAE y el 87% Testigo p=0,301). Le siguió en frecuencia el Carcinoma Ductal in situ (CDIS), 7,3%, el Carcinoma Lobulillar Invasor (CLI) y un caso de Carcinoma Tubular. En cuanto a grado de diferenciación tumoral, se observó una frecuencia relativa mayor de tumores indiferenciados Grado III en CMAE respecto a Testigo (41,7% vs 20% respectivamente; p<0,05). No se observaron diferencias significativas entre series en cuanto a estado de receptores hormonales y HER2-Neu. El marcador Ki67% cualitativo se estudió en sólo 39 pacientes de la cohorte (31,5%). (tabla 7)
Discusión
El cáncer de mama y embarazo es una asociación que por los cambios en el estilo de vida y culturales (retardo en la maternidad, mejores métodos diagnósticos entre otros) cada vez veremos con mayor frecuencia. (3,4,6).
En nuestro estudio el 19.3% de las pacientes menores de 45 años presentó esta asociación siendo más frecuente que lo reportado por otros autores la cual varía de 2.6% al 15.6% (9,10, 11,)
Las pacientes con CMAE resultaron más jóvenes que sus pares sin embarazo, (33 años vs 39.5 p < 0,001), datos que se equiparan a los reportados por Genin y Matos (9,12) siendo más jóvenes que lo descripto por Azim en un metaanálisis cuya edad media de presentación fue de 36 años (13).
La mediana para la menarca se ubicó en los 12 años de edad, r: 8 y 16 años, sin diferencia entre pacientes con y sin embarazo asociado, lo que coincide con la literatura en general(14)
El antecedente de gestaciones previas estuvo presente en 80,6% de todas pacientes analizadas, sin diferencias significativas (Testigo 80% vs CMAE 83,3%) lo que significa bajo nivel de pacientes nulíparas; esto podría estar relacionado con los nuevos estudios que sugieren que los cambios que se producen por la lactancia promoverian condiciones favorables para el desarrollo del cáncer de mama hasta 10 años posteriores al embarazo (15)
El 33,3 % de las pacientes con CME tuvieron antecedentes familiares en primer grado de CM sin diferencias con las pacientes CM que presentaron antecedentes familiares en el 31% de los casos, al considerar filiación de segundo grado la cifra alcanza el 45,8% vs el 41 en las sin embarazo asociado, no llegando a ser una diferencia significativa entre ambos. Sin embargo, es de gran importancia que las pacientes menores de 45 años con antecedentes familiares de 1 o 2 grados tienen un rango de riesgo de 2,5 veces mayor de presentar un cáncer de mama a edad temprana por lo que es necesaria un control más exhaustivo y temprano que la población general (16).
El tiempo de demora en el diagnóstico resultó significativamente mayor en pacientes con CMAE (6 meses) respecto a la serie Testigo (3 meses) p < 0,005. Esto podría deberse a los cambios propios en la glándula mamaria durante la lactancia que podrían ocultar lesiones, falta de screening mamario durante el embarazo, entre otros. Esta demora diagnostica podría conllevar una peor sobrevida. Nuestra demora diagnostica fue mayor que la informada por Toesca que reportan una demora diagnóstica de entre 1 a 3 meses (17).
Se observó una tendencia significativa de tumores más avanzados y mayor frecuencia de metástasis en pacientes CMAE. En cuanto al tamaño tumoral el 50% de CMAE fueron diagnosticados como tumores T3/ T4 vs el 25% de los testigos, mientras sólo el 8,3% de los CMAE fueron clasificadas T0/T1 vs el 23% respectivamente (p <0,05).
En relación al compromiso axilar, ambos grupos presentaron alta incidencia de axilas positivas, 70% CMAE vs 52% Testigo p<0,058. Por otro lado 25 % de los CMAE presentaron metástasis de inicio en relación al 2 % de las Testigo p<0,001.
Estos datos se correlación con lo reportado en numerosos estudios donde observaron que las pacientes con CMAE presentaban tumores más grandes con mayor numero de axilas positivas y mayor frecuencia de metástasis de inicio. (9.13.17.18.19.20)
Se destaca la elevada frecuencia de estadios IV entre pacientes CMAE, la cual sería hasta 4 veces superior a la esperada por simple azar.
Se decidió reagrupar los estadios en dos estratos: a) “Estadios avanzados” (estadios III y IV), y b) “Estadios no avanzados” (estadios I y II). Se observo que el 54.2% de las pacientes con CMAE presentaban “estadio avanzado” vs 24% de las pacientes Testigo p=0,008. Esto está en relación con lo que refiere la literatura y los metaanálisis (9.12.13.19.20)
En cuanto al tipo histológico el 95 % de los CMAE fueron ductales invasores. El 41.7% de los CMAE fueron tumores indiferenciados G III en contrapartida con el 20 % presente en los no asociados, p<0,05. Esto se correlaciona con lo descripto en la literatura (20 21.22) que describen alta prevalencia de carcinomas ductales invasores y la mayoría de dichos tumores indiferenciados.
No se observaron diferencias significativas entre series en cuanto a estado de receptores hormonales y HER2-Neu.Las pacientes de CMAE tenían receptor estrogénico negativo en el 30% receptor progestinico negativo en un 33%, ambos receptores negativos en un 20% y el HER 2 positivo en un 40%. El marcador Ki67% cualitativo se estudió en 39 pacientes de la cohorte (31,5%) de ellas en las 5 pacientes de CMAE en las que se realizó la detección resultó negativo. Estos datos no se condicen con los publicados por Genin (9) Raphael (19), Azim (13) y Johanson (18) los cuales reportan tumores con alto porcentaje de receptores negativos, alta expresión del Her 2 y alto porcentaje de expresión de Ki 67.
Conclusiones
Dentro del grupo de cáncer de mama en pacientes jóvenes (menores de 45 años) la asociación de CMAE se presentó en el 19.3 % de los casos.
Nuestras pacientes con CMAE fueron más jóvenes que el grupo control con una mediana de 33 años.
La mediana de la menarca en ambos grupos se presento a los 12 años.
Alrededor del 20 % de las pacientes de ambos grupos eran nulíparas.
El 33,3 % de las pacientes con CME tuvieron antecedentes familiares en primer grado de CM sin diferencias con las pacientes Testigo, al considerar filiación de segundo grado la cifra alcanza el 45,8% vs el 41 no llegando a ser una diferencia significativa entre ambos. Es un porcentual importante de pacientes jóvenes con antecedentes familiares, por lo que sería conveniente, en estas mujeres realizar controles más estrictos y paneles genéticos para detección de mutaciones germinales.
La demora diagnóstica fue el doble entre ambos grupos siendo de 3 meses Testigo y de 6 meses en CMAE. Esto podría deberse a la falta de screening, miedo propio de las pacientes en esta etapa, cambios en la glándula durante la gestación, poco entrenamiento en la detección y pesquisa de esta asociación por parte del equipo médico, entre otras.
Como en la mayoría de los trabajos publicados encontramos tumores de mayor tamaño, mayor numero de axilas positivas, tumores más indiferenciados lo que nos lleva a estadios más avanzados y mayor numero de metástasis de inicio.
En cuanto a la relación de tumores con baja expresión de los receptores hormonales o triples negativos, alta expresión del HER2 y sobreexpresión de KI 67 nuestra serie no mostro esta tendencia.
Asociación compleja, tanto para la paciente, su familia y el equipo médico tratante, debemos agudizar su detección, pensarla ante cualquier modificación en la glándula mamaria durante la gestación o lactancia y tener en cuenta los antecedentes familiares de las pacientes.
Bibliografia
- Pirvulescu C, Mau C, Schultz H, Sperfeld A, Isbruch A, Renner-Lützkendorf H, et al. Breast Cancer during Pregnancy: An Interdisciplinary Approach in Our Institution. Breast Care (Basel). agosto de 2012;7(4):311–4.
- Zhang J, Zhou Y-J, Yu Z-H, Chen A-X, Yu Y, Wang X, et al. Identification of core genes and clinical roles in pregnancy-associated breast cancer based on integrated analysis of different microarray profile datasets. Bioscience Reports. el 28 de junio de 2019;39(6):
- Nettleton J, Long J, Kuban D, Wu R, Shaefffer J, El-Mahdi A. Breast cancer during pregnancy: quantifying the risk of treatment delay. Obstet Gynecol. marzo de 1996;87(3):414–8
- Loibl S, Schmidt A, Gentilini O, Kaufman B, Kuhl C, Denkert C, et al. Breast Cancer Diagnosed During Pregnancy: Adapting Recent Advances in Breast Cancer Care for Pregnant Patients. JAMA Oncol. noviembre de 2015;1(8):1145–53.
- Goller SS, Markert UR, Fröhlich K. Trastuzumab in the Treatment of Pregnant Breast Cancer Patients - an Overview of the Literature. Geburtshilfe Frauenheilkd. junio de 2019;79(6):618–25.
- Molckovsky A, Madarnas Y. Breast cancer in pregnancy: a literature review. Breast Cancer Res Treat. abril de 2008;108(3):333–8.
- Kheirelseid EA, Boggs JM, Curran C, Glynn RW, Dooley C, Sweeney KJ, et al. Younger age as a prognostic indicator in breast cancer: A cohort study. BMC Cancer. diciembre de 2011;11(1):383.
- Edge SB, Compton CC. The American Joint Committee on Cancer: the 7th edition of the AJCC cancer staging manual and the future of TNM. Ann Surg Oncol. junio de 2010;17(6):1471–4.
- Genin AS, Lesieur B, Gligorov J, Antoine M, Selleret L, Rouzier R. Pregnancy-associated breast cancers: do they differ from other breast cancers in young women? Breast. 2012 Aug;21(4):550-5.
- Andersson T.M.,Johansson A.L.,Hsieh C.C.,Cnattingius S.,Lambe M.Increasing incidence of pregnancy-associated breast cancer in Sweden.Obstet Gynecol. 2009; 114: 568-572
- Lethaby, A.E., O'Neill, M.A., Mason, B.H., Holdaway, I.M. and Harvey, V.J. (1996), Overall survival from breast cancer in women pregnant or lactating at or after diagnosis. Int. J. Cancer, 67: 751-755.
- Matos E, Ovcaricek T. Breast cancer during pregnancy: retrospective institutional case series. Radiol Oncol. 2021 May 4;55(3):362-368. doi: 10.2478/raon-2021-0022. PMID: 33939895; PMCID: PMC8366736.
- Azim HA, Santoro L, Russell-Edu W, Pentheroudakis G, Pavlidis N, Peccatori FA. Prognosis of pregnancy-associated breast cancer: a meta-analysis of 30 studies. Cancer Treat Rev. noviembre de 2012;38(7):834–42.
- Howell A, Anderson AS, Clarke RB, Duffy SW, Evans DG, Garcia-Closas M, Gescher AJ, Key TJ, Saxton JM, Harvie MN. Risk determination and prevention of breast cancer. Breast Cancer Res. 2014 Sep 28;16(5):446
- Polyak K. Pregnancy and breast cancer: the other side of the coin. Cancer Cell. 2006 Mar;9(3):151-3.
- Brewer HR, Jones ME, Schoemaker MJ, Ashworth A, Swerdlow AJ. Family history and risk of breast cancer: an analysis accounting for family structure. Breast Cancer Res Treat. 2017 Aug;165(1):193-200.
- Toesca A, Gentilini O, Peccatori F, Azim HA Jr, Amant F. Locoregional treatment of breast cancer during pregnancy. Gynecol Surg. 2014;11(4):279-284
- Johansson A.L.V. Andersson T.M. Hsieh C.C. Jirstrom K. Cnattingius S. Fredriksson I.et al.
- Tumor characteristics and prognosis in women with pregnancy-associated breast cancer.Int J Cancer.2018; 142: 1343-1354
- Raphael J, Trudeau ME, Chan K. Outcome of patients with pregnancy during or after breast cancer: a review of the recent literature. Curr Oncol. 2015 Mar;22(Suppl 1):S8-S18
- Parente JT, Amsel M, Lerner R, Chinea F. Breast cancer associated with pregnancy. Obstet Gynecol.1988; 71: 861–864
- Middleton LP, Amin M, Gwyn K, Theriault R, Sahin A. Breast carcinoma in pregnant women: assessment of clinicopathologic and immunohistochemical features. 2003 Sep 1;98(5):1055-60. doi: 10.1002/cncr.11614. PMID: 12942575.
1. II° Cátedra de Clínica Ginecológica1 – I° Cátedra de Clínica Obstétrica y Perinatología2.
Hospital Universitario de Maternidad y Neonatología Facultad de Ciencias Médicas
Universidad Nacional de Córdoba