Aspectos biológicos y legales de la donación de sangre de cordón fetal en Argentina.
Biological and Legal aspects of umbilical cord blood donation in Argentina
Autores:
Mirta Gisela Reynaga1
Resumen
Se estima que entre 10.000 y 15.000 pacientes con neoplasias hematológicas no encuentran un donante compatible, o no tienen tiempo suficiente para encontrarlo por la rápida progresión de la enfermedad. En estos casos, la sangre de cordón umbilical (SCU) podría ser una opción para el trasplante de células madre sanguíneas. La donación de SCU en Argentina, no encuentra suficiente esclarecimiento en la normativa existente. El objetivo de este artículo fue esclarecer bajo una perspectiva transdisciplinar y comparada con el caso español, los aspectos biológicos y legales de la donación de SCU en Argentina para su comprensión, valoración y toma de decisión por parte de los múltiples actores público privados involucrados. Se utilizó para este análisis una revisión sistemática de literatura biomédica, y jurídica. Se concluyó que no existe articulación en los sectores públicos y privados para la gestión del recurso de trasplante de manera ética, segura, eficiente y sostenible.
Abstract
It is estimated that between 10.000 and 15.000 patients with hematologic neoplasia do not find a compatible donor, or do not have enough time to find one due to the rapid progression of the disease. In these cases, umbilical cord blood (UCB) might become an option for blood stem cell transplantation. The UCB donation in Argentina does not find enough understanding in the existing regulations. The aim of this paper was to clarify, from a transdisciplinary and comparative perspective to the Spanish case, the biological and legal aspects of the UCB donation in Argentina for its understanding, assessment and decision making by the multiple public private actors involved. A systematic review of biomedical and legal literature was evidenced for this analysis. It was concluded that an articulation in public and private sectors for management of transplant resource does not exist in an ethical, safe, efficient and sustainable ground
Palabras claves: Trasplante; transfusión; sangre umbilical; célula madre.
Keywords: Transplant; transfusion; umbilical blood; stem cell.
1. Introduccion
La donación de sangre de cordón fetal o umbilical (SCU) es una práctica médica que se llevó acabo por primera vez en el año 1988 en el Hospital de Saint Louis de París, en un niño, Matthew Farrow, de 5 años de edad que padecía Anemia de Fanconi (una enfermedad hereditaria autosómica recesiva caracterizada por mutaciones en los genes FANC, que se traduce en defectos para reconocer y reparar el ADN dañado), y la donante fue su hermana recién nacida. Ésta primera donación exitosa de células progenitoras hematopoyéticas (CHP) provenientes de la sangre de cordón fetal fue fruto de un trabajo colaborativo internacional, ya que Matthew y su familia eran de Carolina del Norte en Estados Unidos, el trasplante se realizó en un Hospital de Francia (Paris), el microbiólogo Dr. Hal Broxmeyer norteamericano fue quien almacenó la sangre de la donante recién nacida, y finalmente fue la francesa Dra. Eliane Glukman quién llevo adelante el primer trasplante de sangre de cordón umbilical.
Según la Asociación Mundial de Donantes de Médula Ósea (World Marrow Donor Association, WMDA), cada año, miles de pacientes son diagnosticados con una enfermedad que puede requerir tratamiento con un trasplante de células madre sanguíneas o hematopoyéticas. Estas células madre provienen tradicionalmente de la donación de médula ósea, ya sea de un familiar o de un donante no relacionado. Sin embargo, se estima que entre 10.000 y 15.000 pacientes al año no pueden encontrar un donante que sea lo suficientemente compatible entre los millones de donantes que figuran en la base de datos mundial. Otros pacientes no tienen suficiente tiempo para encontrar un donante adulto no emparentado debido a la rápida progresión de su enfermedad. En estos casos, la sangre del cordón umbilical puede ser una opción para el trasplante de células madre sanguíneas (1).
En Argentina se diagnostican más de 2.900 casos de leucemia por año, cifra que equivale a un promedio de ocho casos por día, según el último informe del Registro Institucional de Tumores de Argentina (2). La leucemia aguda es la neoplasia más común en la infancia, y representa el 27% de las neoplasias malignas, siendo el pico de incidencia entre los 2 y 5 años de edad (3). Y la leucemia mieloide crónica, rara en niños y adolescentes, es la más común en adultos de entre 50 y 60 años de edad, y representa el 20% de todos los casos de leucemia en adultos (4). Para éstas enfermedades neoplásicas, además de otras patologías, la SCU posee una indicación clínicamente aprobada y constituye un mejor tratamiento frente a otros.
La legislación biojurídica sobre trasplantes en argentina, podríamos dividirla en dos, debido al carácter de órganos, tejidos y células provenientes de un cadáver o de una persona humana viva. En el caso que nos ocupa, de la sangre de cordón umbilical, nos referimos a un donante vivo, una persona humana recién nacida, que posee un interés delegado en sus tutores legales (padres). El recién nacido, pudiera constituirse en uso de su propio interés, y ser él mismo donante y receptor (donación autóloga, o autotrasplante), o en función del interés de otro (donación alogénica), y de ésta situación particular surgen los problemas bioéticos y jurídicos.
La guarda de la SCU en Argentina se puede realizar en bancos privados o en el único banco público que poseemos, que tiene su sede en el Hptal. Profesor Dr. Juan P. Garrahan. El funcionamiento de los mismos, actualmente en Argentina, presentan una disociación irreconciliable, a partir del fallo de la Corte Suprema de la Nación Argentina en el año 2014 (5). En consecuencia, el objetivo de este trabajo fue brindar una mirada transdisciplinar (ética, biomédica y jurídica), que la comunidad médica debe abordar, para el adecuado asesoramiento de los padres en la toma de decisiones, respetando sus derechos de autonomía, sin perder el sustento de la solidaridad y subsidiariedad, que caracterizan el acto de la donación (6).
En el análisis de las propiedades biológicas de la SCU para trasplante, y su proceso de recolección y guarda, se concluyó en la importancia de la decisión suficientemente informada por parte de los padres y profesionales intervinientes, de su guarda en un banco privado o público, de acuerdo a la legislación actual en argentina y la futura-real utilización de la misma. Además, de la necesidad de una revisión jurídica, en beneficio de todos, luego de una comparativa con la legislación española actual en torno a la donación de SCU.
2. Método
Para lograr el objetivo planteado, se trabajó con fuentes primarias y secundarias, a saber:
- Fuente Primaria: Se realizó entrevista telefónica focalizada a tres bancos privados existentes en Argentina, Matercell (sede en la ciudad Autónoma de Buenos Aires) y Protectia (sede en Córdoba), y Biocells (sede en la ciudad Autónoma de Buenos Aires), ya que son los únicos tres de los siete existentes en Argentina, que poseen certificación ISO9001, para conocer información referida a costos de recolección y conservación anual de muestra de SCU, proceso posterior en caso de utilización de la muestra, y tiempo máximo de guarda.
- Fuentes Secundarias:
Se realizó búsqueda bibliográfica en base de datos Nacionales, como el Instituto Nacional Central Único Coordinador de Ablación e Implante (INCUCAI), el Instituto Nacional del Cáncer (INC), y estadísticas del Sistema Nacional de Información de Procuración y Trasplante de la República Argentina (SINTRA).
Además, se trabajó con bases de datos extranjeras, de la Asociación Mundial de Donantes de Médula Ósea (WMDA), del Ministerio de Sanidad de España y su organismo coordinador la Organización Nacional de Trasplantes (ONT).
En cuanto a la bibliografía biomédica se utilizó como motor de búsqueda Google Académico, mediante las siguientes palabras clave en castellano y en inglés: trasplante, trasfusión, células madre, células progenitoras hematopoyéticas, sangre de cordón umbilical, sangre fetal, quimerismo, cáncer, enfermedad injerto contra huésped, autotrasplante, aloinjerto, trasplante alogénico, almacenamiento de sangre.
La legislación argentina fue consultada de la base de datos de Información Legislativa y Documental (InfoLEG), y el Sistema Argentino de Información Jurídica (SAIJ).
3. Desarrollo
3.1. Características Biológicas de la Sangre de Cordón Umbilical
A pesar de que en la literatura científica hablamos de trasplante de sangre de cordón umbilical (SCU), en realidad, también se podría aceptar la denominación de trasfusión de SCU, ya que trasplante designa una sustitución de un órgano o tejido enfermo por otro que funcione adecuadamente, mientras que transfusión hace referencia al procedimiento de administrar sangre o sus componentes directamente en el torrente sanguíneo del paciente receptor.
La SCU posee cifras elevadas de hematíes (glóbulos rojos), condicionado por la hipoxia que se experimenta al momento del nacimiento (contracciones uterinas, mediadas por la oxitocina) y el aporte sanguíneo extra de la placenta (7), por lo que nos encontramos con hematocrito de 51+- 9 % y hemoglobina de 16,5 +- 3 gr/dl, con un volumen corpuscular medio de 108+- 10 fl (fentolitros). Los reticulocitos (glóbulos rojos inmaduros) se encuentran con valores de 3-6%.
Con respecto a los glóbulos blancos, tendremos una leucocitosis (aumento de glóbulos blancos) de 18.000 mm3 (+-10.000-30.000) con inversión de la fórmula leucocitaria y desviación a la izquierda (8); es decir, predominio de linfocitos por sobre los neutrófilos, y éstos a su vez en sus formas inmaduras (neutrófilos con su núcleo en cayado). Así tendremos un 60-70% de linfocitos, y un 30% de neutrófilos.
Las plaquetas en SCU, también se encuentran aumentadas en referencia a valores de un adulto (valor de 150.000 a 450.000 por mm3), además se pueden encontrar plaquetas inmaduras denominadas plaquetas reticulares (9).
Las células de SCU que se utilizan para el trasplante, son las denominadas células progenitoras hematopoyéticas (CPH). La CPH es una célula que mide entre 15 a 25 micras, es decir, son más grandes que un glóbulo rojo (6-8ug) y glóbulo blanco maduro (8-12ug). Presenta un núcleo agrandado que se tiñe de color azul, con la tinción de hematoxilina-eosina, y un citoplasma que se tiñe de color gris azulado; el núcleo es gigante dejando sólo un halo de citoplasma alrededor, que contiene las mitocondrias y ribosomas libres (10, 11). Las CPHs dan origen a todas las otras células maduras de la sangre, por eso también son denominadas “células madre”.
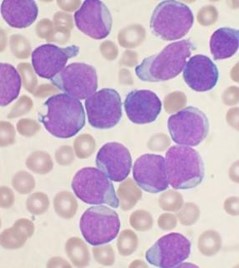
Gráfico 1: Frotis de SCU con tinción hematoxilina-eosina de células madre.
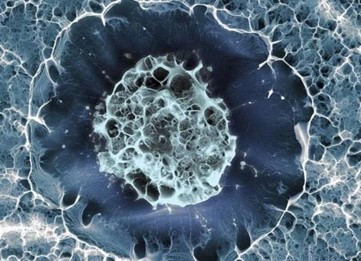
Gráfico 2: Célula madre vista con microscopio electrónico.
El recién nacido además de ser donante de CPHs, lo es de células madre mesenquimales que se encuentran en la gelatina de Wharton del cordón umbilical. Las CPHs son las que darán origen a todas las células de la sangre y el sistema inmune, y las células madre mesenquimales, pueden dar origen a tejido óseo, cartilaginoso y graso, aunque despiertan hoy en día muchas especulaciones, en cuanto a que éstas últimas carecen de marcadores genéticos (12, 13). Las CPHs, a diferencia de las células madre mesenquimales, sí presentan en su membrana citoplasmática un marcador distintivo, que es una glicoproteína transmembrana altamente glicosilada de 110 kD, denominada CD34+. La glicoproteína CD34+ está codificada por el gen CD34 localizado en el brazo corto del cromosoma 1 (1q32.2), y podemos encontrarla además de en las células progenitoras hematopoyéticas, en células endoteliales capilares y en células del estroma de la médula ósea (14, 15).
La cantidad de CPHs en la SCU, corresponde al 1-2% de todas las células mononucleares (células que poseen un solo núcleo) (16). El recuento celular en los laboratorios es a través de la citometría de flujo, cuyos resultados si son reproducibles; a diferencia del uso de marcadores para detectar CD34+ en las células, que resulta muy variable de laboratorio en laboratorio, por lo que no es una forma adecuada de contabilizar las células progenitoras hematopoyéticas en forma comparativa (17).
Además de hacer un cálculo referencial de la cantidad de CPHs presentes en la SCU por citometría de flujo, es necesario confirmar que las mismas están presentes y son capaces de ejercer su efecto terapéutico. Para ello, se realiza una prueba de Unidad Formadora de Colonia (UFC), que cosiste en tomar una pequeña cantidad de la muestra de sangre de cordón umbilical y cultivarla, y evaluar luego la reproducción celular y formación de colonias, para finalmente contabilizarlas en forma automatizada (18).
Se considera una unidad de sangre de cordón umbilical apta para trasplante si presenta las siguientes condiciones (19, 20, 21, 22):
- Volumen de 40-250 mililitros.
- Recuento de leucocitos de 10x108 por mililitro.
- Recuento de células CD34+ de 3x10
- Recuento de unidades formadoras de colonias (UFC) de granulocitos y monocitos de 5x105.
Más del 90% de las muestras de sangre de cordón fetal califican como aptas, considerando estos criterios citológicos; ya que, si recolectamos por ejemplo unos 100 mililitros de sangre de cordón fetal, allí tendremos un total de 18.000 leucocitos por milímetro cúbico, es decir un total de 1.800.000.000 en los 100 mililitros, es decir 18x108. Además, sabemos que el 1% de esos leucocitos corresponden a células progenitoras hematopoyéticas, que serían en total de 18.000.000, es decir 18x106 células CD34+. Luego, el recuento de las UFC se realiza por medio de maquinaria automatizadas, que cumpliría con creces los requisitos para ser una muestra apta para trasplante.
Sin embargo, existen otros criterios de índole obstétrico, que resultan en la exclusión de las muestras de SCU.
Se excluyen de la recolección, procesamiento o guarda, las unidades de SCU que presenten (23, 24):
- Hallazgos positivos para enfermedades infecciosas.
- Pertenezcan a dadores menores de 32 semanas (partos prematuros).
- Eventos obstétricos adversos durante el parto vaginal o parto por cesárea como fiebre materna mayor a 38 grados centígrados, trabajo de parto vaginal prolongado con sufrimiento fetal, presencia de líquido meconial, desprendimiento prematuro de placenta normoinserta.
- Patologías del embarazo como inmunización feto-materna en los casos de incompatibilidad ABO o Rh, restricción de crecimiento intrauterino (RCIU).
3.2. Proceso de Recolección, Tipificación, Criopreservación y guarda de SCU.
La recolección de SCU se realiza al momento del parto vaginal o de la cesárea programada, preferiblemente embarazos mayores de 34 semanas de gestación. El cordón umbilical mide en promedio unos 50 centímetros de longitud, y constituye la comunicación vascular entre el feto y la placenta. Una vez que se produce el nacimiento, se procede al pinzamiento del cordón umbilical entre el primer y tercer minuto, dejando entre 5-10 centímetros de cordón unidos al recién nacido. Se entrega el recién nacido al servicio de Neonatología, mientras se inicia la recolección de la sangre de cordón fetal, colocando un catéter en la vena umbilical.
La sangre que se recolecta va inmediatamente a una bolsa estéril con anticoagulante, para lograr la separación de las células del plasma. Mientras la sangre va recolectándose se espera sin hacer ninguna maniobra manual activa, el alumbramiento de la placenta, es decir su desprendimiento del cuerpo uterino, de manera tal que se aumenta la cantidad de sangre recolectada, y se evita “exprimir” en cordón umbilical.
Una vez recolectada la SCU, es trasportada al laboratorio a temperatura ambiente, sin sobrepasar los límites que son entre 4°C y 30°C. Las unidades de CPHs serán procesadas y congeladas a temperaturas por debajo de los -180°C, inmersas en nitrógeno líquido dentro de las 36 horas de obtenida la muestra (25, 26, 27).
El procesamiento de las muestras de SCU antes de ser congeladas consiste en cumplir con los protocolos a nivel nacional e internacional. En Argentina, el organismo encargado de fijar dichas normas es el INCUCAI (creado por ley 23.885, en el año 1990). El Instituto Nacional Central Único Coordinador de Ablación e Implante (INCUCAI) es el organismo descentralizado con autarquía, que impulsa, normaliza, coordina y fiscaliza las actividades de donación y trasplante de órganos, tejidos y células en Argentina. Así, las normas referidas a los estudios que deben realizarse en la sangre de cordón umbilical destinadas a trasplante, se especifican en su Resolución 319/04 (28, 29, 30), y establecen lo siguiente:
- Recuento total y diferencial de células sanguíneas para incluir leucocitos y glóbulos rojos nucleados.
- La concentración de células CD34+ y/o número total de células formadoras de colonias hematopoyéticas.
- Los cultivos bacterianos de unidades de células progenitoras hematopoyéticas de sangre de cordón umbilical (CPH-SCU) serán realizados en una muestra de CPH-SCU obtenida luego del procesamiento, utilizando un sistema que permita el crecimiento aeróbico y anaeróbico de bacterias y hongos.
- Los resultados de los estudios microbianos positivos incluirán la identidad de los organismos. Habrá capacidad para realizar pruebas de sensibilidad a los antibióticos para bacterias aeróbicas, previo al envío de la unidad de CPH-SCU para el trasplante.
- Estos resultados serán informados al Centro de Trasplante prospectivo.
- Tipificación ABO y Rh.
- Tipo de antígeno leucocitario humano (HLA).
- Se determinarán los antígenos de los loci HLA-A, HLA-B y HLA-DRB 1.
- Pueden determinarse los antígenos HLA-C, HLA- DQA y HLA-DQB.
- Se puede realizar la identificación de los antígenos HLA Clase I, loci A, B y C mediante método serológico. Los resultados ambiguos serán confirmados por técnicas de ADN. Todas las tipificaciones Clase II, locus DR serán realizados mediante técnicas de ADN.
- Se determinará Anti-HIV-1 (anticuerpo contra Virus de Inmunodeficiencia Humana 1), anti-HIV-2 (anticuerpo contra Virus de Inmunodeficiencia Humana 2), HIV-1-Ag P24 (antígeno P24 del Virus de Inmunodeficiencia Humana 1), Anti-HTLV (anticuerpo contra Virus Lipotrópico Humano), HbsAg (antígeno de superficie del Virus de Hepatitis B), AntiHBc (anticuerpo contra el core o núcleo del virus de Hepatitis B), anti-HCV (anticuerpo contra el virus de Hepatitis C), anti-CMV (anticuerpo contra Citomegalovirus), pruebas serológicas para sífilis, Brucelosis, Chagas y cualquier otro ensayo requerido por las normas actuales vigentes para el estudio de marcadores de ITT (Infecciones Trasmisibles por Trasfusión) en donantes de sangre.
- El estudio de hemoglobina por electroforesis se realizará cuando la historia familiar lo indique.
3.3. Tipificación HLA en CPHs de SCU.
El sistema HLA (Antígenos Leucocitarios Humanos), hace referencia a los genes del Complejo Mayor de Histocompatibilidad (MHC), localizados en el brazo corto del cromosoma 6. La respuesta inmune contra antígenos HLA representa la principal barrera al trasplante de órganos y de células progenitoras hematopoyéticas. En la actualidad, los principales centros de trasplante, así como los Bancos de Células de Cordón seleccionan las unidades de sangre de cordón umbilical para un paciente basado en la tipificación de baja resolución de HLA-A, -B y de alta resolución para HLA-DRB1. En contraste a los trasplantes de médula ósea donde HLA clase I (A, B, C) y clase II (DRB1 y DQB1) se determinan en alta resolución para la selección del donador a fin de minimizar el riesgo de los dos obstáculos principales, la Enfermedad Injerto contra Huésped (EICH) y rechazo del injerto para un trasplante exitoso de células progenitoras hematopoyéticas no relacionadas (31, 32, 33).
Conocemos que el sistema HLA, se divide en dos, dependiendo de las características de las glucoproteínas en la membrana celular. Así, el sistema HLA tipo I, presenta glicoproteínas con una cadena pesada alfa unida a una molécula de microglobulina beta-2. La cadena pesada consta de 2 dominios que se unen al péptido, un dominio tipo inmunoglobulina (Ig) y una región transmembrana con una cola citoplasmática. La cadena pesada de la molécula de la clase I está codificada por genes en los locus HLA-A, HLA-B y HLA-C. Estas glicoproteínas HLA I, están presentes en todas las células nucleadas.
El sistema HLA II, suelen estar presente sólo en las células presentadoras de antígenos (linfocitos B, macrófagos, células dendríticas, y células de Langerhans), el epitelio del timo y los linfocitos T activados (pero no en reposo); además, la mayoría de las células nucleadas pueden ser inducidas para que expresen moléculas de HLA II mediante interferón (IFN) gamma. Las moléculas HLA II consisten en 2 cadenas polipeptídicas alfa (α) y beta (β); cada cadena tiene un dominio de unión al péptido, un dominio del tipo Ig y una región transmembrana con una cola citoplasmática. Ambas cadenas polipeptídicas están codificadas por genes de la región HLA-DP, -DQ o -DR del cromosoma 6.
Ahora bien, los linfocitos T, juegan un papel fundamental en el rechazo de injerto o trasplante, ya que son los encargados de reconocer en la membrana celular este sistema HLA, y actuar desencadenando una respuesta inmunológica de intensidad variable. Así, los linfocitos T que expresan moléculas de CD8 reaccionan con moléculas HLA I, y poseen una función citotóxica. Y los linfocitos T reactivos a las moléculas HLA II expresan CD4 y se denominan linfocitos T helper o colaboradores porque estimulan la proliferación de las otras células inflamatorias.
Dentro del sistema HLA I (HLA-A, HLA-B, y HLA-C) y HLA II (-DP, y – DR), los antígenos más inmunogénicos o más fuertes de mayor a menor son HLADR, HLA-B y HLA-A (34). Por tanto, estos tres son los más importantes para la búsqueda de donante y receptor.
La sangre de cordón umbilical, en éste sentido, juega con una ventaja fundamental para evitar u obtener una baja incidencia de Enfermedad Injerto contra Huésped (EICH) agudo y crónico (35), debido a:
- Inmadurez de los linfocitos T del donante.
- Baja cantidad numérica de linfocitos T infundidos.
- Células dendríticas (células presentadora de antígenos) selectivas con una alorreactividad disminuida.
- Baja respuesta de las células dendríticas a las citocinas, incluyendo al TNF (Factor de Necrosis Tumoral) e IFNγ (Interferón Gamma).
- Mayor cantidad de células productoras de IL 10 (Interleuquina 10), que es un inhibidor de la síntesis de citoquinas.
En conclusión, gracias a todas éstas propiedades de la sangre de cordón umbilical, se ha reportado trasplantes de células progenitoras hematopoyéticas de donante no relacionado, con 1 a 3 disparidades en HLA-A, HLA-B y HLA DRB, con baja incidencia de EICH, sin llegar al rechazo del injerto (36, 37, 38).
En el caso de trasplante de SCU en adultos, además de buscar compatibilidad HLA-A, HLA-B y HLA-DR, es necesario contar con la cantidad suficiente de células CD34+. Así, veremos que para un adulto se hacen necesarias la transfusión de dos unidades de SCU. La cantidad adecuada de células CD34+, se calcula de acuerdo al peso del paciente receptor. Una proporción menor de 1.8 x 107 CD34+ por kg de peso tiene un marcado decremento en el éxito del injerto y la sobrevida del receptor. Por ejemplo, para un paciente adulto de 70 kilogramos, sería insuficiente trasfundir 1.260.000.000 células CD34+(49,40,41).
3.4. Usos terapéuticos de las CPHs en la actualidad.
Definir los usos terapéuticos de las CPHs de SCU, es fundamental porque constituyen la base del consentimiento informado en todo procedimiento médico.
En Argentina, el INCUCAI, órgano independiente, autárquico, pero que depende del Ministerio de Salud Nacional y tiene asistencia de COFESA (Consejo Federal de Salud, formado por los Ministros de Salud de las provincias) y COFETRA (Consejo Federal de Trasplante, formado por los representantes de los organismos de procuración de órganos de todas las provincias), mediante resolución 204/21 del año 2021(42), establece claramente la clasificación de las indicaciones de uso de SCU para trasplante en:
- Clínicamente Aprobada (A): Se refiere a dos situaciones, una en donde el trasplante de CPH constituye un mejor tratamiento frente a otros; y la otra para aquellos pacientes que luego de un cuidadoso análisis de los riesgos y beneficios (disponibilidad del donante, la fuente de CPH y la inmunosupresión a utilizar, entre otras), constituye una opción válida.
- Experimental (EXP): En este tipo de indicaciones hay poca experiencia; los estudios clínicos adicionales son necesarios a fin de definir el rol del trasplante de CPH en estas patologías. Se incluyen en este grupo toda otra indicación no contemplada en la presente norma.
- Generalmente No Recomendada (GNR): Esta categoría incluye estadios tempranos de enfermedades, en las cuales los resultados del tratamiento convencional no justifican el riesgo de mortalidad asociado al trasplante.
Establecida la clasificación de las indicaciones, podemos observar las siguientes enfermedades y su relación con el trasplante de CPH como tratamiento. Utilizaremos siglas para tipo de trasplante ALO: Alotrasplante o Alógeno (trasplante de un individuo a otro de la misma especie, pero que no es gemelo idéntico); AUTO: Autotrasplante o Autólogo (las CPH provienen de la misma persona que las va a recibir, por lo que el paciente es su propio donante); DR: Donante Relacionado (el donante es un familiar consanguíneo); DNR: Donante No Relacionado (el donante no es un familiar consanguíneo); DR/DNR con MISMATCHED: Donante Relacionado y No Relacionado con Discordancia (hay discordancia en el sistema HLA).
Pacientes Adultos
|
ENFERMEDAD |
ESTADIO
|
DR |
DNR |
DR/DNR con MISMATCHED |
AUTO
|
|
|
ALO |
ALO |
ALO |
||
|
LEUCEMIAS |
|
|
|||
|
LMA (Leucemia Mieloide Aguda)
|
1 Remisión Completa (RC) bajo riesgo EMR – (Enfermedad Mínima Residual) |
GNR |
GNR |
GNR |
A |
|
1 RC bajo riesgo EMR + |
A |
A |
A |
GNR |
|
|
1 RC riesgo intermedio |
A |
A |
A |
A |
|
|
1 RC alto riesgo |
A |
A |
A |
GNR |
|
|
2 RC |
A |
A |
A |
A |
|
|
LPA (LMA Promielocítica) 2 RC molecular |
A |
A |
GNR |
A |
|
|
|
Recaída/Refractaria |
A |
A |
A |
GNR |
|
LLA (Leucemia Linfoblástica Aguda)
|
Ph(-) 1 RC riesgo estándar y EMR- |
GNR |
GNR |
GNR |
A |
|
Ph(-) 1 RC riesgo estándar y EMR+ |
A |
A |
A |
GNR |
|
|
Ph(-) 1 RC riesgo alto |
A |
A |
A |
GNR |
|
|
Ph(+) 1 RC EMR- |
A |
A |
A |
A |
|
|
Ph(+) 1 RC EMR+ |
A |
A |
A |
GNR |
|
|
2 RC |
A |
A |
A |
GNR |
|
|
Recaída/refractaria |
A |
A |
A |
GNR |
|
|
LMC (Leucemia Mieloide Crónica)
|
1° Fase crónica falla a ITK (inhibidores de la tirosina quinasa) de 2° y 3° generación |
A |
A |
A |
GNR |
|
Fase acelerada, crisis blástica o > 1° fase crónica |
A |
A |
A |
GNR |
|
|
Mielofibrosis |
Primaria o secundaria con score DIPSS int o alto |
A |
A |
A |
GNR |
|
SMD (Síndrome Mielodisplásico)
|
Riesgo alto, AREB I y II |
A |
A |
A |
GNR |
|
LMA 2° 1 RC o 2 RC |
A |
A |
A |
A |
|
|
Estadios más avanzados |
A |
A |
A |
GNR |
|
|
LLC (Leucemia Linfática Crónica)
|
Riesgo alto, no transformada |
A |
A |
A |
GNR |
|
Transformación a Richter
|
A
|
A
|
A
|
A
|
|
|
LINFOMAS |
|||||
|
Linfoma difuso de células grandes B |
1 RC (IPI intermedio/alto) |
GNR |
GNR |
GNR |
A |
|
|
Recaída quimio sensible, ≥ 2 RC |
A |
A |
EXP |
A |
|
Recaída post TCPH autólogo |
A |
A |
A |
GNR |
|
|
Enfermedad refractaria |
A |
A |
A |
A |
|
|
Linfoma primario del SNC |
GNR |
GNR |
GNR |
A |
|
|
Linfoma Folicular
|
1 RC, no transformado |
GNR |
GNR |
GNR |
GNR |
|
1 RC, transformado a linfoma de alto grado |
GNR |
GNR |
GNR |
A |
|
|
Recaída quimio sensible, ≥ 2 RC |
A |
A |
GNR |
A |
|
|
|
≥ 2 RC luego de recaída post TCPH autólogo |
A |
A |
EXP |
GNR |
|
Refractario |
A |
A |
A |
GNR |
|
|
Linfoma del Manto
|
1 RC |
GNR |
GNR |
GNR |
A |
|
>1 RC/RP sin TCPH autólogo previo |
A |
A |
EXP |
A |
|
|
>1 RC/RP luego de TCPH autólogo |
A |
A |
A |
GNR |
|
|
Refractario |
A |
A |
EXP |
GNR |
|
|
MW (Macroglobulinemia de Waldenström)
|
1 RC |
GNR |
GNR |
GNR |
GNR |
|
Recaída sensible, ≥ 2RC |
GNR |
GNR |
GNR |
A |
|
|
Alto riesgo |
A |
A |
EXP |
|
|
|
Linfoma T periférico
|
1 RC |
A |
A |
GNR |
A |
|
Recaída quimio sensible, ≥ 2 RC |
A |
A |
A |
A |
|
|
Refractario |
A |
A |
A |
GNR |
|
|
Linfomas T cutáneos |
Estadios tempranos (EORTC/ISCL I-IIA) |
GNR |
GNR |
GNR |
GNR |
|
|
Estadios avanzados (EORTC/ISCL IIB- IV) |
A |
A |
EXP |
GNR |
|
Linfoma Hodgkin
|
1 RC |
GNR |
GNR |
GNR |
GNR |
|
Recaída quimio sensible sin auto TCPH previo |
EXP |
EXP |
GNR |
A |
|
|
Recaída quimio sensible con auto TCPH previo |
A |
A |
A |
A |
|
|
Refractario |
EXP |
EXP |
EXP |
A |
|
|
|
|
|
|
|
|
|
Mieloma Múltiple |
Riesgo estándar |
A |
A |
GNR |
A |
|
|
Riesgo alto |
A |
A |
A |
A |
|
|
Recaída quimio sensible con auto TCPH previo |
A |
A |
A |
A |
|
Amiloidosis |
|
A |
A |
GNR |
A |
|
Anemia aplásica adquirida severa- AA/HPN |
Reciente diagnóstico |
A |
A |
GNR |
NA |
|
|
Recaído/Refractario |
A |
A |
A |
NA |
|
HPN Hemolítica |
|
GNR |
GNR |
GNR |
NA |
|
Fallo medular congénito (Anemia de Fanconi, Disqueratosis congénita, Anemia de Blackfan– Diamond y otros fallos medulares congénitos) |
|
A |
A |
A |
NA |
|
Cáncer de mama |
Alto riesgo HER2 negativo |
GNR |
GNR |
GNR |
A |
|
|
Metastásico quimiosensible |
EXP |
EXP |
GNR |
EXP/A |
|
Tumores Germinales |
Segunda línea, alto riesgo |
GNR |
GNR |
GNR |
A |
|
|
Refractario primario, >2 recaída |
GNR |
GNR |
GNR |
A |
|
Cáncer de ovario |
Alto riesgo/Recaído |
EXP |
GNR |
GNR |
GNR |
|
Meduloblastoma |
Post cirugía, alto riesgo |
GNR |
GNR |
GNR |
A |
|
Cáncer de pulmón a células pequeñas |
Limitado |
GNR |
GNR |
GNR |
EXP |
|
Sarcoma de partes blandas |
Metastásico |
EXP |
GNR |
GNR |
GNR |
|
Sarcoma de Edwing |
Localmente avanzado, metastásico quimiosensible |
EXP |
GNR |
GNR |
A |
|
Cáncer renal |
Metastásico, refractario a citoquinas |
EXP |
EXP |
GNR |
GNR |
|
Cáncer de páncreas |
Avanzado |
EXP |
GNR |
GNR |
GNR |
|
Cáncer colorrectal |
Metastásico |
EXP |
GNR |
GNR |
GNR |
|
Esclerosis múltiple |
Enf muy activa, recurrente remitente, falla a tratamientos específicos |
EXP |
GNR |
GNR |
A |
|
|
Enf progresiva con componente inflamatorio activo, enfermedad agresiva |
EXP |
GNR |
GNR |
A |
|
Esclerosis sistémica |
|
EXP |
GNR |
GNR |
A |
|
Lupus eritematoso sistémico |
|
EXP |
GNR |
GNR |
A |
|
Enfermedad de Crohn |
|
EXP |
EXP |
EXP |
A |
|
Artritis reumatoidea |
|
EXP |
GNR |
GNR |
A |
|
Artritis idiopática juvenil |
|
A |
A |
A |
A |
|
Enfermedades autoinmunes monogénicas |
|
A |
A |
A |
GNR |
|
Vasculitis |
|
GNR |
GNR |
GNR |
A |
|
Polimiositis Dermatomiositis |
|
GNR |
GNR |
GNR |
A |
|
Citopenias autoinmunes |
|
A |
A |
A |
A |
|
Neuromielitis óptica |
|
EXP |
EXP |
EXP |
A |
|
Polineuropatía desmielinizante |
|
GNR |
GNR |
GNR |
A |
|
Miastenia Gravis |
|
|
|
|
|
|
Síndrome de la persona rígida |
|
|
|
|
|
|
Diabetes tipo I |
|
GNR |
GNR |
GNR |
EXP |
|
Enfermedad celíaca refractaria tipo II |
|
GNR |
GNR |
GNR |
A |
|
Inmunodeficiencia Primaria |
|
A |
A |
A |
NA |
Gráfico 3: Indicaciones terapéuticas de CPH de SCU en paciente adulto.
Pacientes Pediátricos
|
ENFERMEDAD |
ESTADIO
|
DR |
DNR |
DR/DNR con MISMATCHED |
AUTO |
|
|
|
ALO |
ALO |
ALO |
|
||
|
NEOPLASIAS HEMATOLOGICAS |
|
|
|
|||
|
LMA
|
1 RC bajo riesgo |
GNR |
GNR |
GNR |
GNR |
|
|
1 RC riesgo alto y muy alto |
A |
A |
A |
GNR |
||
|
2 RC |
A |
A |
A |
GNR |
||
|
> 2 RC |
A |
A |
A |
GNR |
||
|
LLA |
1 RC bajo riesgo |
GNR |
GNR |
GNR |
GNR |
|
|
|
1 RC riesgo alto |
A |
A |
A |
GNR |
|
|
2 RC |
A |
A |
A |
GNR |
||
|
> 2 RC |
A |
A |
A |
GNR |
||
|
LMC
|
1° Fase crónica falla a ITK de 2° y 3° generación |
A |
A |
A |
GNR |
|
|
Fase acelerada, crisis blástica o > 1° fase crónica |
A |
A |
A |
GNR |
||
|
SMD y LMMJ |
|
|
A |
A |
A |
GNR |
|
LNH (Linfoma No Hodgkin)
|
1 RC riesgo) |
(bajo |
GNR |
GNR |
GNR |
GNR |
|
1 RC riesgo) |
(alto |
A |
A |
A |
A |
|
|
2 RC |
|
A |
A |
A |
A |
|
|
Linfoma Hodgkin
|
1 RC |
|
GNR |
GRN |
GNR |
GNR |
|
2 RC, primera recaída |
A |
A |
A |
A |
||
|
ENFERMEDADES NEOPLASICAS Y TUMORES SOLIDOS |
||||||
|
Inmunodeficiencia (ID) primaria |
ID combinada severa |
A |
A |
A |
NA |
|
|
|
Otras ID primarias |
A |
A |
A |
NA |
|
|
Talasemias y drepanocitosis |
|
A |
A |
A |
NA |
|
|
Osteopetrosis |
|
A |
A |
A |
NA |
|
|
Anemia aplásica adquirida severa |
|
A |
A |
A |
NA |
|
|
Mucopolisacaridosis (MPS)
|
MPS-I H Hurler |
A |
A |
A |
NA |
|
|
MPS-I H Hurler Scheie (severa) |
GNR |
GNR |
GNR |
NA |
||
|
MPS- VI MaroteauxLamy |
A |
A |
A |
NA |
||
|
Anemia de Fanconi |
|
A |
A |
A |
NA |
|
|
Anemia de Blackfan-Diamond |
|
A |
A |
A |
NA |
|
|
Disqueratosis congénita |
|
A |
A |
A |
NA |
|
|
Tumores de células germinales |
|
A |
A |
A |
A |
|
|
Sarcoma
|
Sarcoma de Ewing (alto riesgo o > 1 RC) |
EXP |
EXP |
EXP |
A |
|
|
Sarcoma partes blandas (alto riesgo o >1 RC) |
EXP |
EXP |
EXP |
A |
||
|
Neuroblastoma |
Alto riesgo o >1 RC |
A |
A |
EXP |
A |
|
|
Tumores cerebrales |
|
GNR |
GNR |
GNR |
A |
|
|
Tumor de Wilms |
> 1 RC |
GNR |
GNR |
GNR |
A |
|
|
Enfermedades Autoinmunes |
|
A |
A |
A |
A |
|
Gráfico 4: Indicaciones terapéuticas de CPH de SCU en paciente pediátrico.
Dichas indicaciones del INCUCAI se corresponden con las redes de información del European Bone Marrow Traspant (EBMT), la Comisión Asesora en Terapias Celulares y Medicina Regenerativa de Argentina, el Grupo Ad Hoc de Biobancos del Ministerios de Ciencia, Tecnología e Innovación Productiva de Argentina, y el Grupo Argentino de Medula Ósea.
Del análisis del gráfico 3 y 4, surge la utilidad terapéutica de un trasplante de CPHs de SCU, dependiendo de quién sea el dador. Así, el autotrasplante (trasplante autólogo) es generalmente no recomendado, en la leucemia (enfermedad neoplásica más frecuente) de pacientes pediátricos, siendo clínicamente aprobado el trasplante alógeno. Y en el caso de la leucemia mieloide crónica (cáncer más frecuente) en adultos sucede lo mismo.
Se ha estimado que la probabilidad de encontrar un donante compatible no relacionado es de 1 en 20.000 durante los primeros 20 años de vida. Y la probabilidad de encontrar un donante idéntico en el HLA entre hermanos del paciente (donante relacionado) es del 30%, siendo en general un 25%. Dicha probabilidad se incrementa con el número de hermanos, así, podríamos utilizar la siguiente fórmula para estimar la probabilidad exacta: 1- (3/4)n donde n es el número de hermanos (43, 44, 45). Ejemplo, si tuviera 10 hermanos consanguíneos, la probabilidad es del 94%, es decir, uno de ellos podría ser mi futuro donante.
3.5. Etapas del trasplante de CPHs.
Las etapas o pasos a tener en cuenta para un trasplante de CPHs de SCU, son:
- Establecer la patología con indicación terapéutica clínicamente aprobada (indicación de trasplante de CPH, tipo de donante adecuado, elegibilidad del donante alogénico de acuerdo a su compatibilidad HLA y analíticos infecciosos).
- Procesamiento de las CPHs (correcta conservación, manipulación, congelación, almacenado y distribución).
- Acondicionamiento del receptor (tratamiento mieloablativo o no).
- Descongelación e infusión de CPHs.
- Estudios de quimerismo, para evaluar la aceptación del trasplante.
El comportamiento in vivo del trasplante autólogo y del alogénico son diferentes. En el autólogo es necesario “hacer lugar” primero, por lo cual para erradicar la enfermedad de base (en el caso de enfermedades neoplásicas), se administra dosis altas de quimioterapia y/o radioterapia (regímenes de acondicionamiento mieloablativos) y rescatar la hemopoyesis destruida administrando las CPHs de SCU. En el caso del trasplante alogénico, la erradicación de las células neoplásicas del paciente, se realiza in vivo de dos formas (46); primariamente a través de la administración de quimioterapia y/o radioterapia, y en un segundo tiempo, la transfusión de las CPH, produce un efecto de “injerto contra tumor”, es decir, el inóculo hemopoyético reconoce como extrañas a las células tumorales del paciente, e inicia una respuesta alorreactiva eliminándolas (inmunoterapia adaptativa).
El acondicionamiento del receptor puede ser de dos tipos, mieloablativos (uno o más agentes quimioterápicos, combinados o no con radioterapia) o no mieloablativos. La posibilidad de los acondicionamientos no mieloablativos, es gracias a la eficacia del efecto de injerto contra tumor de las CPHs de SCU, y constituye una de las principales ventajas en trasplante de adultos mayores en que sus condiciones generales les impidan un acondicionamiento mieloablativo convencional (47).
Los acondicionamientos no mieloablativos, son en realidad acondicionamientos de intensidad reducida, que consiguen una mielosupresión y una toxicidad extrahematológica menor, muy valiosa en pacientes pediátricos, ya que permite evitar efectos no deseados sobre el crecimiento estatural y la fertilidad (48).
El éxito terapéutico del trasplante de CPHs, en el caso de enfermedades neoplásicas, es lograr un quimerismo completo; y en el caso de enfermedades no malignas en niños, como las inmunodeficiencias o enfermedades del metabolismo, se acepta también un quimerismo mixto y estable.
El quimerismo en hematología se refiere a la presencia de células linfohematopoyéticas no propias del receptor que aparecen como resultado de un trasplante alogénico. Es decir, si se logra el quimerismo significa que el sistema linfohematopoyético del donante ha sido capaz de implantarse en el receptor y ha desplazado al sistema linfohematopoyético del receptor o coexiste en equilibrio con este. Así, mediante determinaciones secuenciales, es posible conocer la evolución o comportamiento de la quimera con vistas a confirmar el fallo primario del injerto, o conocer, antes de que otros indicadores clínicos se manifiesten, que puede haber un fallo secundario del mismo (49, 50, 51).
El quimerismo se clasifica de acuerdo a las células del donante en el receptor en:
- Quimerismo total o completo (QC): donde todas las células que se detectan proceden del donante.
- Quimerismo mixto (QM): en el que coexisten células del donante y el receptor en un compartimento celular dado. Por ejemplo: en los linfocitos.
- Quimerismo dividido: cuando una o más líneas celulares proceden en su totalidad del donante y a su vez una o más proceden totalmente del receptor.
- Microquimerismo: en el que existe menos del 1 % de células del donante. Este grado de quimerismo solo se puede detectar cuando se utilizan técnicas muy sensibles.
Las técnicas hoy empleadas son en sangre periférica, de amplificación de ADN por PCR, que cuenta con la ventaja por sobre los métodos anteriores de no requerir que el receptor y dador sean del mismo sexo (52).
El estado de la quimera puede variar con el trascurso del tiempo, por eso es importante monitorear su evolución. Por ejemplo, una quimera establecida como completa en los primeros días después del trasplante, puede evolucionar a quimera mixta e incluso desaparecer, lo que se traduciría finalmente en un fallo del injerto. Por otra parte, el estado de quimera mixta puede evolucionar hacia el fallo del injerto, si predominan las células del receptor o hacia el estado de quimera completa con predominio casi absoluto (98 a 100 %) de la hematopoyesis del donante.
En general, en los trasplantes convencionales, el régimen de acondicionamiento que se aplica es tal, que produce una eliminación casi completa del tejido hematopoyético y linfoide del receptor, por lo que generalmente se alcanza un grado de quimerismo total o completo, y la alorreactividad del donante contra las células del receptor es poco significativa. Por lo tanto, la determinación del quimerismo no es esencial cuando se trata de un trasplante que utiliza un régimen de acondicionamiento mieloablativo. En cambio, en los regímenes de toxicidad reducida (no mieloablativos), el acondicionamiento que recibe el paciente es solo el suficiente para que se logre la implantación del injerto, y bajo este régimen, se conserva el tejido hematopoyético del paciente y se alcanza un estado de quimerismo mixto que puede mantenerse estable durante años y no es necesariamente es señal de recaída (53).
Según las recomendaciones de la Sociedad Americana de Trasplante de Sangre y Médula Ósea, en los trasplantes no mieloablativos o de toxicidad reducida, los estudios secuenciales de patrón de quimerismo, deben realizarse más frecuente, cada 2 a 4 semanas, durante los primeros cuatro meses, ya que, en las primeras semanas puede predecir la Enfermedad Injerto Contra Huésped o el fallo del injerto. Sin embargo, no es posible predecir en el 100 % de los casos y de manera inequívoca el comportamiento de la quimera y su relación con la evolución del injerto, pero es útil y necesario determinar en qué línea celular y en qué grado se establece la quimera, para actuar de manera precoz (54).
3.6. Legislación en argentina sobre CPHs provenientes de SCU.
Las leyes en Argentina en torno al trasplante han sufrido una evolución de acuerdo a los avances de la ciencia y la puesta en práctica de los distintos procedimientos médicos con distintos órganos, tejidos y células. Así, tenemos la ley 21.541 de Trasplante de Órganos, sancionada en el año 1977, que daba lugar a la posterior creación y puesta en marcha del CUCAI (Centro Único Coordinador de Ablación e Implante) como un organismo de procuración nacional a cargo de la normatización de los trasplantes en Argentina (55). Luego, la ley 23.885 sancionada en el año 1990, convierte al CUCAI en INCUCAI (Instituto Nacional Central Único Coordinador de Ablación e Implante), un organismo que sigue dependiendo del Ministerio de Salud de la Nación, pero que posee autarquía con personalidad jurídica, con cierta libertad e independencia, con sus propios recursos y con capacidad para nombrar y remover empleados en forma autónoma, funcionando como un organismo descentralizado (56).
Ya creado en el año 1990 el INCUCAI, la ley 21.541 de Trasplante de Órganos fue derogada por la ley 24.193 (57), sancionada en el año 1993 como ley de Trasplante de Órganos y Materiales Anatómicos, que debido a la ambigüedad e imprecisión del término “materiales anatómicos”, fue luego actualizada por la ley 26.066 de Trasplante de órganos y tejidos (58), sancionada en el año 2005. Previamente, en el año 2001, se sancionaba la ley 25.392 de Registro Nacional de donantes de Células Progenitoras Hematopoyéticas (59), por la cual se creaba un registro nacional de dadores con sede en el INCUCAI.
Finalmente, la ley 24.193, fue derogada por la ley 27.447 de Trasplante de Órganos, Tejidos y Células (60), sancionada en el año 2018, conocida como Ley Justina, que introdujo cambios con respecto a la línea establecida en las leyes anteriores, como lo es la figura del donante presunto, es decir, todas las personas mayores de 18 años de edad pasan a ser dadores de órganos, a menos que expresen su voluntad contraria.
La ley 27.447 establece la donación y trasplante de corazón, vasos, estructuras valvulares y otros tejidos cardíacos, pulmón, hígado, páncreas, intestino, riñón y uréter, tejidos del sistema osteoarticular y musculoesquelético, piel, córneas y esclera, tejidos del sistema nervioso periférico, membrana amniótica, y células progenitoras hematopoyéticas (CPH). Y se exceptúan de esta ley las células naturalmente renovables o separables del cuerpo, la sangre y sus componentes para transfusiones (tiene su propia legislación en la ley 22.990, ley de Sangre, sancionada en el año 1983), las células y los tejidos germinativos para fines de reproducción humana asistida, los gametos y embriones humanos, y las células para ser utilizadas en investigación básica.
En consonancia con la ley 25.392 que dispone la creación del Registro Nacional de Donantes de Células Progenitoras Hematopoyéticas, el INCUCAI con su Resolución 319/04, definió las características y normas de funcionamiento de los Bancos de Células Progenitoras Hematopoyéticas provenientes de la sangre periférica y del cordón umbilical, que fueran destinadas a trasplante en pacientes. Dicha resolución, en su anexo IV, referido al consentimiento informado de la donación de CPH de la sangre placentaria y del cordón umbilical, la madre del recién nacido renunciaba a los derechos de reclamar las CPH para su uso privado (autólogo), quedando exceptuada en los casos, en los cuales dentro de un grupo familiar existe un niño afectado de una enfermedad con indicación de trasplante, sin donante compatible y cuya madre este embarazada. Frente a esta circunstancia se autoriza la colecta de la unidad de CPH proveniente de la SCU, su procesamiento y criopreservación con el destino específico de su utilización en el hermano/a enfermo
(61).
Luego, la Resolución 319/04, fue modificada por la Resolución 060/09, en puntos referidos a la idoneidad de los profesionales a cargo de los bancos de CPH. Finalmente, surgió la Resolución 069/09, que en sus fundamentos advertía un crecimiento en los últimos años de la utilización de las CPH de SCU, dando lugar al progresivo surgimiento de Bancos privados en cuyas actividades figuraba la preservación de CPH provenientes de SCU, células mesenquimales y tejido de cordón para un eventual uso autólogo (62).
Dicha resolución 069/09, buscaba regular la actividad de los Bancos privados tomando como fundamentos los principios de voluntariedad, confidencialidad, altruismo y solidaridad, así en su artículo 6° dice “Las CPH provenientes de la sangre de cordón umbilical y la placenta que se colecten a partir de la entrada en vigencia de la presente resolución para usos autólogos eventuales, usos para los que no haya indicación médica establecida, deberán ser inscriptas en el Registro Nacional de Donantes de Células Progenitoras Hematopoyéticas, mediante el Protocolo aprobado en el Anexo III de la Resolución INCUCAI Nº 319/04 y en las que en un futuro la reemplacen, complementen o amplíen, y estarán disponibles para su uso alogénico, conforme lo establecido por la Ley Nº 25.392”. En conclusión, las CPH provenientes de SCU, colectadas en Bancos privados para uso autólogo, debían ser destinadas para uso alogénico, es decir, estar registradas en el Banco de Donantes de CPH, y estar disponibles para su uso en otra persona en caso de necesidad (en anexos se puede visualizar consentimiento informado de dicha medida).
Dicha resolución fue judicializada, y el 22 de mayo del 2012, la Corte Suprema de la Nación, confirmo la sentencia de inconstitucionalidad parcial de la resolución del INCUCAI 069/09, en cuanto a la obligatoriedad de donar las CPH de cordón umbilical y placenta reservadas por los padres para su uso de los recién nacidos. El fallo fue débilmente fundamentado en encasillar a la acción de guarda de las CPH por parte de los Bancos privados, dentro de la Ley de Sangre (ley 22.990) (63), por lo cual ya no recaía sobre la ley de Trasplante, tejidos y células (ley 24.193), ni sus regulaciones a través de las resoluciones del INCUCAI. El segundo aspecto del fallo, con respecto al derecho de los padres, se priorizo la autonomía y libertad de los mismos en cuanto al destino de las CPH para su uso autólogo, y se dejó de lado el bien común, y más aún la racionalidad de la utilidad médica comprobada del uso autólogo de las mismas (64, 65, 66).
Así, por Resolución 262/14 del INCUCAI, el 30 de julio se derogó la Resolución 069/09, concluyendo no obstante que no comparte los fundamentos del fallo, y mencionando que en las inspecciones realizadas en Bancos privados de la Ciudad Autónoma de Buenos Aires, se habían constatado deficiencias de infraestructura, equipamiento, y de capacitación del recurso humano; como también que en Registro Nacional de Células Progenitoras Hematopoyéticas, no existían registros de las unidades colectadas, por lo cual se desconocía la cantidad de las mismas, las condiciones en las que fueron obtenidas, transportadas, procesadas y criopreservadas. Por ende, dichas unidades de CPH de sangre de cordón umbilical y placenta, bajo la custodia de Bancos privados, no pueden ser utilizadas en trasplante de CPH (67).
3.7. Bancos Privados en Argentina
La relación y dinámica de trabajo de los bancos privados y público en Argentina, es la contracara de países de habla hispana, como lo es el caso español.
En España actualmente existen seis Bancos Públicos que componen la red del Sistema Nacional de Salud (Barcelona, Bilbao, Madrid, Málaga, Santiago de Compostela y Valencia), y dos Bancos privados, que cuentan en conjunto con 65.000 unidades de sangre de cordón umbilical; los Bancos públicos como privados trabajan en red a partir del Real Decreto Ley 9/2014, por el que se establecen las normas de calidad y seguridad para la donación, la obtención, la evaluación, el procesamiento, la preservación, el almacenamiento y la distribución de células y tejidos humanos y se aprueban las normas de coordinación y funcionamiento para su uso en humanos(68).
España ha diseñado en forma eficiente la colaboración de los Bancos privados y públicos, de manera tal que, la paciente embarazada que va a donar la sangre de cordón umbilical, en el formulario de consentimiento informado, se le da información sobre el procedimiento, y se le especifica que la donación se realiza de manera altruista y con carácter universal, es decir, que la donación se realiza para cualquier paciente que la necesite, y la misma da su consentimiento firmado de manera libre y voluntaria, sin que exista coacción económica o de otro tipo.
Además, España, ya en el año 2008 había elaborado el Plan Nacional de Sangre de Cordón (PNSCU) con el objetivo básico de alcanzar 60.000 unidades de sangre de cordón umbilical (SCU) de alta calidad en un periodo de 6-8 años. Luego, en esa misma línea de trabajo, se aprobó en el 2019, la puesta en marcha de un nuevo PNSCU que forma parte de la Estrategia Nacional de Trasplante Hematopoyético 2020-2025, cuyos objetivos son mantener un stock de 60-65.000 unidades de SCU con celularidad superior a 8 x 108 células nucleadas totales (69, 70, 71)
En Argentina, en cambio, contamos con un solo Banco público que está en el Hospital de Pediatría "Prof. Dr. Juan P. Garrahan", en la Ciudad Autónoma de Buenos Aires (CABA), y siete Bancos privados de guarda de CPHs provenientes de SCU. Los siete Bancos privados son los siguientes:

Gráfico 5: Nombres y distintivos comerciales de los siete bancos privados existentes en Argentina.
El funcionamiento de los Bancos privados es autónoma e independiente entre ellos, aunque se encuentran agrupados a una asociación sin fines de lucro, tal como se define en su página web, denominada ABC Cordón, fundada en el año 2011, que sería la que otorga una certificación a dichos bancos privados, aunque no se encuentra información sobre qué tipo de normas son las que se deben cumplir para dicha certificación (72). Luego, hay bancos privados (Matercell, Protectia y Biocells) que en sus páginas web presentan una certificación según normas ISO 9001/2015, que es la norma vigente al día de hoy (estándar internacional que establece un Sistema de Gestión de Calidad de una organización).
En entrevista telefónica con los tres bancos privados certificados por ABC Cordón y normas ISO9001, se pudo obtener información sobre los costos de la extracción y guarda de la sangre de cordón umbilical. La extracción, traslado al laboratorio y su procesamiento tiene un costo de US$180 a US$200 dólares, con variaciones por descuentos debido a promociones como el día de la mujer, día de la madre, entre otros. Luego, la guarda anual, tiene un costo de US$280 a US$390 dólares, dependiendo si se desea guardar además de las CPHs de la SCU, las células mesenquimales y tejidos del cordón.
Los puntos clave de la guarda de SCU en bancos privados fueron los siguientes:
- La criopreservación es de sangre de cordón umbilical y opcionalmente de parte del cordón (células mesenquimales y tejido del cordón).
- El banco privado solo realiza la guarda de dicho material, no realiza la probable trasfusión o trasplante autólogo.
- De ser la muestra insuficiente en cantidad o calidad, se informa al cliente, quién decide si la misma se desechará o se procede a su guarda de todos modos.
- Se asegura la calidad en la criopreservación por un período de 16 a 20 años.
- Las muestras criopreservadas en bancos privados no pueden ser recibidas en bancos públicos.
- A los costos del servicio se suma un “seguro” en caso de no poder continuar pagando la criopreservación anual, con la posibilidad de continuar la criopreservación con un compromiso de pago posterior.
- Discusión y Conclusiones
Finalizada la exposición de los aspectos biológicos y legales de la SCU como fuente de CPHs para trasplante en enfermedades neoplásicas y otras, se encontraron limitantes biológicas y legales a tener en cuenta frente a la decisión de su guarda en un banco público o privado.
Dentro de los aspectos biológicos favorables al uso de SCU como fuente de CPHs, surgieron en primer lugar del análisis del sistema HLA. Concretamente, se hizo referencia a dos características biológicas fundamentales, que le otorgan ventajas por sobre las CPHs de médula ósea. El primer aspecto fue la tipificación de las unidades de SCU distinta. Las CPHs de SCU sólo necesitan la tipificación de baja resolución de HLA-A, -B y de alta resolución para HLA-DRB1, a diferencia de las CPHs de médula ósea en donde se deben determinar mayor cantidad de antígenos
HLA y con técnicas de alta resolución (HLA-A, HLA-B, HLA-C, HLA-DRB1 y HLADQB1). El segundo aspecto, fue que, además de requerir la determinación de menos antígenos HLA, se han realizado trasplantes exitosos de CPHs de SCU con 1 a 3 disparidades en HLA-A, HLA-B y HLA DRB, con baja incidencia de EICH, sin llegar al rechazo del injerto.
En segundo lugar, siguiendo con el análisis de los aspectos biológicos de comportamiento in vivo del trasplante de CPHs de SCU autólogo versus alógeno, se expuso que sólo éste último tiene un efecto de “injerto contra tumor”, es decir, el inóculo hemopoyético reconoce como extrañas a las células tumorales del paciente, e inicia una respuesta alorreactiva eliminándolas. Además, se concluyó que ésta inmunoterapia adaptativa, es la que permite el acondicionamiento no mieloablativo deseable en pacientes adultos mayores y pediátricos, por su menor toxicidad extrahematológica.
En el análisis de los usos terapéuticos de las CPHs de SCU y su guarda en un banco público o privado, se observó dos limitaciones para la SCU guardada en banco privado. La guarda de SCU en un banco privado es para uso autólogo, así, se encontró que su uso en patologías neoplásicas de pacientes pediátricos no tiene indicación clínica aprobada. Luego, el uso autólogo en paciente adulto, si bien, si posee indicación clínica aprobada, se requerirá para la trasfusión terapéutica dos unidades de SCU, para disponer de la cantidad suficiente de células CD34+. Esta situación significa, que una de las unidades de SCU puede pertenecer al mismo paciente, pero la segunda unidad de SCU, necesariamente debe corresponder a otro dador relacionado (pariente consanguíneo) o no relacionado (otra persona no familiar) compatible, ya que el limitante es obtener la cantidad suficiente de CPHs necesarias para el tratamiento de una persona adulta.
Del estudio de la probabilidad de compatibilidad surge la conclusión de la mayor probabilidad de encontrar un donante compatible no relacionado, ya que la familia numerosa argentina, hoy en día, no es una realidad. En Argentina, el Ministerio de Salud publicó las estadísticas vitales correspondientes al año 2020, y la tasa global de fecundidad (el número de hijos por mujer) se ubicó en 1,54, es decir, por debajo de la tasa de reemplazo de la que depende la estabilidad de la población, siendo la tasa de reemplazo de 2,1 hijos por mujer (73). En conclusión, la guarda de SCU para trasplante en banco público, es una solución frente a ésta situación y por lo mismo su promoción se hace necesaria para la renovación de unidades de SCU, tal como lo lleva adelante el caso de España.
Desde el análisis de la perspectiva legal en Argentina, el panorama actual no es favorable para el trabajo conjunto de bancos privados y público. Por lo mismo, el consentimiento informado de los padres al contratar los servicios de un banco privado, debe ser el suficiente para dar cuentas del real o potencial uso que se le dará a la muestra criopreservada. Cabe destacar que luego de la derogación de la resolución 69/09, el INCUCAI no tiene incumbencias de autoridad de control sobre los bancos privados, por lo que tampoco puede dar garantía de las muestras criopreservadas allí.
En conclusión, una familia que requiera del sistema de salud público para llevar acabo un trasplante de CPHs de SCU guardado en banco privado, no es un caso contemplado en la legislación actual; sólo queda establecido que el INCUCAI está obligado a denegar el procedimiento.
Por último, el análisis del derecho de guarda para uso autólogo por parte de los padres en un banco privado, debe ser considerando teniendo en cuenta no sólo los aspectos legales, que le son favorables, sino también desde el punto de vista biológico y ético (74), para que sea en ejercicio pleno de un consentimiento informado, y respetando el principio terapéutico y de totalidad, desde la perspectiva bioética personalista. En donde, el principio terapéutico seria en interés del que tiene que recibir el trasplante, que en consonancia con el deseo auténtico de los padres de usar la SCU para uso autólogo, debe ser contrastado con los datos biológicos que informan sobre sus limitaciones. Luego, el principio de totalidad, hace referencia a que el bien del todo prevalece sobre el bien de la parte, pero éste principio no puede ser entendido a nivel sociedad, porque de ser así, se podría disponer de órganos, tejidos o células de algunas personas sin su consentimiento en favor de otras; por tanto, el principio de totalidad debe ser entendido sobre la misma persona, es decir la acción de realizar una adaptación de mielosupresión (matar las células neoplásicas) para luego recibir un autotrasplante o alotrasplante para salvar la vida. La necesidad y el éxito comprobado del trasplante alógeno nos plantea la existencia de los otros dos principios del Personalismo, el principio de la solidaridad y subsidiaridad, por los cuales la donación para trasplante es un acto personalísimo altruista y solidario, y requiere del acompañamiento de instituciones, sin fines de lucro, para ayudar en dicho proceso.
Finalizada las conclusiones biológicas, legales y éticas referidas al trasplante de SCU, se deriva la necesidad de un cambio legislativo en Argentina, en favor del trabajo mancomunado de bancos privados y público, promoción de la donación de SCU, y capacitación de la comunidad médica para el adecuado asesoramiento sobre donación de CPHs a las familias.
Referencias Bibliográficas
- Lown, RN, Philippe, J., Navarro, W., Van Walraven, SM, Philips-Johnson, L., Fechter, M., ... y Shaw, BE (2014). Idoneidad médica de donantes de células madre adultas no emparentadas: recomendaciones del Comité del Grupo de Trabajo Clínico de la Asociación Mundial de Donantes de Médula Ósea. Trasplante de médula ósea , 49 (7), 880-886.
- de Argentina, R. I. D. T. (2018). Contexto, Avances y Resultados. Buenos Aires.
- Moreno, F., & Chaplin, M. A. (2018). Registro oncopediátrico hospitalario argentino. incidencia 2000-2009, supervivencia 2000-2007, tendencia de mortalidad 1997-2010 1a edición, 2012.
- Falcione, A. C., Pujol, M. A., Beligoy, L. E., Lanari Zubiaur, E. A., Rojo Pisarello, E. A., Erro, G., ... & Zimmermann, M. C. (2021). Situación actual de pacientes con leucemia mieloide crónica del Nordeste Argentino: Características sociodemográficas y clínicas.
- Lafferriere, N., & Raskovsky, M. (2014). Las Células Madre De Cordón Umbilical Y La Regulación De Los Biobancos En Un Fallo De La Corte Suprema De Argentina (Umbilical Cord Stem Cells and Biobank Regulation in a Decision from the Supreme Court in Argentina). Doctrina Judicial, La Ley, 7.
- Sgreccia, E. (2009). Manual de bioética (Vol. 1). Madrid: Biblioteca de autores cristianos.
- González LLano, Ó. (2014). Los trasplantes de células hematopoyéticas no mieloablativos en pediatría.
- Páez Guerrero, D., Arévalo Romero, J., & Rodríguez Pardo, V. M. (2007). Evaluación de características morfológicas e inmunofenotipo de células madre mesenquimales en cultivo obtenidas a partir de sangre de cordón umbilical y médula ósea. NOVA publ. cient, 114-126.
- Rodríguez Ordóñez, F., Pérez Riaño, D., León Martín, A., Mosquera Zárate, A., Rojas Ávila, A., Forero Villamil, C. A., ... & ÁVILA-PORTILLO, L. U. Z. (2015). Correlación entre características físicas neonatales y maternas con el recuento total de células nucleadas y de células CD34+ por microlitro en sangre de cordón umbilical. Revista Med, 23(2), 71-77.
- Gamba, C., Breier, D. V., Marcos, M. A., Trevani, H., Van der Velde, J., Bonduel, M., & del Pozo, A. E. (2005). Banco público de sangre de cordón umbilical. infant, 75-79.
- Barquinero Máñez, J. (2009). Células madre hematopoyéticas. Monografías de la Real Academia Nacional de Farmacia.
- Romero, J. A. A., Guerrero, D. M. P., & Pardo, V. M. R. (2007). Células madre mesenquimales: características biológicas y aplicaciones clínicas. Nova, 5(8).
- 13. Socarrás-Ferrer, B. B., del Valle-Pérez, L. O., de la Cuétara-Bernal, K., MarsánSúarez, V., Sánchez Segura, M., & Macías-Abraham, C. (2013). Células madre mesenquimales: aspectos relevantes y aplicación clínica en la medicina regenerativa. Revista Cubana de Hematología, Inmunología y Hemoterapia, 29(1), 16-23.
- Colino, C. G. (2003, January). Estado actual de la investigación con células madre. In Anales de Pediatría (Vol. 59, No. 6, pp. 552-558). Elsevier Doyma.
- Rodríguez, V. M., Cuéllar, A., Cuspoca, L. M., Contreras, C. L., Mercado, M., & Gómez, A. (2006). Determinación fenotípica de subpoblaciones de células madre derivadas de sangre de cordón umbilical. Biomédica, 26(1), 51-60.
- Gargantiel, L. V. (2012). Actualizacion en celulas madre hematopoyeticas. REDUCA, 4(10).
- Tamayo Carbón, A. M., Lima Dorta, A., & Chang Monteagudo, A. (2021). Identificación por citometría de flujo de células madre en el tejido adiposo para lipotransferencia autóloga. Revista Cubana de Hematología, Inmunología y Hemoterapia, 37(4).
- Roa Lara, A. (2004). Células madre hematopoyéticas y leucemia mieloide crónica.
- Alvarado-Valverde, S. (2009). Estandarización del protocolo de ensayo de unidades formadoras de colonias de células progenitoras hematopoyéticas.
- Zamora Cruz, M. (2002). Células madre hematopoyéticas: función y aplicaciones clínicas actuales.
- Torres, M. (2009). Sistema nacional de procuración de órganos y tejidos para trasplante.
- Nanni, M. F. (2018). Trasplante de Células Progenitoras Hematopoyéticas (CPH) en Argentina: relevancia de la edad, el sexo y el peso de los donantes de CPH en trasplante no relacionado (Doctoral dissertation, Universidad de Concepción del Uruguay--CRG).
- Lana, S., Ortellado, D., Villalba, M., & Lanari, A. (2006). Trasplante de sangre de cordón umbilical de donante no emparentado. Revista de Posgrado de la VI Cátedra de Medicina, 158, 18-21.
- González LLano, Ó. (2014). Los trasplantes de células hematopoyéticas no mieloablativos en pediatría.
- Cruz-Rico, G., & Cruz-Rico, J. (2000). Criopreservación de células progenitoras hematopoyéticas. Gaceta Médica de México, 136, 13-15.
- Cortés, A. Células progenitoras hematopoyéticas: trasplante. Aplicaciones y Práctica de la Medicina Transfusional.
- Abichaín, P. ¿Por qué debemos seguir congelando las células progenitoras hematopoyéticas?
- Pozo, A. E. D. (2009). Bancos de células progenitoras hematopoyéticas de sangre de cordón umbilical y la placenta: análisis de las resoluciones sobre su habilitación y regulación. Perspectivas Bioéticas, 14.
- Resolución 319/04 del Instituto Nacional Central Único Coordinador de Ablación e Implante INCUCAI, año 2004.
- Acero Aguilar, S., Guillén Cortijo, V., Blanco Curví, S., Herranz Márquez, N., & Carro Bravo, M. (2007). Sangre de cordón umbilical. Procedimientos de recogida, donación y aspectos legales. Metas enferm, 64-68.
- Rivero-Jiménez, R. A. (2014). Razones para un banco de sangre de cordón umbilical en el Instituto de Hematología e Inmunología de Cuba. Revista Cubana de Hematología, Inmunología y Hemoterapia, 30(1), 4-10.
- Morales de los Santos, J. A., Jaime Pérez, J. C., Mancías Guerra, C., Salazar Riojas, M. D. R., & Gómez Almaguer, D. (2006). Diversidad de antígenos leucocitarios humanos A, B, DQB1 y DRB1 en células de sangre de cordón umbilical criopreservadas en el Hospital Universitario Dr. José Eleuterio González. Medicina Universitaria, 8(33), 212-219.
- Guerra, C. M. Banco de sangre de cordón umbilical. La sangre y sus enfermedades, 235.
- Morales, R. H. (2019). Enfermedad injerto contra huésped en el trasplante de sangre de cordón umbilical de donante no emparentado en adultos con enfermedades hematológicas malignas (Doctoral dissertation, Universitat de València).
- Da Silva, F. D. M. V. M. (2010). Enfermedad injerto contra huésped crónica: factores pronósticos y nuevas opciones terapéuticas.
- López-Hernández, G., Olivas-Román, L. R., del Pilar Salazar-Rosales, H., & Corcuera-Delgado, C. T. (2020). Lactante menor con leucemia congénita y enfermedad de injerto contra huésped postrasplante. Acta Pediátrica de México, 40(4), 223-233.
- Villafañe, M. J., & Moreno, L. H. (2012). Enfermedad injerto versus huésped. Dermatol Peru, 22(4), 161-70.
- Feria Saldana, K. H. (2019). Enfermedad injerto contra huesped: reporte de casos y revision de la literatura.
- Torres, D., Cerón, W., Córdova, B., Rodríguez, R., Cabrera, E., Alegría, R., & Cóndor, J. M. (2016). Evaluación de umbrales mínimos de celularidad en unidades de sangre de cordon umbilical en el Instituto Nacional Materno Perinatal del Perú. Revista Peruana de Medicina Experimental y Salud Pública, 33, 695-699.
- López Sánchez, M. (2007). Caracterización de las unidades de sangre de cordón procedentes de donantes con patología obstétrica.
- Torres Palomino, D. C. (2014). Evaluación del recuento de progenitores hematopoyéticos de las unidades de sangre de cordón umbilical según criterios de celularidad NETCORD. Instituto Materno Perinatal de Lima.
- Resolución 204/21 del Instituto Nacional Central Único Coordinador de Ablación e Implante INCUCAI, año 2021.
- Morera Barrios, L. M., Ustáriz García, C. R., García García, M. D. L. Á., Lam Díaz, R. M., Guerreiro Hernández, A. M., & Hernández Ramírez, P. (2008). Probabilidad de encontrar donantes HLA idénticos en familiares no relacionados para posible trasplante de células hematopoyéticas. Revista Cubana de Hematología, Inmunología y Hemoterapia, 24(1), 0-0.
- Quispe, A. C., & Tordoya, L. F. S. (2012). Frecuencias alélicas HLA clase I (HLA-A, HLA-B Y HLA-C) y clase II (HLA-DR), en población mestiza boliviana de donantes y receptores de órganos Allelic frequency of HLA class I (HLA-A, HLA-B and HLA-C) and class II (HLA-DR), in Bolivian mestizos population of donors and organ recipient. BIOFARBO, 20(2), 39-46.
- Allo Pejenaute, V. (2020). Propuesta de un plan de intervención para aumentar el número de donantes jóvenes de médula ósea en la Comunidad Foral de Navarra.
- Bastos Oreiro, M. (2017). Influencia de la alorreactividad KIR en el trasplante alogénico de progenitorres hematopoyéticos haploidéntico, no manipulado.
- 47.Burotto, M., Bertín CM, P., Galindo, H., Garrido, M., Melgoza, G., Nervi, B., ... & Álvarez, M. (2009). Trasplante con precursores hematopoyéticos de cordón umbilical en adultos con neoplasias hematológicas en Chile: Serie clínica. Revista médica de Chile, 137(8), 1054-1060.
- Ruiz-Argüelles, G. J., Gómez-Almaguer, D., Ruiz-Delgado, G. J., & del Carmen Tarín-Arzaga, L. (2007). Ocho años de experiencia con el “método mexicano” en la realización de trasplantes de células hematopoyéticas alogénicas. Gaceta médica de México, 143(3), 231-235.
- Amor Vigil, A. M., Jaime Fagundo, J. C., Pavón Morán, V., Figueredto Peguero, Y. E., Luna Conde, C., Wilford de León, M., ... & Martínez Antuña, G. (2005). Quimerismo molecular en el trasplante alogénico de células hematopoyéticas: resultados preliminares. Rev. cuba. hematol. inmunol. hemoter.
- Rodríguez, A. M., Cuéllar, F., Ramírez, J. L., & Vásquez, G. (2006). Seguimiento y evaluación molecular de quimerismo en pacientes trasplatados con células hematopoyéticas. Iatreia, 19(4-S), ág-S.
- Bailón, A. N. (2019). TESIS DOCTORAL Dinámica del quimerismo en sangre periférica, médula ósea y linajes leucocitarios en el trasplante alogénico de progenitores hematopoyéticos (Doctoral dissertation, Universidad Complutense de Madrid).
- Pérez Ortiz, L., Torres Ochando, M., Segura Díaz, A., Breña Atienza, J., Guerra Domínguez, L., Manyani Manyani, K., ... & Gómez Casares, M. T. (2019). Quimerismo mediante PCR cuantitiativa en tiempo real para predecir la recaída de pacientes con Leucemia Mieloblástica Aguda (LMA) sometidos a trasplante alogénico de progenitores hematopoyéticos. Blood Transfusion.
- Bautista, A. M., Mayol, A. S., Gutiérrez, A., Ballester, C., Canaro, M., & Besalduch, J. (2010). Transplante de progenitores hematopoyéticos (TPH) alogénico no mieloablativo: Casuística de un solo centro. Medicina balear, 25(1), 13-20.
- Moscardó García, F. (2013). Impacto del quimerismo hematopoyético precoz en el injerto tras trasplante alogénico de progenitores de sangre de cordón umbilical de donante no emparentado para el tratamiento de hemopatías malignas.
- Ley 21541 Trasplante de órganos (18 de marzo 1977). http://servicios.infoleg.gob.ar/infolegInternet/verNorma.do;jsessionid=B5305E4E150BD44BF6E8F605F3F61875?id=303711
- Ley 23885 Ablación e implantes de órganos (1 de noviembre 1990). http://servicios.infoleg.gob.ar/infolegInternet/verNorma.do?id=285
- Ley 24193 Trasplante de órganos y materiales anatómicos (19 de abril 1993). http://servicios.infoleg.gob.ar/infolegInternet/anexos/0-4999/591/texact.htm#:~:text=%E2%80%94%20La%20extracci%C3%B3n%20de%20%C3%B3rganos%20o,salud%20del%20dador%20y%20existan
- Ley 26066 Trasplante de órganos y tejidos (22 de diciembre 2005). http://servicios.infoleg.gob.ar/infolegInternet/verNorma.do?id=112375#:~:text=ABLACION%20EN%20LOS%20CASOS%20DE,DE%2018%20A%C3%91OS %20NO%20EMANCIPADOS.
- Ley 25392 Registro Nacional de donantes (10 de enero 2001). http://servicios.infoleg.gob.ar/infolegInternet/verNorma.do?id=65723#:~:text=REGISTRO%20NACIONAL%20DE%20DONANTES%20%2D%20CREACION%20%2D&text=CENTROS%20DE%20RECLUTAMIENTO%20DE%20DADORES%2C%20DE%20TIPIFICACION%20DE%20DADORES%20E%20INFORMATICO.&text=Esta%20norma%20modifica%20o%20complementa,por%20 25%20norma(s).
- Ley 27447 Ley de trasplante de órganos, tejidos y células (26 de julio 2018). http://servicios.infoleg.gob.ar/infolegInternet/verNorma.do?id=312715#:~:text=LA%20PRESENTE%20LEY%20TIENE%20POR,EL%20TRASPLANTE%20Y %20SU%20SEGUIMIENTO.
- Montoya, M. F., & Sedlinsky, G. B. La construcción social de las células madre como tecnología estratégica. Un análisis socio-técnico del caso argentino.
- Pozo, A. E. D. (2009). Bancos de células progenitoras hematopoyéticas de sangre de cordón umbilical y la placenta: análisis de las resoluciones sobre su habilitación y regulación. Perspectivas Bioéticas, 14.
- Ley 22990 Ley de Sangre (2 de diciembre 1983). http://servicios.infoleg.gob.ar/infolegInternet/verNorma.do?id=49103#:~:text=ESTABLECESE%20UN%20REGIMEN%20NORMATIVO%20CON,EL%20SISTEMA%20NACIONAL%20DE%20SANGRE.&text=Esta%20norma%20no%20modifica%20ni%20complementa%20a%20ninguna%20norma.
- Lafferriere, J. N. (2010). La regulación jurídica de la investigación sobre células troncales.
- Luna, F., & Vanderpoel, S. (2013). Not the usual suspects: addressing layers of vulnerability. Bioethics, 27(6), 325-332.
- INCUCAI, R. (2015). Resolución INCUCAI 069/09. Perspectivas Bioéticas, (2627), 42-56.
- Laporta, G., Steinberg, S., & Dewey, R. (2014). Células madre de sangre de cordón umbilical. ¿Quién tiene la palabra?. Derecho y Ciencias Sociales, (11), 40-57.
- Fernando Pablo, M. M. (2015). Real Decreto-Ley 9/2014, de 4 de julio, por el que se establecen las normas de calidad y seguridad para la donación, la obtención, la evaluación, el procesamiento, la preservación, el almacenamiento y la distribución de células y tejidos humanos y se aprueban las normas de coordinación y funcionamiento para su uso en humanos.
- Ruiz Salvador, I., & Moreno Aznar, L. A. " De residuo a tesoro": Programa de salud para la donación de sangre de cordón umbilical.
- Morata, S. P. Programa de Educación para la Salud sobre la Donación de Sangre de Cordón Umbilical.
- Organización Nacional de Trasplantes. (2020). Plan Nacional de Sangre de Cordón Umbilical 2020-2025. Ministerio de Sanidad. España. Disponible en: http://www.ont.es/infesp/TejidosPHCelulas/Plan_Nacional_de_Sangre_de_Co rd%C3%B3n_Umbilical_2020-2025.pdf
- ABC Cordón. Asociación de Bancos de Células Madre de Cordón Umbilical (s.f.). Bancos Certificados por ABC Cordón. http://www.abccordon.com/bancos-certificados
- Ministerio de Salud Argentina (2020). Indicadores Básicos. https://www.argentina.gob.ar/sites/default/files/indicadores_basicos_2020.pdf
- Sgreccia, E. (2009). Manual de bioética (Vol. 1). Madrid: Biblioteca de autores cristianos.
Anexo: Consentimiento Informado para AUTORIZACION DE EGRESO DE UNIDADES DE CPH DE SCU (según Resolución 319/04 y 69/09).
1 Médica Tocoginecóloga y Legista (M.P. 7571).
Lules. Tucumán. C.P. 4128.