Experiencia en el Tamizaje Primario con Genotipificación de VPH y Triage Citológico en la Provincia de Mendoza

Autores:
Federiche, Claudia1; Oronel, Ana;Venditti1, Paula; Orrico, Santiago1
Objetivo
Analizar los resultados obtenidos en el tamizaje primario para el cáncer de cuello uterino con genotipificación de VPH y triage citológico, en el subsistema de salud pública de la Provincia de Mendoza y su comparación con los obtenidos previamente, en el screening con citología para la detección de lesiones CIN2+.
Método
Estudio retrospectivo descriptivo que analiza los resultados del screening en pacientes de 30 a 65 años en un período de 30 meses. Se evaluaron 46830 paciente con citología entre 01/08/2017 y 31/01/2020 versus 22692 pacientes con genotipificación VPH entre 1/11/2021 y 30/4/2024. En todos los casos VPH positivos se realizó triage con citología. Todas las mujeres con VPH no 16/18 con citología ASCUS+, y aquellas VPH 16 y/o 18 independientemente de la citología, fueron derivadas a colposcopía y eventual biopsia.Se analizaron los resultados histológicos CIN 2+ de ambos grupos.
Resultados
De las 1363 biopsias realizadas en el grupo tamizado con citología, resultaron 387 CIN2+ (0,82 % del total de citologías). Se obtuvieron 245 CIN2 ( 0,52 %), 60 CIN 3 ( 0,13 %), 18 CIS (0,04%), 52 carcinoma invasor (0,11%), 5 adenoCIS (0,010%), 7 adenocarcinoma (0,014%). De los 22692 tests VPH realizados, 3931 fueron positivos para VPH en general (17,32%). De éstos, 2788 fueron positivos VPH no 16/18 (70,92%), 869 para VPH 16 (22,11%). 243 VPH 18 (6,18%) y 31 para 16 y 18 (0,79%). De los tests VPH positivos se obtuvieron 1232 biopsias con 468 resultados histológicos CIN 2+ (2,06% del total de tests): 270 CIN2 (1,19%), 123 CIN3 (0,54%), 28 CIS (0,12%), 43 carcinoma escamoso invasor (0,19%) y 4 adenocarcinoma invasor (0,02%).
La tasa total de detección de CIN2+ fue claramente mayor en las pacientes tamizadas con el test VPH (20,62/1000) en relación a las estudiadas con citología (8,13/1000), por lo que el cribado con test de VPH nos permitió detectar 2,5 veces más de patología precursora y cáncer cervicouterino.
Conclusión
El tamizaje con genotipificación de VPH y triage citológico ha demostrado ser más efectivo en la detección del cáncer y lesiones precursoras. Esto permite seleccionar a la población con verdadero riesgo, lo que resulta en un screening con mayor costo-efectividad en la Provincia de Mendoza.
Introducción
El cáncer de cuello uterino plantea un importante desafío para la salud en los países en desarrollo, lo que pone de relieve la necesidad de estrategias de detección adecuadas para acelerar la eliminación de esta enfermedad. (1) A pesar de los avances sigue siendo un importante problema de salud pública mundial, con aproximadamente 660.000 casos nuevos en 2022 y 350.000 muertes cada año. (2)
Pocas enfermedades reflejan las desigualdades a nivel mundial como el cáncer de cuello uterino. Su incidencia en los países de bajos y medianos ingresos se duplica y su tasa de mortalidad triplica la de los países de altos ingresos. Más del 94% de las muertes causadas por este cáncer se producen en los países más pobres. Las diferencias regionales de esta patología se relacionan con el acceso a los servicios de vacunación, cribado y tratamiento, los factores de riesgo como prevalencia del VIH y determinantes socio-económicos. Las mujeres con VIH tienen una probabilidad 6 veces mayor de padecer cáncer de cuello uterino en comparación con la población general. Esta enfermedad afecta de manera desproporcionada a las mujeres más jóvenes y a consecuencia de ello el 20% de los niños que pierden a su madre a causa del cáncer, lo hacen debido a esta enfermedad.(3)
En la actualidad no deberían morir mujeres por esta causa. Se cuenta con las herramientas necesarias para prevenirlo. La vacunación profiláctica contra el VPH, el cribado y el tratamiento de las lesiones precancerosas, son medidas eficaces para evitar el cáncer de cuello uterino y tienen una muy buena relación costo beneficio.
La Organización Mundial de la Salud, según las previsiones de incidencia y mortalidad para el 2030, propone una estrategia mundial para la eliminación del cáncer de cuello uterino como problema de salud pública, alcanzando una tasa de incidencia umbral de 4 por 100000 mujeres/año. Sus objetivos son: vacunar al 90% de las niñas antes de los 15 años; que el 70% de las mujeres accedan al test de VPH al menos 2 veces entre los 35 y 45 años de edad; y garantizar el tratamiento del 90% de las mujeres con enfermedad precursora o cáncer de cuello uterino. (2)
La infección por el VPH es muy frecuente: casi todas las personas que tienen relaciones sexuales contraen este virus a pocos años de iniciar la actividad sexual. La mayoría de las infecciones por VPH desaparecen solas sin causar enfermedad. Cuando éstas se hacen persistentes, pueden evolucionar a cáncer de cuello uterino. Ciertos tipos de VPH también dan lugar a cáncer de ano, vulva, vagina, pene y cavidad orofaríngea. La evidencia confirma que la infección persistente con tipos de VPH de alto riesgo oncogénico es la causa primaria del CCU y de la mayoría de las lesiones precursoras. Se estima que deben transcurrir varios años (20 aproximadamente) entre la infección inicial y el desarrollo del cáncer de cérvix. (4,5,6)
En referencia a la prevención secundaria de esta enfermedad, se ha utilizado la detección mediante citología con éxito cuando ha formado parte de programas nacionales con alta cobertura y con disposición de recursos para el seguimiento de pacientes, pruebas diagnósticas complementarias y tratamiento de las lesiones. (7)
En la actualidad, en base a la comprensión de la patogénesis molecular del VPH, se han desarrollado numerosos test moleculares para screening y diagnóstico. Estos han sido propuestos tanto solos como acompañados con citología, con el objetivo de mejorar el desempeño de los programas de prevención de cáncer de cuello uterino.
El test de VPH ocupa un lugar importante como herramienta de tamizaje por su alta sensibilidad y capacidad de descartar patología (alto valor predictivo negativo). Esto explica la ausencia de riesgo de patología invasora por varios años cuando la prueba es negativa. (8)
De todas maneras existe una limitación de este test como prueba de cribado por su menor especificidad para detectar lesiones de alto grado en relación con la citología. Esto hace referencia a que la mayoría de las infecciones por VPH son transitorias y regresan espontáneamente. La dificultad de diferenciar éstas de las infecciones persistentes es lo que podría llevar a un sobrediagnóstico y sobretratamiento. Por este motivo, es necesaria la estrategia que combina pruebas y que permite seleccionar entre todas las pacientes con Test VPH positivo aquellas con verdadero riesgo de tener lesión preneoplásica y requerir una prueba diagnóstica. (9)
Un programa de tamizaje depende de varios factores, siendo el más importante la cobertura de la población objetivo, la participación de la población es la manera más sencilla de mejorar la efectividad de un programa.
En la Provincia de Mendoza se creó por ley 5773 el Programa Provincial de Prevención y Detección Precoz de Cáncer de Cuello Uterino y Mama. Se utilizó como prueba de tamizaje la citología convencional, desde sus inicios hasta fines de 2021. Previo a modificar dicha Ley y con la aprobación del procedimiento de implementación de test de VPH, se reemplazó la mencionada estrategia por el cribado con test de VPH más triage con citología convencional en pacientes de 30 a 65 años, a partir de esa fecha.(10)
Aquí se realiza un estudio que tiene como objetivo analizar los resultados obtenidos en el tamizaje primario para el cáncer de cuello uterino realizado con genotipificación de VPH y triage citológico en el subsistema de salud público de la provincia de Mendoza, en comparación con los obtenidos previamente con el screening citológico para detectar lesiones CIN 2+, en mujeres entre 30 y 65 años.
Material y Métodos
En un estudio retrospectivo descriptivo y comparativo se evaluaron los resultados obtenidos del screening con citología de 46830 pacientes entre el 1/8/17 y el 31/1/2020 versus los resultados logrados luego del tamizaje primario con genotipificación de VPH de 22925 pacientes entre el 1/11/21 y el 30/4/24 realizados en el sector de salud pública de la provincia de Mendoza. Ambos abarcaron a pacientes entre 30 y 65 años.
El test de genotipificación de VPH se realizó con sistema COBAS 4800 PCR real time. Esta técnica identifica 14 genotipos de alto riesgo y reporta individualmente los genotipos 16 y 18. En todos los casos positivos para test de VPH se realizó triage con citología convencional, cuyas muestras fueron obtenidas en el mismo momento del tamizaje con VPH.
Selección de la prueba de screening.
Durante los últimos 15 años, grandes estudios randomizados han brindado importantes conclusiones a favor de la implementación del test de VPH como tamizaje primario. Éste detecta aproximadamente un 30% más de lesiones CIN2+ y un 20% más de lesiones CIN3+ en mujeres mayores de 30 años. Además es importante destacar la mayor detección precoz de lesiones de alto grado persistentes con este método en comparación con la citología.
Necesidad de un triage
| La principal limitación del test de VPH es su menor especificidad para detectar lesiones de alto grado en comparación con la citología. La aplicación de ésta para la prueba de triage cuenta con la mayor evidencia entre los especialistas para la detección de lesiones precursoras y cáncer.
Claramente la elevada especificidad de la citología implica una menor necesidad de colposcopias y de seguimiento.
Una publicación holandesa que comparó diferentes estrategias de triage en el contexto de un programa de tamizaje poblacional, posicionó a la citología como el test de elección y sostiene que su repetición a los 12 meses para población inicialmente negativa para el triage se traduce en un VPP para CIN 3+ de 37.5% (95% CI 32.6–42.6), VPN de 99.3%(95% CI 89.1–99.8) y la menor tasa de derivación colposcópica. (11)
El estudio ATHENA demostró que la mejor estrategia de triage es la aplicación de la citología con el uso del Test de Detección de 14 tipos de VPH de Alto Riesgo más genotipificación de VPH 16 y 18, mostrando una sensibilidad global para CIN3+ de 72.2% (95% CI 66.4–77.4) y un VPP de 13.9% (95% CI 12.8– 15.0). (12)
Selección de población para el estudio:
Todas las mujeres con VPH no 16/18 con citología ASCUS+, y todas las mujeres con VPH 16 y/o 18, independientemente del resultado citológico fueron derivadas para realización de colposcopia y eventual biopsia. Las demás mujeres con test de VPH no 16/18 se remitieron para realización de nuevo test de VPH a los 12 meses. El grupo de mujeres con test de VPH negativo fueron remitidas a la próxima ronda de detección con test de VPH a los 5 años(13); teniendo en consideración los antecedentes de la paciente.
Resultados
Se analizaron los resultados histológicos CIN 2+ surgidos de las biopsias realizadas en ambos grupos de pacientes. Los datos fueron extraídos de la base de datos del Programa Provincial de Prevención y Detección Precoz de Cáncer de Cuello Uterino y Mama de la provincia de Mendoza.(INFOPAP)
Se realizaron 46830 citologías en el periodo entre el 1/8/2017 y el 31/1/2020 (30 meses). De las cuales resultaron 42657 (91,09%) pap negativos, 1321 (2,82%) insatisfactorios, 1086 (2,32%) ASCUS, 52 (0,11%) AGC, 1014 (2,16%) LSIL, 227(0,48%) ASC-H , 404 (0,86%) HSIL y 69 (0,15%) carcinomas invasores.( Tabla n°1)
Tabla N° 1.
|
Insatisf. |
Negativo |
ASCUS |
AGC |
LSIL |
ASC- H |
HSIL |
INVASOR |
|
1321 (2,8%) |
42657 (91%) |
1086 (2,3%) |
52 (0,1%) |
1014 (2,1%) |
227 (0,5%) |
404 (0,9%) |
69 (0,1%) |
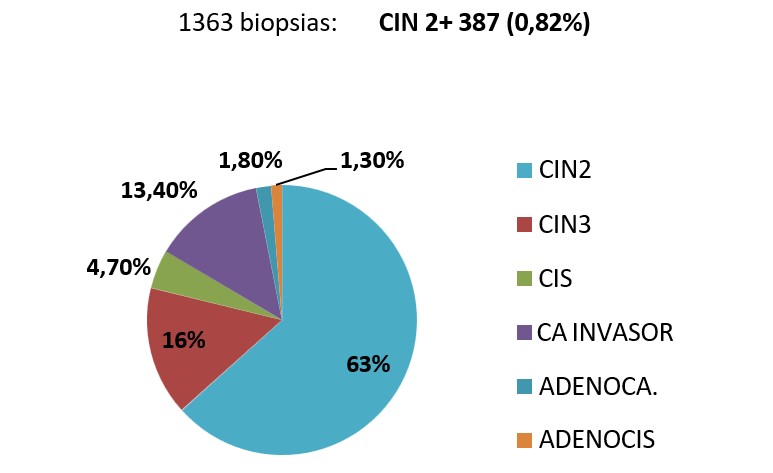
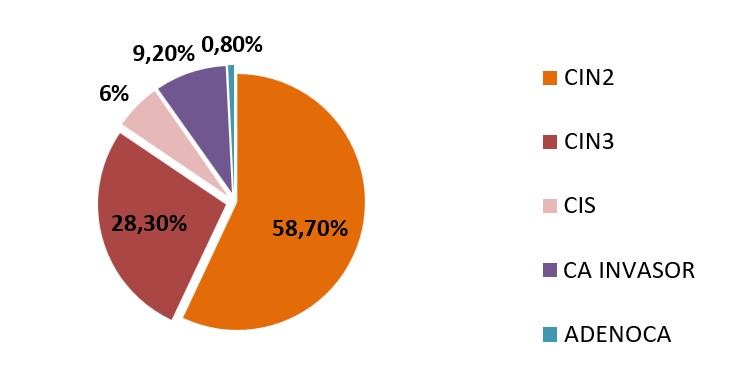
De las 46830 citologías se generaron 1363 (2,91%) biopsias: 387 informaron resultado histológico CIN 2+ (0,82% del total de citologías). Se obtuvieron 245 CIN 2 (0,52%), 60 CIN 3 (0,13%), 18 CIS (0,03%), 52 carcinoma escamoso invasor (0,11%), 5 adenocis (0,01%), 7 adenocarcinoma invasor (0,01%). (Gráfico n° 1)
Grafico n°1.
Se efectuaron 22692 test de VPH entre el 1/11/21 y el 30/4/24, de los cuales 101 (0,44%) resultaron no aptos, 18660 (82,23%) negativos y 3931 (17,32%) fueron positivos para VPH en general. (Gráfico n°2). De estos últimos, 2788 (70,92%) fueron positivos para VPH no 16/18, 869 (22,11%) positivos para VPH 16, 243 (6,18%) VPH 18 positivos, y 31 (0,79%) muestras fueron positivas tanto para VPH 16 como 18.(Gráfico n°3) (Tabla n°2).
Gráfico n°2.
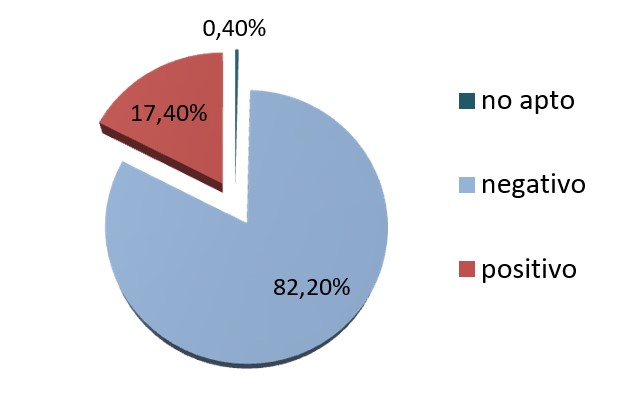
Gráfico n°3.
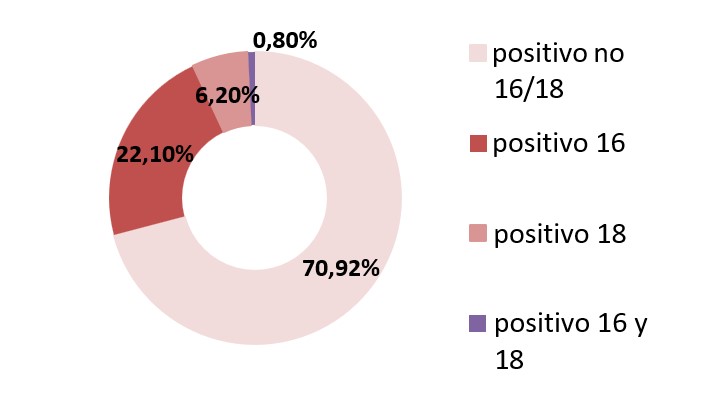
Tabla n°2.
|
No aptos |
negativo |
Positivo no 16/18 |
Positivo 16 |
Positivo 18 |
Positivo 16 y 18 |
|
101 (0,4%) |
18660 (82,2%) |
2788 (12,3%) |
869 (3,8%) |
243 (1,1%) |
31 (0,1%) |
De los 22692 test de VPH realizados se generaron 1232 biopsias (5,43%) De éstas se obtuvieron 468 resultados histológicos CIN 2+ (2,06% del total de tests efectuados). Se informaron 270 CIN2 (1,19%), 123 CIN 3 (0,54%), 28 CIS (0,12%), 43 carcinoma escamoso invasor (0,19%) y 4 adenocarcinoma invasor (0,02%). (Tabla n°3), (Gráfico n°4), (Gráfico n°5).
Tabla n°3
|
CIN 2 + |
Positivo no 16/18 |
Positivo 16 |
Positivo 18 |
Positivo 16y 18 |
|
468 |
172 |
257 |
31 |
8 |
Gráfico n° 4
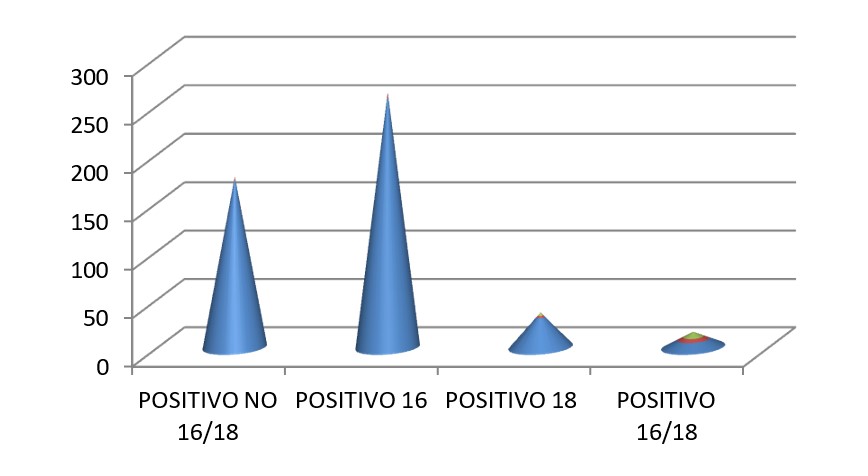
Gráfico n°5.
Resultados finales:
|
Tamizaje (30-65años) |
CITOLOGIA |
TEST DE VPH (triage con citología) |
|
Población con prueba positiva |
2852 |
3931 |
|
Nº biopsias |
1363 |
1232 |
|
Detección CIN 2+ |
387 |
468 |
|
Tasa de detección |
8,13 X 1000 |
20,62x 1000 |
La tasa de detección de CIN 2+ fue significativamente mayor en la cohorte de tamizaje con test de VPH (20,62/1000) frente a la de citología (8,2/1000).
Discusión
Aunque el screening mediante citología ha reducido la incidencia de cáncer cervical invasor en muchos países, aún esta patología continúa siendo una de las principales causas de muerte y enfermedad en mujeres, sobre todo en los países en vías de desarrollo. El VPH es la principal causa de cáncer cervical y en la historia natural de esta enfermedad la infección persistente por VPH precede la aparición de anormalidades citológicas. Estudios de cohorte longitudinales han mostrado que la combinación de test de VPH como tamizaje y triage con citología tiene mayor sensibilidad y brinda mayor protección a largo plazo contra CIN 3 que la citología sola. (14)
La prevalencia de la infección por VPH tiene su pico en las pacientes alrededor de los 20 años, pero esta infección es usualmente transitoria. La especificidad del tamizaje con test de VPH es mayor en mujeres de 35 años o más. La incidencia máxima del cáncer cervical es alrededor de los 40 años, lo que sugiere que la eficacia del test de VPH debería ser mayor cuando se realiza en mujeres entre los 30 y los 40 años. (14)
Aunque la citología tiene una alta especificidad y puede ser útil al estimar el riesgo inmediato, su menor sensibilidad y menor valor predictivo negativo en comparación con el test de VPH reduce la utilidad de la prueba para la predicción del riesgo a largo plazo. Los resultados de las pruebas de VPH solos o con triage con citología permiten alargar los intervalos de seguimiento y diferir la colposcopia por resultados de bajo riesgo. (15)
Numerosos estudios a nivel poblacional indican que la incidencia y la mortalidad por cáncer de cuello uterino disminuyen a medida que aumenta la detección y el tratamiento de anormalidades cervicales histológicas de alto grado. (15)
La OMS recomienda el tamizaje basado en la prueba de VPH en lugar de la citología, cuando haya recursos disponibles, desde 2014. Para el tamizaje primario, la mejora en la sensibilidad reduce la tasa de resultados falsos negativos. Se recomienda la prueba de VPH debido a su mayor sensibilidad en comparación con la citología en la primera detección. También es más probable que la prueba de VPH detecte lesiones precursoras de adenocarcinoma que el tamizaje basado en citología. (16)
La mayor sensibilidad y el mayor rendimiento enfocado en la carcinogénesis cervical conferidos por el test de VPH, en relación a la citología, es lo que permite la prolongación de los intervalos de screening con seguridad. La incorporación de este test en el tamizaje primario requiere la educación de las pacientes y de todo el sistema de salud. Este cambio en el screening de prueba citológica a test de VPH, en conjunto con la educación y la vacunación, contribuirá a un control más eficiente del cáncer cervical. (17)
En un estudio realizado en Suecia con más de 12000 pacientes se encontró que las mujeres de alrededor de 30 años que fueron tamizadas con prueba de VPH junto con citología tuvieron una reducción de aproximadamente el 40% en el riesgo de desarrollar CIN2-3 o cáncer invasor en las rondas de tamizaje posteriores, en comparación con las mujeres tamizadas solo con citología. Esta
reducción permite extender los intervalos de screening, requiriendo menos muestras citológicas y posiblemente disminuyendo los costos del tamizaje. (14)
En mujeres mayores de 30 años se recomienda reemplazar la citología por test de VPH en el tamizaje. La citología debe utilizarse como prueba de triage para los casos positivos de test de VPH. (16)
Existe consenso sobre la superioridad de la prueba del VPH en mujeres mayores de 30 años. La mayoría de los resultados positivos en mujeres jóvenes reflejan infecciones transitorias en lugar de lesiones precursoras. Los resultados positivos en este subgrupo etario pueden llevar a sobrediagnóstico y sobretratamiento, por lo cual no se sugiere realizar este test en mujeres menores de 30 años.
La prueba de VPH es más sensible que la citología y debe utilizarse para la detección primaria. Sin embargo, si la detección se basará únicamente en la prueba de VPH, muchas pacientes serían remitidas a colposcopia innecesariamente, ya que la mayoría de las infecciones por VPH se resuelven inmunológicamente. En cuanto a la relación costo-efectividad, una segunda prueba como triage antes de la colposcopia (citología) mejora la especificidad.
La mujer debe ser derivada a colposcopia para eventual biopsia guiada sólo cuando la prueba de VPH es positiva (sin genotipificación) y la citología es anormal. En caso de existir genotipificación, deben ser derivadas a colposcopia todas las pacientes con VPH 16 y/o 18 y aquellas con VPH no 16/18 y citología ASCUS+. (18)
Se debe suspender el cribado en mujeres mayores de 65 años si han tenido una vigilancia adecuada los últimos 10 años. Si hay antecedente de HSIL+, el tamizaje debe continuar por al menos 25 años después de realizado el tratamiento.(16)
Un tema crítico es que, al ofrecer citología para mujeres menores de 30 años y prueba de VPH para las mayores, ambas tecnologías tienen que estar disponibles simultáneamente, lo que requiere más recursos e induce a su mal uso, por lo cual la educación de todo el personal de salud es de fundamental importancia.
En los países de ingresos altos, la prueba de VPH es rentable debido a su VPN mayor, lo cual permite intervalos de tamizaje prolongados. En los países de ingresos bajos y medianos se debe abordar la rentabilidad. En Argentina se inició este nuevo tamizaje en la provincia de Jujuy, en el año 2012, extendiéndose su uso por distintas provincias, sin llegar aún a abarcar la totalidad de las mismas. Mendoza cuenta con genotipificación para VPH con triage con citología desde noviembre de 2021.
Conclusión
La experiencia en Mendoza con la implementación del tamizaje primario con genotipificación de VPH y triage citológico resultó ser 2,5 veces más eficiente que la citología sola para detectar CIN 2+.
Esta nueva estrategia, en el marco de un programa organizado de cribado para cáncer de cuello uterino, permitió seleccionar a la población con verdadero riesgo, lo que resultó en un screening con mayor costo-efectividad.
Bibliografía
- Boshuang Yao, Jieru Peng, Wei Song, Liu Yang, Meng Zhang, Xia Wu. Real-world effectiveness of citology and HPV-based screening strategy in cervical cancer screening: a cross- sectional population-based study in Chengdu, China. PLoS One. 2024 Feb 29,19(2):e0299651.doi:10.1371/ journal.pone.0299651.eCollection2024.
- Global strategy to accelerate the elimination of cervical cancer as a public health problem]. Ginebra: Organización Mundial de la Salud; 2022.
- Guida, F., Kidman, R., Ferlay, J. et al. Global and regional estimates of orphans attributed to maternal cancer mortality in Nat Med 28, 2563–2572 (2022). https://doi.org/10.1038/s41591-022-02109-2.
- de Martel C, Plummer M, Vignat J, Franceschi S. Worldwide burden of cancer attributable to HPV by site, country and HPV type. International Journal of Cancer. 2017;141(4):664–70. doi:10.1002/ijc.30716.G. McQuillan, D. Kruszon-Moran, L.E. Markowitz, E.R. Unger, R. Paulose
- Prevalence of HPV in adults aged 18-69: United States, 2011-2014. NCHS Data , (2017), 1-8
- Stelze, Dominik et Estimates of the global burden of cervical cancer associated with HIV. The Lancet. 2020. https://doi.org/10.1016/S2214-109X(20)30459-9
- Manual para la implementación del test de VPH en contexto programático / Silvina Arrossi ... [et al.]. - 1a ed . - Ciudad Autónoma de Buenos Aires : Instituto Nacional del Cáncer, 2016.
- Dijkstra MG, Snijders PJ, Arbyn M, Rijkaart DC, Berkhof J, Meijer CJ. Cervical cancer screening: on the way to a shift from cytology to full molecular screening. Ann Oncol. 2014 May;25(5):927-35
- Bosgraaf RP, Siebers AG, De Hullu JA, Massuger LF, Bulten J, Bekkers RL, Melchers The current position and the future perspectives of cervical cancer screening. Expert Rev Anticancer Ther. 2014 Jan;14(1):75-92.
- Procedimiento Implementación del test de VPH como prueba de tamizaje primario para cáncer de cuello uterino. Resolución N° 1215/22. Ministerio de Salud, Desarrollo Social y Deportes - Subsecretaría de Salud.
- Dijkstra MG, van Niekerk D, Rijkaart DC, van Kemenade FJ, Heideman DA, Snijders PJ, Meijer CJ, Berkhof J. Primary hrHPV DNA testing in cervical cáncer screening: how to manage screen-positive women? A POBASCAM trial substudy. Cancer Epidemiol Biomarkers Prev. 2014 Jan;23(1):55-63.
- Castle PE, Stoler MH, Wright TC Jr, Sharma A, Wright TL, Behrens CM. Performance of carcinogenic human papillomavirus (HPV) testing and HPV16 or HPV18 genotyping for cervical cancer screening of women aged 25 years and older: a subanalysis of the ATHENA study. Lancet Oncol. 2011 Sep; 12(9):880–90.
- Guía de procedimientos para la implementación del test de VPH como tamizaje primario del cáncer de cuello uterino en la Provincia de https//prevencioncancermujer.mendoza.gov.ar.
- Naucler P, Ryd W, Tomberg S, Strand A, Wadell G, Efgren C, Rádberg T, Strander B, Johansson B, Forslund O, Hansson B, Rylander E, Dillner J. Human Papillomavirus and Papanicolaou tests to screen for Cervical Cancer. N Engl J Med 2007.357:16.
- Perkins R, Guido R, Castle P, Chelmow D, Einstein M, García F, Huh W, Kim J, Moscicki AB, Nayar R, Saraiya M, Sawaya G, Wentzensen N, Schiffman M, para el Comité de Directrices de Consenso de Gestión Basada en el Riesgo de ASCCP de 2019. Consenso de gestión basada en riesgos de la ASCCP de 2019. Pautas para la detección anormal del cáncer de cuello uterino. Pruebas y precursores del Cáncer.
- Carvalho C, Teixeira J, Braganza J, Derchein S, Zeferino L, Vale,D. Detección de cáncer de cuello uterino con prueba de VPH: Actualizaciones sobre la recomendación. Rev Bras Ginecol Obstet 2022;44(3):264-271.
- Mayrand MH, Duarte-Franco E, Rodrigues I, Walter S, Hanley J, Ferenczy A, Ratnam S, Coutlée F, Franco E for the Canadian Cervical Cancer Screening Trial Study Group. Human Papillomavirus DNA versus Papanicolaou Screening Tests for Cervical Cancer. N.Engl.J.Med 2007,357;16.
- AEPCC- Guía: Prevención secundaria del cáncer de cuello de útero, 2022. Conducta clínica ante resultados anormales de las pruebas de Coordinador: Torné A. Secretaria: del Pino M. Autores: Torné A; Andía D; Bruni L; Centeno C; Coronado P; Cruz Quilez J,; de la Fuente J; de Sanjosé S; Grandados R; Ibañez R; Lloveras B; Lubrano A; Matías Guiu X; Medina N; Ordi J; Ramírez M; del Pino M.
1. Ministerio de Salud de la Provincia de Mendoza. Casa de la Salud de la Mujer. Programa Provincial de Prevención y Detección Precoz de Cáncer de Cuello Uterino y Mama.
Mendoza. Argentina.