Infección por Parvovirus B19 durante el Embarazo: Caracterización Clínica, Diagnóstico y Recomendaciones para la Detección Temprana
Autores:
Dra. María Pilar Adamo1, Biól. María Belén Colazo Salbetti1, Mgtr. Gabriel Amilcar Boggio2, Dra. Laura Moreno2.
Resumen
Entre el año 2023 y el 2024 se ha observado un brote epidémico con elevada incidencia de infecciones por parvovirus B19. Este virus, responsable del eritema infeccioso, infecta las células progenitoras eritroides y puede provocar complicaciones severas, especialmente en embarazadas sin inmunidad previa. Por ello, es necesario aumentar la conciencia sobre este patógeno entre las enfermedades de transmisión materno-infantil, así como optimizar el diagnóstico de infección por B19V durante la gestación. Este artículo aborda las características clínicas, la transmisión vertical y los efectos del parvovirus humano B19 (B19V) en el embarazo, con un análisis basado en casos de Córdoba, Argentina. Se destaca la importancia de incluir el B19V en la pesquisa TORCH y realizar estudios serológicos y moleculares tempranos. La sospecha clínica y el diagnóstico oportuno pueden reducir las complicaciones fetales y mejorar los resultados perinatales.
Palabras clave: embarazo, infección congénita, anemia, TORCH, hidropesía fetal, aborto.
Abstract
Between 2023 and 2024, an epidemic outbreak with a high incidence of parvovirus B19 infections has been observed. This virus, responsible for erythema infectiosum, infects erythroid progenitor cells and can cause severe complications, particularly in pregnant women without prior immunity. Therefore, raising awareness about this pathogen among maternal-fetal transmission diseases and optimizing the diagnosis of B19V infection during pregnancy are crucial. This article discusses the clinical features, vertical transmission, and effects of human parvovirus B19 (B19V) in pregnancy, with an analysis based on cases from Córdoba, Argentina. It emphasizes the importance of including B19V in TORCH screening and performing early serological and molecular studies. Clinical suspicion and timely diagnosis can reduce fetal complications and improve perinatal outcomes.
Keywords: pregnancy, congenital infection, anemia, TORCH, fetal hydrops, miscarriage.
Desde la primavera septentrional 2023, se ha reportado un aumento inusual de infecciones por parvovirus humano B19 (B19V). El brote se incrementó en el último trimestre de 2023 alcanzando su pico en abril de 2024 (1–4). Por este motivo, y debido a que la circulación viral típicamente aumenta entre finales del invierno e inicio del verano, es posible anticipar que en el hemisferio sur el número de casos aumente a partir de la primavera de 2024.
B19V es el agente etiológico del eritema infeccioso, una enfermedad generalmente benigna y común en la niñez (5).
La transmisión ocurre principalmente a través de secreciones respiratorias, pero también por sangre o productos sanguíneos contaminados (6,7). La incidencia es mayor en la niñez; a pesar de ello, hasta 50% de las mujeres en edad fértil son susceptibles al virus y se ha reportado una frecuencia infección primaria durante el embarazo de 13,5 a 31,6% (8–10). Se estima que la tasa de transmisión vertical es del 25 al 50% y el riesgo de resultados fetales adversos puede alcanzar el 19% en períodos epidémicos (11–13).
La infección postnatal está asociada a manifestaciones inespecíficas durante el pródromo (no siempre presente) como malestar general y síndrome pseudogripal. En los niños se produce el exantema maculopapular reticular con eritema en el rostro y en los adultos son más comunes las artropatías (artritis/artralgia), si bien el 25 a 50% de los casos pueden ser asintomáticos (14,15).
El virus se replica eficientemente en células progenitoras eritroides de la médula ósea e hígado fetal, provocando la muerte celular. Además, la infección no productiva en tejidos no eritroides, donde el virus no completa su ciclo de replicación, activa respuestas inflamatorias (16). Durante la producción eritrocitaria, el virus aprovecha la mitosis celular, alcanzando altas cargas virales que disminuyen el recuento de reticulocitos y hemoglobina. Esto es particularmente grave en pacientes con enfermedades hematológicas preexistentes, en quienes la primoinfección por B19V puede ocasionar una crisis de anemia aplásica (17). En inmunocomprometidos, la replicación viral prolongada puede también derivar en depleción de eritrocitos (18). Las embarazadas susceptibles, sin anticuerpos específicos tipo G, constituyen otro grupo de riesgo, ya que el B19V puede transmitirse por vía transplacentaria y causar complicaciones fetoneonatales, no con frecuencia pero sí graves (4). Los efectos citotóxicos y mecanismos apoptóticos de B19V producen arresto de la eritropoyesis que puede resultar en anemia, hipoxia tisular, miocarditis y derrame pericárdico, causando patologías placentarias y complicaciones como aborto, insuficiencia cardíaca, insuficiencia renal, hidropesía y muerte fetal intrauterina hidrópica o no hidrópica (4,19). Las manifestaciones clínicas relacionadas con la infección congénita por B19V son conocidas y están incluidas en el síndrome TORCH (Toxoplasmosis, Rubéola, Citomegalovirus, Herpes, Sífilis, Otros) (20).
El diagnóstico de infección congénita por B19V se puede realizar mediante ensayos serológicos y moleculares en la madre, el feto y/o el neonato. En los casos en los que faltan datos clínicos de la embarazada, la ausencia de detección de IgM en suero materno puede ser engañosa, ya que entre el inicio de la infección materna y la aparición de manifestaciones clínicas fetales pueden transcurrir hasta 20 semanas. Para entonces la IgM materna ya puede haber descendido a niveles indetectables. En la sangre fetal, la presencia de IgG indica inmunidad adquirida pasivamente de la madre, con una transferencia de inmunoglobulinas que aumenta desde el segundo trimestre hasta el término, mientras que la ausencia de IgM puede deberse a la inmadurez del sistema inmunológico fetal. Consideraciones similares se aplican al diagnóstico de recién nacidos. Por lo tanto, la combinación de detección directa (ensayos moleculares) con pruebas serológicas mejora la precisión diagnóstica de la infección congénita (21,22).
En Argentina, el diagnóstico de B19V no está completamente estandarizado. La inclusión en la pesquisa de infecciones del grupo TORCH depende habitualmente de las directrices del centro de atención sanitaria. En muchos casos la infección suele pasar desapercibida, o se arriba a un diagnóstico tardíamente, lo que representa un problema de salud pública dentro de las enfermedades de transmisión maternoinfantil.
Este artículo tiene como objetivo ofrecer una actualización sobre los avances más recientes en relación a la infección por B19V durante la gestación en nuestro entorno, con el fin de proporcionar una síntesis clara junto con aspectos clave a considerar durante el abordaje diagnóstico para estos casos.
Caso clínico: infección por B19V en paciente embarazada con hidropesía grave, muerte fetal y persistencia viral
En el 2022 reportamos un caso de infección por B19V en una embarazada diagnosticada durante el segundo trimestre de gestación, con desenlace fatal para el feto y persistencia viral materna (23). La paciente (G2P1), de 33 años, inmunocompetente y sin comorbilidades previas, cursaba un embarazo controlado cuando a las 22 semanas de gestación (SG) presentó contracciones intermitentes inadecuadas para la edad gestacional y pérdida de líquido. Durante la evaluación física se constataron signos vitales y movimientos fetales normales pero en la ecografía se identificó la presencia de hidropesía y ascitis fetal. Además, la ecografía Doppler reveló anemia fetal con flujo elevado en la arteria cerebral media y signos de hidropesía generalizada, con derrame pleural y pericárdico. Tras descartar causas inmunológicas, cardiacas y cromosómicas, así como otras posibles causas infecciosas (TORCH), la determinación serológica de IgM anti-B19V resultó positiva en el suero materno. La paciente recibió dos transfusiones intrauterinas para tratar la anemia fetal con buena respuesta inicial, pero tras la segunda transfusión se desencadenó bradicardia fetal y derrame pericárdico, con desenlace de la muerte fetal. Tras la inducción del parto, la expulsión del feto muerto se produjo en 48 horas; la paciente fue dada de alta sin complicaciones. Se realizó un seguimiento del caso, analizando los marcadores serológicos y virológicos en la paciente, hasta el año y medio posterior a la muerte fetal, con muestras tomadas a intervalos de 6 meses. Dos semanas después del diagnóstico confirmatorio y de la muerte fetal, la IgM ya no era detectable, mientras que los niveles de IgG aumentaron significativamente. Esta cinética de IgG específica, junto con la detección inicial de IgM, apoya el diagnóstico de una infección aguda por B19V. Además, el ADN viral se mantuvo detectable en dos determinaciones posteriores al parto, evidenciando el curso prolongado de esta infección en la madre tras la fase aguda. En este caso, los parámetros fetales críticos fueron los signos marcadores y revelaron la gravedad del cuadro clínico sin signos maternos previos que permitieran sospechar precozmente la infección. Tras descartar otras posibles causas, se confirmó la infección por B19V mediante IgM específica en el suero materno. Si el análisis serológico se hubiera realizado más tarde, sólo la detección del ADN viral hubiera permitido identificar la infección materna.
Caso clínico: hidropesía fetal asociada a infección vertical por B19V
Se trata de un recién nacido prematuro con infección vertical por B19V con antecedentes prenatales de hidropesía fetal (24). En este caso la infección parvoviral fue sospechada oportunamente pero el diagnóstico prenatal enfrentó dificultades en su aproximación e interpretación, lo que llevó a descartar erróneamente al B19V como posible agente causal de la patología fetal. El recién nacido de 36 SG presentó peso adecuado para la edad gestacional (2950 g) y la madre de 30 años de edad (G3P1), con embarazo controlado, no tenía comorbilidades previas. Durante el primer trimestre de gestación la madre presentó anemia y edemas en los miembros inferiores -signos asociados a infección por B19V- mientras que a las 17 SG se detectó higroma fetal. Se realizó amniocentesis que resultó en cariotipo normal. En el segundo trimestre (22 SG) se identificaron los primeros signos ecográficos de ascitis fetal y polihidramnios. La pesquisa de agentes TORCH (incluyendo HIV y sífilis) resultó negativa. En la SG 26 se solicitó serología materna para B19V, resultando IgG positiva e IgM negativa, lo que llevó a descartar erróneamente una infección aguda por parvovirus. La madre, 0 Rh negativo, recibió inmunoglobulina anti-D en la SG 28 para prevenir complicaciones de incompatibilidad. La prueba de Coombs resultó negativa tanto en la madre durante la gestación como en el recién nacido. Debido a una colestasis biliar materna, el nacimiento se adelantó a las 36 SG. Al nacer, el neonato presentó abdomen globuloso y hepatomegalia, con una adecuada adaptación cardiorrespiratoria, recibiendo el diagnóstico de hidropesía fetal no inmune. Las pruebas para infecciones TORCH fueron negativas, pero la detección de B19V mediante PCR confirmó la presencia del genoma viral con IgM negativa, indicando infección vertical. A partir de una nueva muestra, se repitieron los ensayos serológicos en la madre incluyendo la PCR; sin embargo, tanto el ADN viral como la IgM, marcadores de infección aguda, fueron negativos. El neonato prematuro presentó distensión abdominal (ascitis), ictericia y anemia progresiva durante los primeros 17 días con buena evolución al alta. Este estudio demuestra que cuando se sospecha de infección por B19V durante la gestación y sólo se solicita la serología en sangre materna, se puede arribar a un diagnóstico equivocado ya que los anticuerpos maternos pueden ya no ser detectables cuando aparecen signos fetales. Por ello es recomendable complementar con la detección molecular del virus en la madre (PCR), así como en muestras fetales, en caso de ser posible. Por ejemplo, en este caso durante la intervención de amniocentesis debería haberse realizado PCR y serología para B19V.
Estudio de pacientes embarazadas y recién nacidos sintomáticos y asintomáticos de Córdoba
Recientemente, realizamos un estudio descriptivo para analizar la presencia del B19V durante el embarazo en pacientes de la ciudad de Córdoba (25). Explorando los datos de las historias clínicas se seleccionaron pacientes con signos maternos y/o feto-neonatales atribuibles a B19V, incluyendo las manifestaciones típicas de la infección postnatal, como fiebre, artropatías, exantema, anemia materna (Hb<110 g/dL) y signos prenatales o al momento del nacimiento, como anemia e hidropesía. Evaluamos la presencia de B19V en 328 pacientes sintomáticos y 310 asintomáticos. Dentro del grupo de embarazadas, 185 presentaron síntomas y 208 fueron asintomáticas. Además, se analizaron muestras de sangre de cordón umbilical de recién nacidos, incluyendo 143 sintomáticos y 102 asintomáticos. Las embarazadas sintomáticas fueron catalogadas en dos grupos según el momento de toma de la muestra clínica. Por un lado las pacientes con diagnóstico oportuno (n=73), con muestra de sangre obtenida cuando los signos y síntomas estaban presentes y se sospechó la infección; mientras que el otro grupo incluyó pacientes con diagnóstico retrospectivo (n=112), cuya muestra de sangre se recolectó en el postparto inmediato. Así, los grupos de estudio representaron los casos que pueden observarse en la práctica clínica, tanto en contextos de sospecha oportuna como tardía de infección congénita por B19V. En todas las muestras se determinó la presencia del genoma viral por PCR de punto final y los anticuerpos específicos, IgM e IgG. Además, en las muestras ADN positivas, se evaluó la carga viral mediante PCR en tiempo real. Para lograr un análisis preciso, identificamos a los casos positivos según la combinación de parámetros serológicos y moleculares en conjunto con el contexto clínico de cada paciente. Este enfoque nos permitió evaluar de manera integral el estado de la infección, particularmente en casos con combinación de parámetros dudosos, como cuando la detección del ADN viral y la IgM no resultó positiva simultáneamente. La interpretación de los datos laboratoriales se hizo tomando como referencia la cinética de antígenos y anticuerpos durante la infección (Fig.1). Particularmente, durante la gestación los signos clínicos marcadores pueden ser observados sólo en el feto, pudiendo aparecer hasta 20 semanas después de la infección materna. Para este momento, la IgM materna puede estar aún detectable o no, y similar consideración debe tenerse en cuenta con el ADN viral. Por lo tanto, para el grupo de pacientes embarazadas consideramos como positivas aquellas que tenían IgM e IgG, pudiendo estar presente o no el ADN viral. Además, se consideraron positivas las embarazadas sin IgM específica detectable pero con una carga viral mayor a 105 UI/mL (superior al valor de corte sugerido en otros estudios). Entre los recién nacidos, cualquier combinación de ADN viral con IgM (no siempre presente) se consideró indicativo de infección.
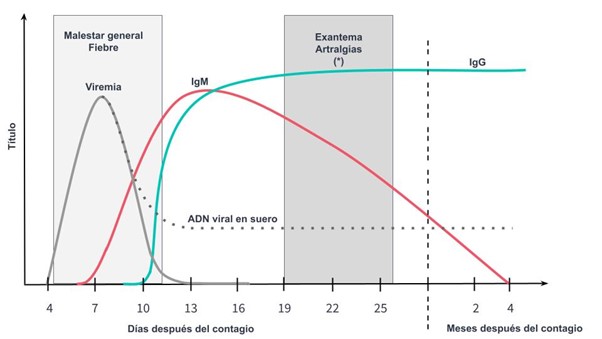
Fig.1. Cinética con las curvas de marcadores virológicos y serológicos en la infección postnatal de un individuo inmunocompetente y previamente sano.
Se puede observar que tanto el ADN viral como la IgM pueden permanecer detectables por varias semanas, incluso meses, luego del contagio o inicio de la infección. Particularmente, el ADN puede continuar circulando a bajo título por períodos más prolongados (años, en algunos casos). El pico de viremia, que ocurre entre los 5 y 10 días posteriores al contagio, se asocia con una fase prodrómica, la cual no siempre está presente. Esta etapa se caracteriza por síntomas inespecíficos, como fiebre, astenia, mialgias, cefalea y malestar general. Posteriormente, entre los 14 y 21 días desde el contagio, pueden aparecer las manifestaciones específicas de la infección (exantema y/o artralgias). (*) En la infección congénita los signos fetales como anemia, ascitis, hidropesía, entre otros, que aparecen semanas o meses después de la fase aguda materna , pueden ser los signos marcadores. En estos casos, la sospecha clínica puede ocurrir cuando la IgM materna ha caído a niveles indetectables.
La frecuencia global de casos positivos en pacientes sintomáticos fue 8% (27/328), 16% (12/73) en el grupo con diagnóstico oportuno, 5% (6/112) en diagnóstico retrospectivo y 6% (9/143) entre los recién nacidos. La diferencia entre el diagnóstico oportuno y el retrospectivo fue significativa (p = 0.02), pero no se encontró diferencia al analizar las combinaciones de parámetros confirmatorios entre ambos grupos (p = 0.72). Además, en sintomáticos, se analizaron muestras pareadas de 77 binomios madre-recién nacido confirmando 6 casos de transmisión vertical; 3 recién nacidos fueron asintomáticos y 3 presentaron síndrome TORCH. La frecuencia de detección global en asintomáticos fue 8% (26/310), no siendo estadísticamente diferente en comparación con el grupo de sintomáticos (p=0.22). En las pacientes sintomáticas con diagnóstico oportuno se identificaron manifestaciones clínicas típicas, como exantema, anemia y artropatías. Además tanto embarazadas como recién nacidos mostraron signos asociados con la infección congénita, incluyendo patologías placentarias (edema, polihidramnios), hepatoesplenomegalia, retraso del crecimiento intrauterino, prematurez, cardiopatía, ascitis e hidropesía fetales, aborto espontáneo y muerte fetal. Entre los recién nacidos hubo casos en los que el síndrome TORCH fue el único dato registrado en la historia clínica. Por otro lado, la anemia materna, caracterizada por niveles de hemoglobina inferiores a los valores considerados normales para el embarazo, fue la manifestación clínica más frecuente en pacientes con diagnóstico retrospectivo. La alta frecuencia detectada evidencia la necesidad de incrementar la sospecha de B19V en esta población de riesgo y de mejorar los protocolos de diagnóstico para la identificación y manejo de estos casos. La alta frecuencia de detección en el grupo de embarazadas sintomáticas con diagnóstico oportuno, demuestra que la sospecha clínica temprana incrementa significativamente las posibilidades de arribar a un diagnóstico etiológico certero.
Conclusiones
Estos estudios pusieron en evidencia que el algoritmo diagnóstico de B19V para infección congénita en nuestro medio requiere ser revisado. Por diferentes razones se subestima su importancia, lo que ocasiona demoras en el diagnóstico y dificultades en el manejo clínico de los pacientes.
La sospecha temprana incrementa las posibilidades de alcanzar un diagnóstico oportuno, que se podría facilitar si se considera al B19V dentro del espectro de las agentes del grupo TORCH. Por otra parte, ampliar la definición de caso de enfermedad parvoviral incluyendo la anemia materna como marcador clínico y factores de riesgo epidemiológico también serviría como elemento clave para evaluar la posible transmisión vertical. Cuando se sospecha de infección materna, es recomendable intensificar los controles mediante ultrasonido con el objetivo de detectar los signos fetales característicos de la infección intrauterina. No obstante, cuando la sospecha es tardía, aún es posible confirmar el diagnóstico mediante ensayos de laboratorio complementarios (serología y PCR) debidamente interpretados. El aporte de la cinética de los marcadores serológicos y moleculares es de utilidad para orientar las decisiones ante situaciones particulares.
Para identificar y gestionar eficazmente las infecciones por B19V durante el embarazo es necesario colocar a este agente bajo el radar. Para realizar un diagnóstico laboratorial oportuno se debe considerar incorporar tempranamente ensayos moleculares (PCR); además, es necesario comprender la historia natural de la infección durante la gestación, las manifestaciones clínicas, los marcadores virológicos y serológicos en los casos maternos, fetales y neonatales, así como la epidemiología local, para su correcta interpretación.
Referencias
- Patalon T, Saciuk Y, Trotzky D, Pachys G, Ben-Tov A, Segal Y, et al. An Outbreak of Parvovirus B19 in Israel. Viruses. 2023 Nov 16;15(11):2261.
- Ceccarelli G, Branda F, Ciccozzi A, Romano C, Sanna D, Casu M, et al. Reassessing the Risk of Severe Parvovirus B19 Infection in the Immunocompetent Population: A Call for Vigilance in the Wake of Resurgence. Viruses. 2024 Aug 24;16(9):1352.
- Farcet MR, Karbiener M, Aberham C, Powers N, Aue D, Kreil TR. Parvovirus B19 rebound outbreak 2024 and implications for blood- and plasma-product safety. Transfusion (Paris) [Internet]. 2024 [cited 2024 Nov 4];n/a. Available from: https://onlinelibrary.wiley.com/doi/abs/10.1111/trf.18032
- Kagan KO, Hoopmann M, Geipel A, Sonek J, Enders M. Prenatal parvovirus B19 infection. Arch Gynecol Obstet [Internet]. 2024 Jul 29 [cited 2024 Aug 4]; Available from: https://doi.org/10.1007/s00404-024-07644-6
- Leung AKC, Lam JM, Barankin B, Leong KF, Hon KL. Erythema Infectiosum: A Narrative Review. Curr Pediatr Rev. 2024;20(4):462–71.
- Sun P, Jiang P, Liu Q, Zhang R, Wang Z, Cao H, et al. Parvovirus B19 DNA and antibodies in Chinese plasma donors, plasma pools and plasma derivatives. PeerJ. 2023;11:e15698.
- Suter C, Colakovic M, Bieri J, Gultom M, Dijkman R, Ros C. Globoside and the mucosal pH mediate parvovirus B19 entry through the epithelial barrier. PLoS Pathog. 2023 May;19(5):e1011402.
- Jensen IP, Thorsen P, Jeune B, Møller BR, Vestergaard BF. An epidemic of parvovirus B19 in a population of 3596 pregnant women: A study of sociodemographic and medical risk factors. BJOG Int J Obstet Gynaecol. 2000;107(5):637–43.
- van Gessel PH, Gaytant MA, Vossen ACTM, Galama JMD, Ursem NTC, Steegers EAP, et al. Incidence of parvovirus B19 infection among an unselected population of pregnant women in the Netherlands: A prospective study. Eur J Obstet Gynecol Reprod Biol. 2006;128(1–2):46–9.
- Barlinn R, Rollag H, Trogstad L, Vainio K, Basset C, Magnus P, et al. High incidence of maternal parvovirus B19 infection in a large unselected population-based pregnancy cohort in Norway. J Clin Virol. 2017 Sep 1;94:57–62.
- Yaegashi N, Niinuma T, Chisaka H, Uehara S, Okamura K, Shinkawa O, et al. Serologic study of human parvovirus B19 infection in pregnancy in Japan. 1999;38(1):30–5.
- Enders M, Weidner A, Zoellner I, Searle K, Enders G. Fetal morbidity and mortality after acute human parvovirus B19 infection in pregnancy: Prospective evaluation of 1018 cases. Prenat Diagn. 2004;24(7):513–8.
- Enders M, Klingel K, Weidner A, Baisch C, Kandolf R, Schalasta G, et al. Risk of fetal hydrops and non-hydropic late intrauterine fetal death after gestational parvovirus B19 infection. J Clin Virol. 2010;49(3):163–8.
- Tolfvenstam T, Broliden K. Parvovirus B19 infection. Semin Fetal Neonatal Med. 2009 Aug 1;14(4):218–21.
- Torun C. Parvovirus B19 Infection in Adults: A Case Series. Cureus. 2024 Jun 25;16(6):e63169.
- Ganaie SS, Qiu J. Recent advances in replication and infection of human parvovirus B19. Front Cell Infect Microbiol. 2018 Jun 5;8(JUN):166.
- Fukui S, Hojo A, Sawada U, Kura Y. Aplastic crisis due to human parvovirus B19. IDCases. 2023 Jun 16;33:e01820.
- Mogensen TH, Skouboe MK, Mølle I. Successful use of interferon alfa-2a for persistent parvovirus B19 infection. Lancet Infect Dis. 2023 Apr;23(4):e160–5.
- Boissiere J, Watkins V, Kuller JA, Dotters-Katz SK. Parvovirus B19 in Pregnancy. Obstet Gynecol Surv. 2024 May;79(5):281–9.
- Penner J, Hernstadt H, Burns JE, Randell P, Lyall H. Stop, think SCORTCH: rethinking the traditional ‘TORCH’ screen in an era of re-emerging syphilis. Arch Dis Child. 2021 Feb 1;106(2):117–24.
- Attwood LO, Holmes NE, Hui L. Identification and management of congenital parvovirus B19 infection. Prenat Diagn. 2020;40(13):1722–31.
- Bonvicini F, Puccetti C, Salfi NCM, Guerra B, Gallinella G, Rizzo N, et al. Gestational and Fetal Outcomes in B19 Maternal Infection: a Problem of Diagnosis. J Clin Microbiol. 2020 Dec 21;49(10):3514–8.
- Bertoldi A, Colazo Salbetti MB, Rodríguez G, Tenaglia M, Hernández G, Alfaro J, et al. Human parvovirus B19 infection in a pregnant patient resulting in severe hydrops, foetal death and persistent infection. Access Microbiol. 2022 Oct 3;4(10):acmi000428.
- Boggio GA, Moreno L, Di Cuatro N, Colazo Salbetti MB, Pedranti M, González A, et al. Human parvovirus B19 vertical infection and hydrops fetalis. A case report. Arch Argent Pediatr. 2024 Oct 17;e202410420.
- Colazo Salbetti MB, Boggio G, Dicuatro N, Gudiño AP, Olivera N, Pedranti M, et al. Parvovirus B19 remains an underestimated pathogen among infections during gestation in Argentina: Insights through the study of symptomatic and asymptomatic pregnant patients and newborns from Córdoba. J Clin Virol. 2024 Dec 1;175:105739.
1. Instituto de Virología “Dr. J. M. Vanella”, Facultad de Ciencias Médicas, Universidad Nacional de Córdoba.
2. Cátedra de Clínica Pediátrica, Facultad de Ciencias Médicas, Universidad Nacional de Córdoba.